大肠杆菌不耐热肠毒素无毒突变体mLT63毒性检测及佐剂效果研究*
2010-08-21白雪飞郭静玉雷万军段广才
白雪飞,郭静玉,雷万军,段广才
大肠杆菌不耐热肠毒素无毒突变体mLT63毒性检测及佐剂效果研究*
白雪飞,郭静玉,雷万军,段广才
目的对已构建的大肠杆菌不耐热肠毒素无毒突变体mLT63进行表达、纯化、毒性检测,并对其佐剂活性进行研究。方法 采用已知的最佳诱导表达条件进行诱导表达,诱导表达产物经亲和层析、纯化浓缩后,进行毒性检测。将纯化后的mLT63联合幽门螺旋杆菌(Hp)亚单位疫苗UreB、Omp11经口途径免疫BALB/c小鼠,免疫后取血清、胃组织提取液、粪便提取液进行ELISA试验,检测其中的特异性抗体水平,将结果进行统计分析。结果 经家兔回肠袢毒性试验验证本室构建大肠杆菌不耐热肠毒素无毒突变体mLT63没有毒性,mLT63联合Hp亚单位疫苗UreB、Omp11免疫小鼠实验证实mLT63具有佐剂活性。结论 本室构建、表达的大肠杆菌不耐热肠毒素无毒突变体mLT63无毒,并具有免疫佐剂的活性。
大肠杆菌不耐热肠毒素;突变体;佐剂
Email:baix uefei2003@126.com
应用生物技术得到的纯化抗原往往在粘膜表面接种时免疫原性较弱,并且容易诱导免疫耐受。为加强局部粘膜免疫,激活粘膜免疫应答,使疫苗发挥最大作用,可通过在疫苗中加入适当的免疫佐剂进行免疫接种。较理想的粘膜佐剂应该高效、安全,能激活粘膜免疫系统,在其存在的情况下抗原经粘膜供给可引发抗原特异性的全身和粘膜局部的体液和细胞介导的免疫应答。
大肠杆菌不耐热肠毒素(heat-labile enterotoxin,LT)是产肠毒素性大肠杆菌(enterotoxigenicEscherichia coli,ET EC)产生的一种对热敏感的毒素,是引起人及哺乳动物腹泻的主要因素之一。LT是迄今为止发现作用最强的免疫原之一,并且具有很好的粘膜免疫佐剂作用,它能通过增加抗原的摄入和呈递,有效地在粘膜水平提高免疫原性,还能诱导B细胞成熟和免疫刺激细胞因子的产生〔1〕。此外,LT不能诱导耐受并且能够中止耐受诱导。但LT的高毒性限制了它的应用,利用基因工程构建的LT无毒衍生物突变体能够弥补这样的不足。LT第63位氨基酸突变,使丝氨酸诱变为赖氨酸,使得LTA失去NAD蛋白结合位点,即可无毒并具有较强的免疫原性和佐剂性,极有可能成为适用于人体的粘膜免疫佐剂〔2〕。本研究对已构建的 TB1(pMAL-c2X-mlt)原核表达系统进行诱导、表达及纯化,并将表达产物进行毒性检测和佐剂活性检测。
1 材料与方法
1.1 材料
1.1.1 菌株 基因工程重组菌 TB1(pMAL-c2X-mlt)由申晓靖等人构建并保存〔3〕。
1.1.2 实验动物 日本大耳白家兔(CV级),购自河南省实验动物中心,雌性,4kg。6-8周龄BALB/c小鼠30只(CV级),雌雄各半,购自河南省实验动物中心。
1.1.3 主要仪器 DYY-Ⅲ型垂直电泳槽(北京六一仪器厂),半干式电转移槽(BIORAD公司),JY92-Ⅱ超声波细胞粉碎机(上海新芝生物技术研究所),凝胶图像分析仪(美国syugene),直链淀粉亲和层析预装柱(New England Biolabs公司)。
1.1.4 主要试剂 丙烯酰胺、甲叉丙烯酰胺、β-巯基乙醇、四甲基已二胺(TEMED)等购自Sigma公司,二氨基联苯胺(DAB)购自 Roche公司,IPTG购自TaKaRa公司,兔抗霍乱毒素(CT)购自Sigma公司,羊抗兔HRP-IgG购自北京邦定泰克生物技术有限公司。
1.2 方法
1.2.1 TB1(pMAL-c2X-mlt)的诱导表达 将鉴定过的阳性克隆菌落接种到5mL含氨苄青霉素的LB液体培养基中,37℃振摇过夜,取50μ L菌液加入5mL含氨苄青霉素的LB液体培养基中,振摇至对数中期,加入 IPTG诱导。TB1(pMAL-c2X-mlt)在37 ℃、pH 7.5-8.0、IPTG 浓度为 0.2 mmol/L、不含葡萄糖的培养基中诱导6h能够达到最大的表达量〔4〕。
1.2.2 诱导表达产物的处理 将大量诱导完成后的菌液进行超声粉碎、盐析沉淀,得到的蛋白粗提物进行亲和层析纯化,纯化后的mLT63进行蛋白定量,确定终浓度。
1.2.3 融合蛋白的毒性检测 日本大耳白家兔禁食24 h后,局部常规消毒铺巾,乙醚麻醉,沿腹正中线开腹,选择回肠袢,沿回盲部向上行走4-6cm开始结扎,共结扎8段,每段5 cm,每两段之间间隔5 cm,每段肠管均注入0.5mL样品,并标记顺序,关腹,具体样品量见表1。家兔继续禁食24 h后,氯仿麻醉处死,剖腹观察回肠袢外观,抽取每段肠管内的液体,计量做比较。采用本室纯化的LT(0.5 mg/mL)做为阳性对照。
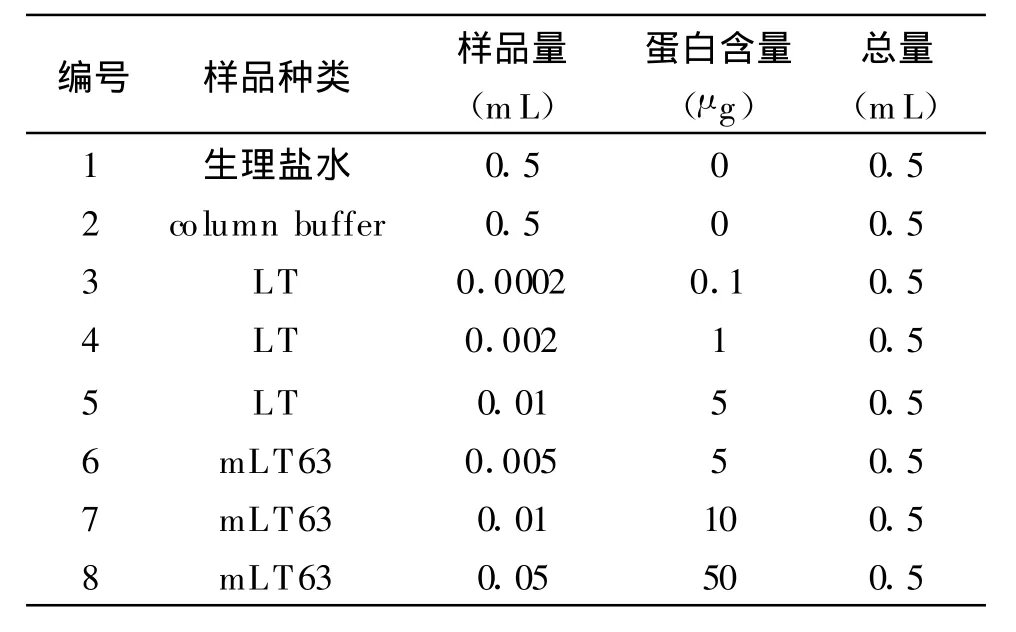
表1 家兔回肠袢结扎段注入样品及编号Table 1 Different sample and content in each loop
1.2.4 融合蛋白的佐剂活性检测 将 30只BALB/c小鼠随机分为3组,A、B、C组每组各10只,A组为 rUreB、rOmp11、mLT63经口免疫组,B组为 rUreB、rOmp11经口免疫组,C组为 column buffer对照组。
A组:每次经口灌胃 rUreB 10μ g,rOmp11 10μ g,mLT63 10μ g,200μ L/只 。
B组:每次经口灌胃 rUreB 10μ g,rOmp11 10μ g,200μ L/只 。
C组:每次经口灌胃column buffer,200μ L/只。
免疫接种前将各组小鼠禁食12 h,禁水4 h,灌胃组3%NaHCO3100μ L灌胃中和胃酸,30min后各组分别按照上述免疫物质及剂量进行免疫。在实验开始的第1、21 d各免疫1次,免疫结束4 h后恢复食水。
末次免疫2w后,A、B、C组各10只小鼠均摘除眼球取血;颈椎脱臼处死后,75%酒精消毒,剖腹取胃组织,同时收集新鲜粪便,Elisa法测定血清、胃液、粪便提取物中的特异性抗体水平。应用SAS 9.13统计软件包进行数据分析,评价抗原和佐剂组合的免疫应答效果。
2 结 果
2.1 mLT63的毒性检测 阴性对照组:1、2段肠腔外观无异常,肠腔内几乎无液体。阳性对照组:3、4、5段肠腔均充血水肿,肠腔内积液约有8~9mL。实验组:6、7、8段肠腔外观无异常,肠腔内几乎无液体。(图 1,2)
2.2 mLT63的佐剂活性检测 根据ELISA检测判断标准,血清、胃液、粪便提取物中重组蛋白特异性IgG、sIgA结果如下表。

图1 注入0.1 g LT的肠段Fig.1 Rabbit ileum loop which injected in 0.1 g LT图2 对照肠段:肠段 1内注入 50 g mLT63肠段 2内注入 column bufferFig.2 Rabbit ileum loop 1 which injected in 50 g mLT63.The number 2 which injected in column buffer
表2 各组小鼠血清、胃液及粪便提取物中的特异性抗体的表达±s)Table 2 Expression of specific antibodies in serum,gastric juice and extractions of dejecta in different groups(±s)
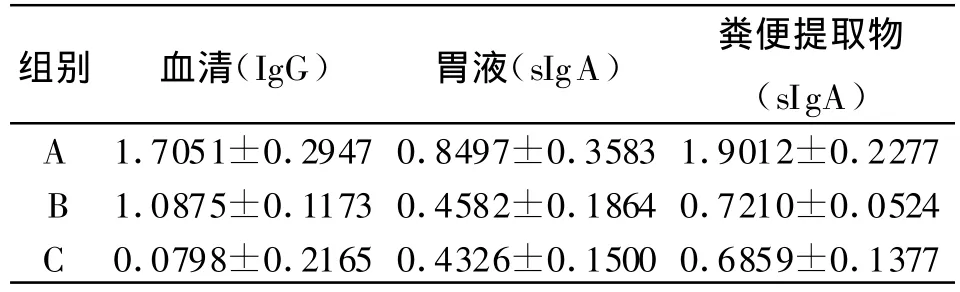
表2 各组小鼠血清、胃液及粪便提取物中的特异性抗体的表达±s)Table 2 Expression of specific antibodies in serum,gastric juice and extractions of dejecta in different groups(±s)
组别 血清(IgG) 胃液(sIgA) 粪便提取物(sIgA)A 1.7051±0.2947 0.8497±0.3583 1.9012±0.2277 B 1.0875±0.1173 0.4582±0.1864 0.7210±0.0524 C 0.0798±0.2165 0.4326±0.1500 0.6859±0.1377
各组资料经检验符合正态分布;单因素方差分析显示:组间差异有统计学意义。①小鼠血清中特异性IgG结果显示:A、B、C组之间差异有统计学意义(P<0.05),B、C组之间差异无统计学意义(P>0.05)。②小鼠胃液中特异性sI-gA结果显示:A组高于B、C组(P<0.05),B、C组之间差异无统计学意义(P>0.05)。③小鼠粪便提取物中特异性sI-gA结果显示:A、B、C组间差异有统计学意义(P<0.05),B、C组之间差异无统计学意义(P>0.05)。
3 讨 论
粘膜佐剂是经粘膜免疫的疫苗中的重要组分。许多接种失败的疫苗中通过加入适当的免疫佐剂能够显著提高免疫接种效果。作为LT的无毒突变体mLT63具有无毒、免疫原性好等特点,可作为候选疫苗佐剂。本研究室构建了以pMAL-c2X为载体,TB1为工程菌的原核表达系统,并通过优化诱导表达条件,已能够实现TB1(pMAL-c2X-mlt)的高效表达,经亲和层析纯化获得了高纯度的mLT63。
家兔回肠袢毒性试验是检测肠毒素的常用方法〔5〕。毒性试验结果表明,100ng的LT可导致家兔回肠袢肠段充血水肿,而50μ g的mLT63对家兔回肠袢肠段无任何毒性作用。充分证明我们所构建、表达的mLT63没有毒性。Hp亚单位疫苗是经粘膜免疫的疫苗之一,非粘膜途径的免疫接种几乎无免疫保护作用。Hp尿素酶(Urease,Ure)是Hp定植和致病的关键因素,也是H p重要的毒力因子之一。尿素酶B亚单位(UreB)缺乏尿素酶活性并保留了免疫原性,其编码基因高度保守,因此成为Hp疫苗的重要候选抗原之一〔6〕。多数革兰氏阴性细菌的外膜蛋白具有良好的抗原活性,可作为抗体和免疫细胞攻击的主要靶标,介导对细菌最直接有效的杀灭作用。Omp11是Hp的一种外膜蛋白,其编码基因具有高度保守性,有望成为Hp疫苗的重要免疫抗原〔6〕。因此,在本研究中应用Hp抗原rUreB、rOmp11联合mLT63经口途径免疫BALB/c小鼠,研究结果表明:mLT63联合 rUreB、rOmp11经口免疫BALB/c小鼠所引起的免疫应答高于抗原组及对照组,从而证实我们所构建表达的大肠杆菌无毒突变体mLT63具有良好的免疫佐剂活性。在研究过程中,无一例小鼠发生腹泻、精神萎靡等现象,说明了mLT63作为疫苗佐剂的安全性。
通过本研究,我们对 TB1(pMAL-c2X-mlt)进行了诱导表达,纯化产物经家兔回肠袢实验检测证实为无毒性,并通过动物实验证实了所构建、表达的mLT63具有良好的佐剂活性。
〔1〕Verweij WR,Haan L,Holtrop M,et al.Mucosal immunoadjuvant activity of recombinantEscherichia coliheat-labile enterotoxin and its B subunit:induction of sy stemic IgG and secretory IgA responses in mice by intranasal immunization with influenza virus surface antigen〔J〕.Vaccine,1998,16(20):2069-2076.
〔2〕Parez N,Fourgeux C,M ohamed A,et al.Rectal immunization with rotavirus virus-like particles induces sy stemic and mucosal humoral immune responses and protects mice against rotavirus infection〔J〕.Virol,2006,80(4):1752-1761.
〔3〕申晓靖,段广才,郗园林,等.大肠杆菌不耐热肠毒素基因克隆和无毒突变体mLT63的构建及序列分析〔J〕.河南医学研究,2005,14(2):100-103.
〔4〕白雪飞,郗园林,段广才.大肠杆菌不耐热肠毒素(LT)无毒突变体mLT63在大肠杆菌中的融合表达及纯化〔J〕.中国人兽共患病学报,2006,22(9):821-824.
〔5〕Park KS,Ono T,Rokuda M,et al.Cytotoxicity and enterotoxicity of the thermostable direct hemoly sin-deletion mutants of Vibrio parahaemoly ticus〔J〕.Microbiol Immunol,2004,48(4):313-318.
〔6〕Keenan JI,Allardyce RA,Bagshaw PF.Lack of protection following immunisation withH.py lorimembrane vesicles highlights antigenic differences betweenH.felisandH.pylori〔J〕.FEM S Microbiol Lett,1998,161(1):21-27.
Toxicity detection of heat-labile enterotoxin in non-toxic mutant ofEscherichia coliand investigation on its adjuvant effect ofE.coliheat-labile enterotoxin
BAI Xue-fei,GUO Jing-yu,LEI Wan-jun,DUAN Guang-cai
(HenanUniversity of Science and Technology,Luoyang410003,China)
In the present study,the expression,purification,toxicity detection and the adjuvant effect of the heat-labile enterotoxin in non-toxic mutant mLT63 ofEscherichia coliwere investigated,in which the inductive expression was performed under optimal condition for inductive expression and the toxicity of the products obtained from inductive expression were tested for toxicity after being purified and concentrated with affinity chromatography.BALB/c mice were immunized orally with the mutant mLT63 associated withHelicobacter pylori(Hp)subunit vaccine UreB,Omp11.After immunization,the specific antibody levels in serum,extract from gastric tissues and fecal extract were determind by means of ELISA assay and the results were subjected to statistical analysis.It was demonstrated that the mutant mLT63 of heat-labile entrotoxin ofE.coliconstructed in our laboratory devoided of any toxic effect as revealed by the rabbit ileal loop assay,but its adjuvant effect could be demonstrated in the associated immunization of mice withHpsubunit vaccine UreB and Omp11.
Escherichiacoliheat labile enterotoxin;mutants;adjuvant
R478.99
A
1002-2694(2010)01-0069-03
*河南省教育厅自然科学研究计划项目(2008A310005)
河南科技大学,洛阳 471003;
2009-05-16;
2009-10-18
