猪瘟细胞活疫苗细胞制备中分散液消化试验
2010-08-15崔海辉浙江育英职业技术学院杭州310018
崔海辉 (浙江育英职业技术学院 杭州 310018)
目前使用的猪瘟活疫苗主要是猪瘟兔化弱毒疫苗和猪瘟脾淋苗[1]。猪瘟细胞活疫苗是利用动物细胞大规模培养技术用猪瘟兔化弱毒株接种易感细胞培养,收获细胞培养物,加适宜稳定剂,经冷冻真空干燥制成。猪瘟细胞活疫苗和兔源猪瘟活疫苗生产使用的种毒均是我国自己研发的猪瘟兔化弱毒株(C株)[2]。
猪瘟细胞活疫苗在实际大规模细胞培养过程中遇到很多难题,而其中在细胞消化过程中分散液的选择直接影响到细胞接毒后细胞毒收获液的效价,因此细胞消化过程中一定要选择正确的分散液[3,4]。
1 材料与方法
1.1 材料
1.1.1 种毒 猪瘟兔化弱毒株(C株) 由中国兽医药品监察所提供,通过兔体继代,采集定型热反应兔的脾脏作毒种(简称脾毒)。物品:5ml注射器、6号针头、250ml或500ml锥型瓶、120目铜沙网漏斗、眼科剪刀镊子、500ml大烧杯、大三角瓶(500ml或1000ml)、平皿(中号)、玻璃珠(大些的)、四层纱布漏斗、转瓶等。冻干毒:5瓶0.8g/瓶
1.1.2 犊牛睾丸 来源浙江金华
1.1.3 配液 乳汉(欧)液、7.5%碳酸氢钠溶液;2万U双抗溶液(SP)、磷酸盐缓冲溶液(PBS溶液)、0.25%胰酶溶液、EDTA胰酶(0.02%~0.05%)、0.4%酚红、血清(NCS)、原代细胞生长液、乳汉液+9%NCS+0.8% sp+0.5%(7.5%碳酸氢钠)、维持液、乳汉液+2.0%NCS+ 0.8%SP+0.5%(7.5%碳酸氢钠)、0.25%胰蛋白酶,使用时调节pH值到8.0。
1.2 方法
1.2.1 细胞制备 操作:250ml瓶中取出牛睾丸—烧杯中洗一遍—平皿中去外皮—烧杯中洗两遍—睾丸中间一直线剪开,用小剪刀将组织刮下—移至烧杯中洗两遍—剪碎后洗一遍—转至三角瓶中加入玻璃珠和适量的0.25%胰蛋白酶(无需过多胰酶)—37℃水浴消化40-50min左右—弃去胰酶,加入少量营养液摇动三角瓶(此过程未用营养液洗去残留的胰酶),加入营养液通过四层纱布漏斗分散细胞至转瓶中(一般每付牛睾丸分散两瓶细胞)—37℃温室、8.5r/h培养,2~5d细胞生长至+++与++++之间时即可接毒。观察细胞时应尽量减少细胞瓶内液体的流动,24h内不要观察细胞。
1.2.2 一接(接毒比例0.3%) 操作:从冷库中取出预先冷冻的乳钵,将半化开的脾毒称取所需重量置于乳钵中研磨、捣碎,研磨后多加乳汉液,继续研磨,让组织中的毒得到充分释放。将种毒吸离心瓶中,配平、2000r/min 20min离心。将脾毒上清按比例接入细胞瓶中,继续培养。
1.2.3 一接一传(带毒传代) 将分散液、PBS溶液放在37℃恒温水浴箱中预热。取细胞形态良好、分布均匀且长满单层的细胞瓶,将瓶身用消毒液擦拭、瓶口用消毒酒精棉擦拭后在酒精灯外焰上烧1周,打开瓶塞。将细胞瓶中原有的细胞生长液倒掉,在火焰保护下向瓶内倒入适量PBS洗液,转动细胞瓶,使PBS洗液均匀漫过细胞面,洗去细胞面上存留的血清和营养液,然后倒掉PBS洗液。
向细胞瓶中加入适量细胞分散液,水平方向转动细胞瓶,使细胞分散液均匀漫过细胞面,然后水平放置在桌面上,进行下一瓶消化,同时经常旋转细胞瓶并密切观察细胞面的变化,当细胞面上出现肉眼可见毛玻璃样,或出现针尖大小的缝隙,或因细胞分散液在瓶内转动而出现细细的划痕时,即可倒掉细胞分散液并尽量倒净,将细胞瓶水平放在台案上,待细胞面出现较大裂痕时,细胞脱离瓶壁,此时细胞在分散液的作用下仍继续消化。经漏钟连接营养液,向瓶内加入含9%血清的细胞生长液,将细胞摇下,此时细胞停止消化。
按1:3分散率补足细胞生长液,将细胞生长液充分混匀,根据分散率均匀地分装在无菌的细胞培养瓶中,塞好塞子,加纸帽扎紧,摇匀细胞生长液,将细胞培养瓶放在转瓶机上,转瓶机转速为8.5r/h,置于37℃温室中继续培养。48h后镜检观察。
1.2.4 一传二接(接毒比例不低于0.35%) 操作:从冷库中取出预先冷冻的乳钵,将半化开的脾毒称取所需重量置于乳钵中研磨、捣碎,研磨后多加乳汉液,继续研磨,让组织中的毒得到充分释放。将种毒吸离心瓶中,配平、2000r/min 20min离心。将脾毒上清按比例接入细胞瓶中,继续培养。
1.2.5 二接一收 5d后收获,将细胞病毒液收于万瓶中,每转瓶留30ml母液,加维持液后继续培养,4天一收,二收、三收…直至细胞脱落或到八收左右弃去。
1.2.6 取样稀释检验 从收获的万瓶中取1ml样品,分别稀释5万倍和10万倍,且各检测5只常温正常且未受过毒兔子,48h开始每6h测温并记录兔子体温,直至96h。
2 结果(见表1、表2)

表1 传代过程中细胞消化现象及48h后生长情况记录表
3 讨论
(1)从本试验细胞传代过程中如表1可以看出6种分散液消化现象中EDTA胰酶加0.4%酚红消化速度快,且细胞呈单个,未见团块;0.25%胰酶:EDTA胰酶=3:2(一周前配,刚化)和0.25%胰酶:EDTA胰酶=4:1(一周前配,刚化)消化速度慢,未见片状脱落现象,加液后都仍有团块。48h后观察细胞的生长情况,EDTA胰酶0.05%~0.02%和EDTA胰酶加0.4%酚红48h长满均匀致密的单层;0.25%胰酶:EDTA胰酶=3:2(一周前配,刚化)细胞瓶上细胞非常稀,弃去;0.25%胰酶:EDTA胰酶=4:1(一周前配,刚化) 48h细胞长满不到50%,60h长满70%。
(2)通过半成品检验结果表2得到用EDTA胰酶
0.05%~0.02%消化细胞的病毒收获液5万倍稀释检测兔子3只定型热,2只轻热,10万倍稀释检测2只定型热,1只轻热,2只无反应;用0.25%胰酶:EDTA胰酶=3:2(现配)化细胞的病毒收获液5万倍稀释检测兔子2只定型热,1只轻热,2只无反应,10万倍稀释检测2只轻热,3只无反应;用0.25%胰酶:EDTA胰酶=4:1(现配)消化细胞的病毒收获液5万倍稀释检测兔子2只轻热,3只无反应,10万倍稀释检测全被无反应;用0.25%胰酶:EDTA胰酶=4:1(一周前配,刚化)消化细胞的病毒收获液5万倍和10万倍稀释检测兔子都无反应;用EDTA胰酶加0.4%酚红消化细胞的病毒收获液5万倍稀释检测兔子4只定型热,1只轻热,10万倍稀释检测3只定型热,2只轻热。
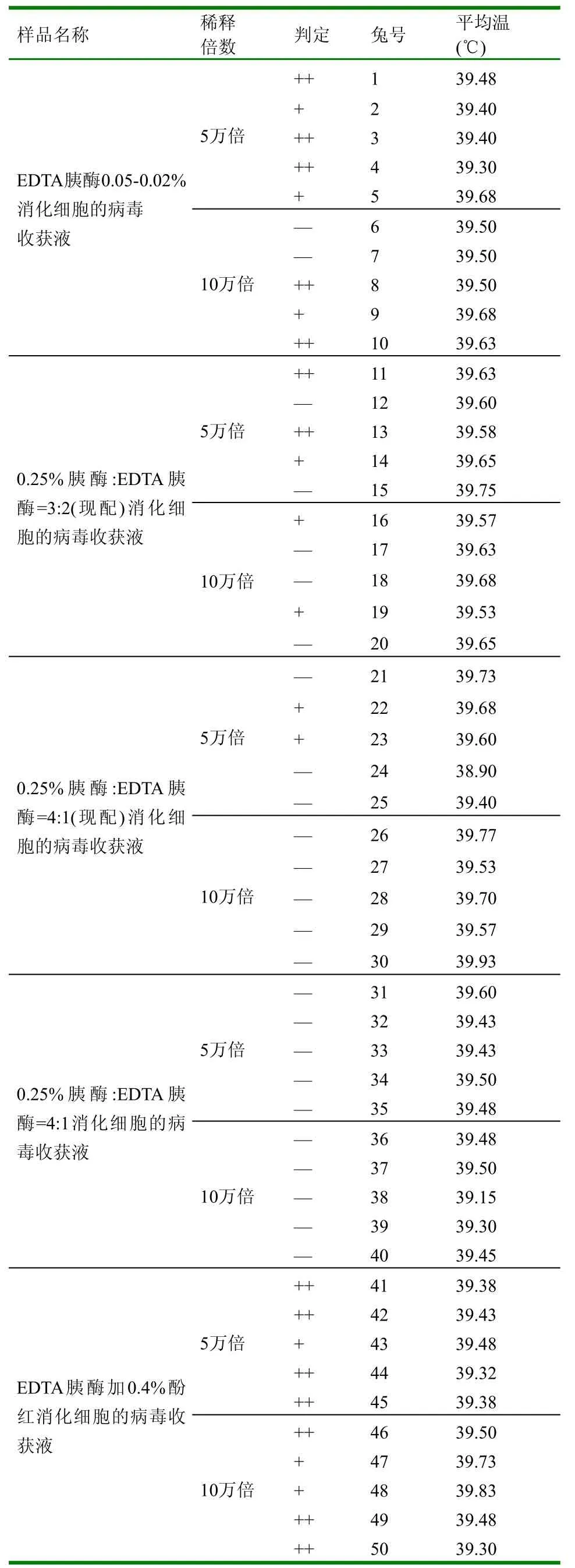
表2 猪瘟细胞活疫苗半成品检验结果
本试验中用EDTA胰酶加0.4%酚红消化细胞的病毒收获液检测兔子起温效果最好,可见细胞消化中分散液对细胞消化的好坏及之后生长起着关键的作用。细胞生长的好坏就直接影响到细胞瓶接毒后细胞毒收获液的效价,因此细胞消化过程中一定要选择正确的分散液。
[1] 张延龄,张晖.疫苗学[M].北京:科学出版社,2004,5-8.
[2] 佚名.中华人民共和国兽用生物制品规程[C].中华人民共和国农业部,2000, 45-51.
[3] 胡显文,肖成祖,李佐虎.细胞工程在生物制药工业中的地位[J].生物技术通讯,2001,12(2):117-119.
[4] 鄂征.组织培养和分子细胞学技术[M].北京出版社,1995,76-79.
[5] R.I.费雷什尼编.实用动物细胞培养液技术[M].-Animal Cell culture,a Proactical approach//潘孝珍等译.北京:世界图书出版公司,1996.
