c-Myc小分子抑制剂10058-F4对肾癌786-0细胞增殖凋亡的影响*
2010-08-14张巧琳罗春丽
张巧琳,徐 新,刘 琪,罗春丽
(重庆医科大学检验系教育部重点实验室 400016)
c-Myc是从鸡病毒V-myc癌基因和同源物中分离出来的原癌基因,在细胞增殖、凋亡和分化等进程中起重要作用。c-Myc因基因扩增、染色体易位、突变在多种肿瘤中表达失控,参与肿瘤进程[1]。通过微阵列和实时定量PCR发现c-Myc在肾癌中因基因扩增和染色体易位呈高表达,其表达量与患者的预后相关[2]。有学者进一步研究证实,c-Myc通路在肾癌中呈持续活化状态,体外 RNAi技术沉默c-Myc基因能有效抑制肾癌增殖、凋亡并可调节相应下游分子[3],但基因沉默对于肿瘤细胞的靶向作用有限。
c-Myc编码产物为转录因子,主要与Max蛋白形成二聚体调节相应下游分子从而调节肿瘤进程。10058-F4是c-Myc小分子抑制剂,可下调c-Myc蛋白表达并特异性阻止c-Myc-Max复合物形成[4-6]。因此,本次实验预用c-Myc-Max二聚体小分子抑制剂10058-F 4研究其对肾癌786-0细胞增殖和凋亡的作用,探讨其潜在治疗作用。
1 材料与方法
1.1 细胞系和主要试剂 786-0细胞株由本室保存,anti-c-Myc、anti-Bcl-2、anti-p27、anti-p21 和 anti-β-actin 的一抗及辣根过氧化物酶标记的抗鼠 IgG均购自 Santa CruZ公司,RPMI1640和小牛血清购自Gibco公司,M TT购自美国Sigma公司,10058-F 4购自Sigma公司。
1.2 细胞培养 人肾细胞癌786-0细胞用含10%新生牛血清的RPM I1640培养液,置于37℃、含CO2体积分数为5%的培养箱中培养,常规换液传代。
1.3 M TT检测 取对数期生长的786-0细胞2~5×104个/m L 100μL接种于96孔板,待细胞贴壁后加入图1A所示浓度的10058-F 4,将其每组细胞做5个复孔,37℃、5%CO2培养箱中孵育,培养不同的时间点后,每孔加入M TT(5 mg/m L)20 μL,继续培养4 h,弃上清液,每孔加 150μL DMSO,用酶标仪570 nm处测吸光度值。细胞增殖活力按公式计算:细胞生长抑制率=[1-(OD实验-OD调零)/(OD对照-OD调零)]×100%。
1.4 FCM检测 取对数生长的786-0细胞接种于50 mL培养瓶中,待细胞贴壁后加入 60、100μM 的10058-F4,加药后继续培养细胞24 h,用0.25%胰酶消化,PBS洗 3次,600×g离心5 min,加入70%乙醇固定细胞,1000×g离心10 min去固定液,加入碘化丙啶染色液[1×PBS,0.1%Trton X-100,碘化丙啶(20μg/m L),RNase A(100μg/m L)],室温染色30 min,上流式细胞仪分析细胞周期,采用PI/annexin-V染色用于检测细胞凋亡,取1×105个细胞加入5μL Annexin V-PE及 10 μL的7-AAD,轻轻混匀,避光保存 20 min,加入 200μL缓冲液,立即用流式细胞仪检测细胞凋亡。
1.5 Western blot法检测 细胞用预冷的 PBS洗3次,用细胞刮收集细胞于离心管中,800×g离心 5 min,转移到EP管中,3000×g离心 5 min,加入 RIPA 裂解液,冰上放 30 min,13000×g离心30 min收集上清液,用考马斯亮蓝于酶标仪上测浓度,加入蛋白上样缓冲液100℃变性5 min,每个上样孔上相同浓度的蛋白,每孔约 50μg,SDS-PAGE,半干转于 PVDF膜上,5%脱脂奶粉封闭3 h,一抗 4℃过夜,TBS T洗膜 3次,每次10 min,二抗室温孵育 1 h,TBST洗膜,3次/10 min,ECL显色。
1.6 统计学处理 采用S PSS13.0统计软件进行分析,结果以表示,以 P<0.05为差异有统计学意义。
2 结 果
2.1 10058-F 4抑制肾癌细胞786-0增殖及c-Myc蛋白表达MTT检测结果显示,加入c-Myc小分子抑制剂10058-F4后,抑制肾癌细胞786-0增殖,且呈浓度依赖性(P<0.05,图 1A)和时间依赖性(P<0.05,图 1B),Western blot法检测结果显示10058-F 4能明显抑制c-M yc蛋白水平表达,并呈浓度依赖性(P<0.05),见图1C。

图1 10058-F4对肾癌786-0细胞增殖及c-Myc蛋白表达的影响

图2 10058-F 4对肾癌786-0细胞周期和凋亡的影响
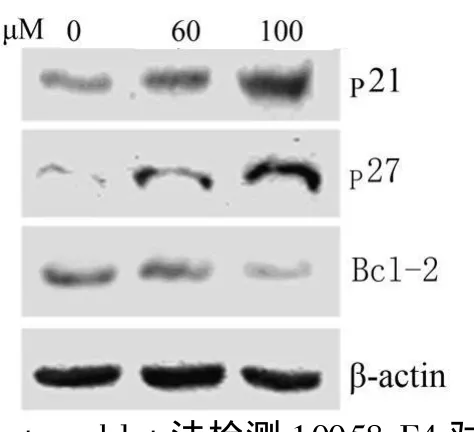
图3 Western blot法检测10058-F4对肾癌786-0细胞p21、p27和Bcl-2蛋白表达
2.2 10058-F 4阻止786-0细胞周期并诱导凋亡 用流式细胞仪检测细胞周期结果显示,60μM 和 100μM 的 10058-F4均可阻止786-0细胞周期于G0/G1期(P<0.05),见图2A,进一步PI/annexin-V双染流式检测显示,100μM的10058-F4作用786-0细胞24h可诱导细胞凋亡,但作用不明显,进一步检测其48 h时细胞凋亡,发现其凋亡细胞增多,对照组细胞凋亡率为(6.2±0.91)%,60μM 的 10058-F4细胞凋亡率为(13.07±0.64)%,100μM 的10058-F4细胞凋亡率为(17.97±0.55)%(P <0.05),见图2。
2.3 10058-F 4影响p21、p27和 Bcl-2蛋白表达 Western blot法检测结果显示,10058-F4可上调p21和p27蛋白表达,并明显下调Bcl-2蛋白,且呈浓度依赖性(P<0.05),见图3。
3 讨 论
c-Myc及其所调节的信号通路在肾癌的发生过程中发挥着重要的作用,抑制 c-Myc表达能有效抑制肾癌生长[3,7]。目前主要采用RNAi技术和寡义核苷酸链等抑制c-Myc表达,但这些技术对肿瘤靶向具有局限性。研究发现,c-Myc主要与Max等形成二聚体调节肿瘤恶性生物学行为,小分子抑制剂10058-F4可特异性抑制c-Myc-Max形成。本次研究采用c-Myc小分子抑制剂10058-F4作用于肾癌786-0细胞,发现其能有效抑制肾癌细胞增殖并诱导其凋亡。
c-M yc蛋白属于具有DNA结合域的转录因子,对细胞周期起正向调节作用,c-Myc基因激活导致大量G0期细胞提前进入细胞周期,推动G0/G1期细胞向S期转变[8]。本研究发现,c-Myc小分子抑制剂 10058-F 4,抑制肾癌 786-0细胞增殖并明显阻止细胞周期于G0/G1。p21、p27是细胞周期素依赖性激酶抑制蛋白,通过抑制CDK的激活使细胞周期阻止于G1期,同时 p21、p27是 c-Myc的靶基因[9]。10058-F4可明显上调p21、p27蛋白表达水平。p21、p27作为c-Myc的靶基因,当c-Myc蛋白水平降低和Max形成二聚体减少,对下游分子的调节作用减弱,p21、p27所受抑制作用相应减弱,表达上调。10058-F4有可能是通过抑制c-Myc活性及与Max二聚体的形成,间接上调 p21、p27蛋白表达,从而抑制肾癌细胞增殖,阻止细胞周期于G0/G1。进一步研究发现,10058-F 4可诱导 786-0细胞凋亡并可下凋c-Myc凋亡相关下游分子Bcl-2蛋白水平,但在24 h时作用并不明显,随着时间延长,诱导凋亡作用增加,呈现时间依赖性,这可能是由于细胞内被抑制的目标蛋白有一定的半衰期,只有当目标蛋白降解以后,10058-F4的抑制效应才显现出来。
c-Myc在多种肿瘤中表达失控,如参与肿瘤的发生,其中包括肾癌,下降c-Myc性活能有效阻止肿瘤进程。c-Myc有望成为肿瘤治疗的新靶点,c-Myc小分子抑制剂10058-F4特异性下调c-Myc表达,抑制c-Myc功能二聚体形成,间接有效调节c-Myc靶基因,有望为肾癌治疗开辟新途径。
[1]popescu NC,Zimonjic DB.Chromosome-mediated alterations of the MYC gene in human cancer[J].J Cell Mol Med ,2002,6(2):151.
[2]Jon AJ,Lovisol O ,Casati B,etal.Gene expression proling of renal cell carcinoma:a DNA macroarray analysis[J].BJU Iint,2006 ,98(1):205.
[3]Tang SW ,Chang WH ,Su YC ,etal.M YC pathw ay is activated in clear cell renal cell carcinoma and essential for proliferation of clear cell renal cell carcinoma cells[J].Cancer Letters,2009,273(1):35.
[4]Berg T ,Cohen SB,Desharnais J,et al.Small-molecule antagonists of Myc/Max dimerization inhibit Mycinduced transformation of chicken embryo fibro-blasts[J].Proc Natl Acad Sci USA,2002,99:3830.
[5]Yin X,Giap C ,Lazo JS,et al.Low molecular weightinhibitors of Myc-Max interaction and function[J].Oncogene,2003,22:6151.
[6]Mo H,Henriksson M.Identification of small molecules thatinduce apoptosis in a Myc-dependentmanner and inhibit Myc-driven transformation[J].Proc Natl Acad Sci USA,2006,103:6344.
[7]Shachaf CM ,Kopelman AM ,Arvanitis C,et al.MYC inactivation uncovers pluripotent differentiation and tumour dormancy in hepatocellular carcinoma[J].Nature,2004,431:1112.
[8]Morrish F ,Neretti N ,Sedivy JM ,et al.The oncogene c-Myc coordinates regulation of metabolic networks to enable rapid cellcycle entry[J].Cell Cycle,2008 ,7(8):1054.
[9]Coqueret O.New roles for p21 and p27 cell-cycle inhibitors:a function for each cell compartment[J].Trends Cell Biol,2003 ,13(2):65.
[10]Saw yers CL.Making progress through molecular attacks on cancer[J].Cold Spring Harb Sym p Quant Biol,2005,70:479.
