进展期胃癌术后多西他赛联合卡培他宾化疗及同步放疗的临床研究
2010-08-14郭红伟靳秀丽魏桂芳刘卓林
郭红伟 靳秀丽 魏桂芳 刘卓林
长治市第二人民医院普外科,山西 长治 046000
我国胃癌的发病率和病死率仍居恶性肿瘤之首,很多患者确诊时已处于晚期,对此类患者,外科手术曾被认为是唯一可潜在治愈的手段,但研究发现约54%的进展期胃癌患者在施行根治性切除术(R0切除术)后仍会发生局部或区域复发,患者5年总生存率不超过40.0%[1]。进展期胃癌单纯根治术的5年生存率已难以提高。近年研究显示,对于进展期胃癌患者术后联合放化疗可显著提高患者生存率[2]。目前胃癌术后放化疗已成为新的研究热点,本研究采用多西他赛联合卡培他宾化疗及同步放疗的方法,治疗进展期胃癌术后患者,评价其治疗耐受性及1、3年生存率。
1 资料和方法
1.1 一般资料 收集本院2004年1月—2006年2月间行根治性手术后的85例进展期胃癌患者。依据AJCC 2002 年TNM分期标准分为Ⅱ~Ⅳ M0期,所有病例均行D1以上清扫术,均经病理证实;经B超、CT证实有可测量病灶,KPS评分(Karnofsky performance status score)均>60分,预计生存期3个月以上,每日摄入食物热量均>1 500千卡,化疗前肝、肾功能正常,血常规正常,均未用过紫杉类药物。采用随机数字表法对患者进行随机分组,其中试验组44例,对照组41例。两组临床资料见表1。
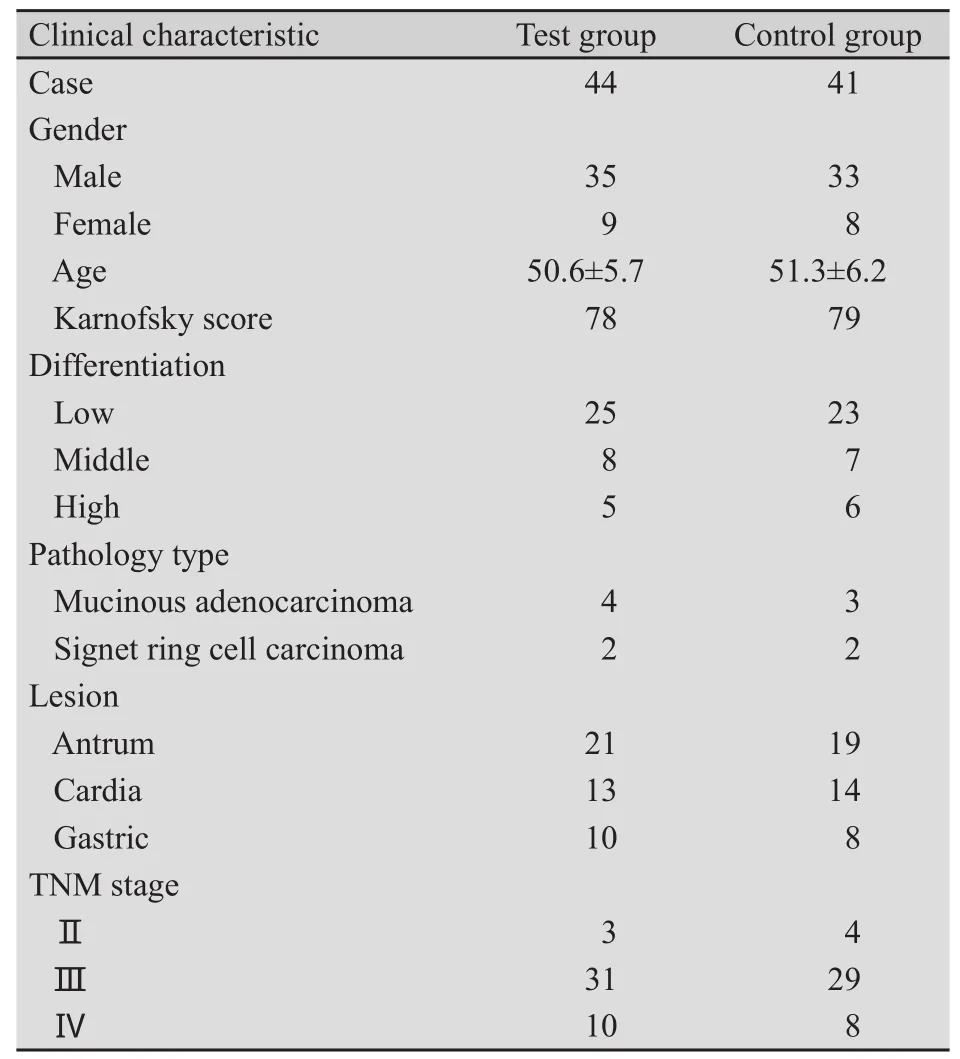
表1 两组患者的临床特征Tab.1 The clinical characteristics of two groups
1.2 治疗方法 试验组:于术后2~4周行多西他赛(75 mg/m2,静脉滴注;每周1次,共5次)联合卡培他宾(1 000 mg/m2,口服,每天2次,共14 d,每3周为1个周期,化疗2个周期)治疗,化疗第1天开始放疗,采用前后两照射野对穿照射,靶体积剂量4 140~4 500 cGy,180 cGy/次,共23~25次,照射范围包括瘤床、手术残端、吻合口和区域淋巴结。放疗结束后3~4周再给予多西他赛70 mg/m2,静脉滴注,第1、8天,每3周为1个化疗周期+卡培他宾1 000 mg,口服,每天3次,共14 d,每3周1次,化疗2个周期。对照组:入组患者采用多西他赛+奥沙利铂+5-FU/CF方案联合化疗,多西他赛5 mg/m2,静脉输注,第1天;奥沙利铂100 mg/m2,静脉输注,第1天;5-FU 2.6 g/m2采用持续静脉输注泵(购自美国百特公司),持续静脉输注48 h,第1天;CF 200 mg/m2于5-FU前30 min静脉输注;化疗前静脉注射格拉司琼3 mg预防恶心、呕吐;用多西他赛前1天口服地塞米松4 mg,每日2次,连用3天;多西他赛化疗前30 min应用地塞米松和苯海拉明抗过敏;静脉输注开始后监测心率、呼吸、血压及脉搏。以上方案每3周重复1次,为了防止外周静脉炎的发生均采用深静脉插管。化疗结束后48 h常规应用重组人粒细胞集落刺激因子(GCSF),皮下连续注射3~5 d。如合并有其他不良反应,给予相应的对症支持治疗。每个疗程化疗后对其不良反应进行评估。
1.3 疗效判定 胃部肿瘤病灶的大小通过胃镜和上消化道钡透进行评估,转移病灶用B超、CT等评估,化疗后原发病灶的疗效根据WHO实体瘤疗效评定标准进行评估:完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)、疾病进展(PD)。化疗毒性反应按照WHO的抗癌药物常见不良反应分级标准进行分级。缓解期指自开始判定CR或PR至肿瘤复发或进展的时间。生存期是从化疗开始至死亡或末次随诊的时间。
1.4 统计处理 利用SPSS 11.5软件进行统计学处理,组间有效率比较采用χ2检验,生存分析采用Kaplan-Meier法,两组间比较采用Logrank检验进行统计分析,P<0.05为差异有统计学意义。
2 结 果
2.1 临床疗效 所有病例随访到2009年8月,无失访病例,两组无治疗相关死亡病例,试验组和对照组患者皆全部完成治疗。试验组患者1年生存率为84.1%(37/44),对照组为61.0%(25/41),两组间比较差异有统计学意义(P=0.017)。试验组3年生存率为65.9%(29/44),对照组为39.0%(16/41),两组间比较差异有统计学意义(P=0.013)。
2.2 不良反应 试验组77.3%(34/44)的患者出现不良反应,其中Ⅲ~Ⅳ级占13.6%(6/44);对照组61.0%(25/41)的患者出现不良反应,其中Ⅲ~Ⅳ级占19.5%(8/41),两组间不良反应发生率及Ⅲ~Ⅳ级发生率差异均无统计学意义(P=0.103;P=0.466),且对肝肾功能影响小(表2)。
3 讨 论
研究表明我国胃癌患者在诊断时绝大多数为进展期胃癌[3],局部复发和远处转移是进展期胃癌根治术后失败的主要原因[4],为进一步提高胃癌治疗的生存率,需要多学科参与的综合治疗。尽管先前的研究认为胃癌术后合理应用辅助化疗可提高无疾病进展生存时间与总生存期,但近来的两项Meta分析结果均显示进展期胃癌根治术后化疗对提高患者生存率只有很小的作用[5-6],同样亦有研究显示术后单纯放疗并不能显著提高生存率[7],近来的临床试验发现对于胃癌完全根治术后患者同步放化疗能显著提高患者3年生存率且不良反应可为患者所耐受[2,8]。为此,术后同步放化疗已被美国国家癌症综合网络(NCCN)推荐为进展期胃癌的标准治疗方案。目前临床上为了让患者在胃癌完全根治术后获得更高的疗效,更合理有效的放化疗联合方案正成为胃癌临床研究的热点。
多西他赛为半合成的紫杉类衍生物,作用机制与紫杉醇相同,对多种肿瘤有效,属广谱的抗肿瘤药[9],多个Ⅱ期临床试验表明,多西他赛单药方案治疗晚期胃癌取得明显的疗效,Vanhoefer等[10]用多西他赛100 mg/m2单药二线治疗晚期胃癌患者取得了20%的有效率。欧洲SAKK与EIO联合对多西他赛与顺铂两药方案(TC)治疗胃癌进行Ⅱ期临床研究,有效率为55%,中位无瘤进展期为6.6个月,中位生存期为9个月,主要的不良反应为血液学毒性。一项多中心的临床试验对多西他赛+顺铂+5-FU(TCF组)与TC方案进行了对比研究,TCF组的有效率为43%,高于TC组的28%,TCF组中位无瘤进展时间与生存时间分别为5.9和10.6个月[11]。基于多个Ⅱ、Ⅲ期临床试验所得结论,多西他赛治疗胃癌的疗效显著。
卡培他宾为5-FU前药口服剂,在肝及肿瘤由酶作用产生两种中间产物5’-DFCR及5’-DFUR,最后在瘤内胸苷磷酶化酶(TP)激活产生有活性的5-FU,由于肿瘤内TP浓度约等于正常组织3倍,故卡培他宾具有选择性杀伤癌细胞作用,对正常组织毒性较5-FU小[12]。卡培他宾单药一线治疗晚期胃癌的有效率为25%~32%,中位生存期9.5~10个月[13]。实验表明,紫杉醇可明显上调TP活性,联合用药增加卡培他宾抗肿瘤作用,故本研究采用紫杉醇联合卡培他宾治疗进展期胃癌。Kang等[14]2004年ASCO会议报道卡培他宾联合紫杉醇一线治疗进展期胃癌有效率52.9%,中位生存期14.6个月。
本研究采用多西他赛联合卡培他宾化疗同步放疗来治疗进展期胃癌根治术后患者并获得了较好的临床疗效。本研究结果显示,研究组1年生存率为84.1%,明显高于对照组的61.0%(P=0.017),3年生存率分别为65.9%和39.0%(P=0.013),这和国外的试验结果相近,提示进展期胃癌术后同步放化疗可提高疗效。多西他赛联合卡培他宾化疗方案可降低患者骨髓抑制发生率和(或)减轻骨髓抑制程度且不降低疗效。多西他赛可使细胞停止于G2/M 期,而此期对放射线的敏感性是G1和S期的4倍,故多西他赛联合卡培他宾化疗方案与放射治疗协同作用可进一步增加疗效。5-FU的标准用法为持续静脉滴注,临床使用较不方便且不良反应较大,本研究使用5-FU衍生物卡培他宾口服能长时间地维持血药浓度,达到与持续静脉滴注5-FU相似的效果,且给药方便,不良反应小,患者容易耐受。本研究同步放化疗患者3年生存率达65.9%,高于INT0116试验的的放化疗患者3年生存率(50%),这可能与使用多西他赛联合卡培他宾方案化疗有关,也可能与本研究病例数较少有关,更长时间的生存率评价有待进一步的观察。
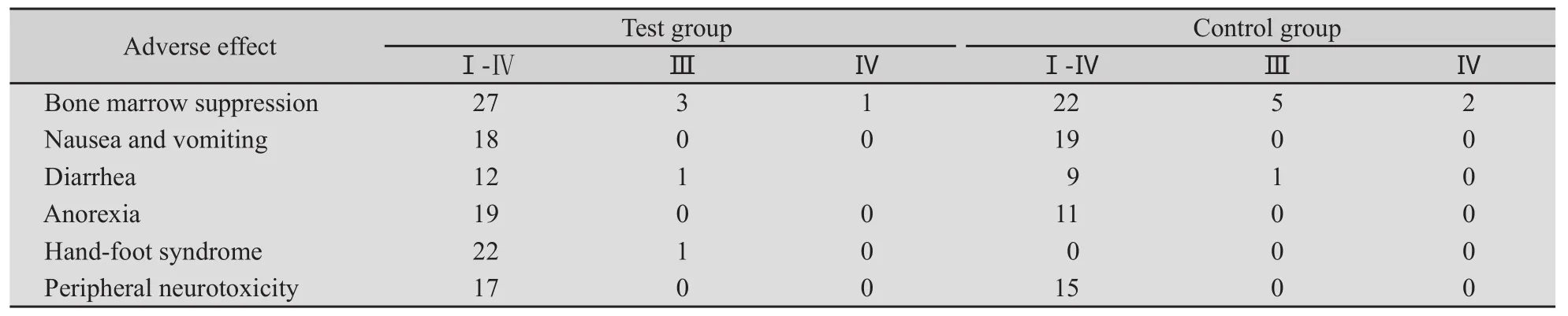
表2 试验组和对照组治疗的不良反应Tab.2 Adverse effects of test group and control group
本研究中,同步放化疗患者总的不良反应发生率较单纯化疗患者有所增加(77.3%∶61.0%),但差异无统计学意义(P=0.103),两组不良反应主要为骨髓抑制,多为Ⅰ~Ⅱ级。这与骨髓抑制程度相对减轻及积极应用G-CSF支持治疗有关。值得提出的是同步放化疗患者厌食的发生率较高43.2%,多数为Ⅰ~Ⅱ级,予以必要的营养支持治疗后,没有出现因为严重的厌食而不能耐受治疗的情况。
综上所述,进展期胃癌术后予以多西他赛联合卡培他宾化疗及同步放疗疗效较好,且治疗不良反应能为患者所耐受,值得临床推广。
[1] Roukos DH, Kappas AM. Perspectives in the treatment of gastric cancer [J]. Nat Clin Pract Oncol, 2005, 2(1): 98-107.
[2] Macdonald JS, Smalley SR, Benedetti J, et al.Chemoradiotherapy after surgery compared with surgery alone for adenocarcinoma of the stomach or gastroesophageal junction[J]. N Engl J Med, 2001, 345(10): 725-730.
[3] 詹友庆, 李威, 孙晓卫, 等. 胃癌外科治疗的远期疗效研究[J]. 中华外科杂志, 2005, 43(17): 1109-1113.
[4] Smalley SR, Gunderson L, Tepper J, et al. Gastric surgical adjuvant radiotherapy consensus report rationale and treatment implementation[J]. Int J Radiat Oncol Biol Phys, 2002,52(2): 283-293.
[5] Mari E, Floriani I, Tinazzi A, et al. Efficacy of adjuvant chemotherapy after curative resection for gastric cancer: a meta analysis of published randomised trials. A study of the GISCAD (Gruppo Italiano per lo Studio dei Carcinomi dell Apparato Digerente)[J]. Ann Oncol, 2000, 11(7): 837-843.
[6] Hu JK, Chen ZX, Zhou ZG, et al. Intravenous chemotherapy for resected gastric cancer: meta analysis of randomized controlled trials[J]. World J Gastroenterol, 2002, 8(6):1023-1028.
[7] Valentini V, Cellini F, D’ Angelillo RM. Combined treatments in gastric cancer: radiotherapy [J]. Suppl Tumori, 2003,2(5): 39-44.
[8] Kim S, Lim do H, Lee J, et al. An observational study suggesting clinical benefit for adjuvant postoperative chemoradiation in a population of over 500 cases after gastric resection with D2 nodal dissection for adenocarcinoma of the stomach[J]. Int J Radiat Oncol Biol Phys, 2005, 63(5):1279-1285.
[9] Belani CP. Optimizing chemotherapy for advanced non-small cell lung cancer: focus on docetaxel[J]. Lung Cancer, 2005,50(Suppl 2): 3-8.
[10] Vanhoefer U, Wilke H, Harstrick A, et al. Phase Ⅱ study of docetaxel as second line chemotherapy (CT) in metastatic gastric cancer [J]. Proc Am Soc Clin Oncol, 1999, 18(3):1163-1175.
[11] Ajani JA, Fodor M, Van Cutsem E, et al. Multinational randomized phase Ⅱ trial of docetaxel (T) and cisplatin(C) with or without 5 fluorouracil (FU) in patients (pts) with advanced gastric or GE junction adenocarcinoma (AGC AGEJC)[J]. Proc Am Soc Clin Oncol, 2000, 19(2): 247-256.
[12] 林云笑, 黄活勋, 潘岐作. 单药卡培他宾治疗晚期乳腺癌和结直肠癌疗效观察[J]. 现代肿瘤医学, 2005, 13(2):247-248.
[13] Hong YS, Song SY, Lee SI, et al. A phase Ⅱ trial of capecitabine inpreriously untreated patientswith and vanced and/or mestastatic ganstric cancer[J]. Ann Oncol, 2004,15(6): 1344-1347.
[14] Kang H, Kin J, Chang H, et al. A phase Ⅱ study of paclitaxel and capecitabine combination chemotherapy in patients with advanced gastric cancer as a first-line[J]. J Clin Oncol,2004, 22(14): 4051.
