抑制Bcl-2基因表达增强非小细胞肺癌NCI-H460细胞放射敏感性的研究
2010-08-14陈蜜徐向英许德权赵芳宗许庆勇胡松柳徐建宇
陈蜜 徐向英 许德权 赵芳宗 许庆勇 胡松柳 徐建宇
哈尔滨医科大学附属肿瘤医院放疗科,黑龙江 哈尔滨 150081
*:现工作单位,浙江省宁波市鄞州人民医院肿瘤放化疗中心,浙江 宁波 315000
肺癌是我国常见的恶性肿瘤,放射治疗是其主要的治疗手段之一。Bcl-2基因是一种重要的抑制细胞凋亡的基因,广泛存在于各种肿瘤细胞中。Bcl-2基因的高表达影响着肿瘤的发生、发展,并使肿瘤细胞对放疗和化疗产生抵抗[1]。有证据表明,Bcl-2基因的高表达会抑制放、化疗诱导的凋亡,而抑制Bcl-2基因的表达可能会增加放、化疗的敏感性[2-3]。RNA干扰(RNA interference,RNAi)是双链小干扰 RNA(small interfering RNA,siRNA)引起特异性靶mRNA裂解而抑制其表达的过程,体内、外的研究显示了RNAi在癌症基因治疗方面良好的应用前景[4-6]。本实验利用抑制Bcl-2基因表达的短发夹RNA(short hairpin RNA,shRNA)重组质粒,并将其转染至非小细胞肺癌NCI-H460细胞中,以观察特异性抑制Bcl-2基因表达对NCI-H460的细胞凋亡及放射敏感性的影响。
1 材料和方法
1.1 材料
1.1.1 细胞株及质粒 非小细胞肺癌NCIH460细胞株由哈尔滨医科大学遗传教研室提供。以pCYU6/GFP/Neo为载体的Bcl-2/shRNA重组质粒购自上海Chooseasy公司,针对Bcl-2基因的shRNA特异序列Bcl-2/shRNA:5’-GGTGAAGTCAACATGCCTGCTTCAAGAGAGCAGGCATGTTGACTTCAC-3’;无义序列Neg-shRNA:5’-GTTCTCCGAACGTGTCACGTCAAGAGATTACGTGACACGTTCGGAGAATT-3’。
1.1.2 主要试剂及仪器 脂质体LipofectamineTM2000和G418购自美国invitrogen公司,小鼠抗人Bcl-2、β-actin单克隆抗体系SantaCruz公司产品,马抗小鼠碱性磷酸酶标记二抗购自北京中杉金桥生物技术有限公司,RPMI1640培养基购自美国Gibco公司,胎牛血清为杭州四季青产品,直线加速器为美国Varian 2100C/D。
1.2 方法
1.2.1 细胞培养及转染 NCI-H460细胞培养于含10%胎牛血清的RPMI 1640培养液中,在37 ℃、CO2体积分数为5%温箱中培养至指数生长期,常规接种于6孔板,每孔密度为4.0×105个细胞,24 h后约80%~90%汇合时,按照LipofectamineTM2000说明书操作将重组质粒转染至NCI-H460细胞中,转染后24 h传代,48 h后加入400 μg/mL的G418,筛选阳性克隆,两周后改为200 μg/mL,继续培养至肉眼可见克隆。荧光显微镜下标记含绿色荧光蛋白的克隆,将其挑出后置于培养瓶中传代培养。
1.2.2 细胞照射 采用直线加速器产生的6MV-X射线室温照射细胞,剂量率为4 Gy/min,照射时将培养瓶的细胞面朝上,并覆1 cm厚的补偿物,源皮距为100 cm。
1.2.3 Western blot检测Bcl-2蛋白表达水平分别收集转染及未转染的细胞,提取细胞总蛋白,以考马斯亮蓝G-250染料法测定蛋白质浓度。蛋白上样量为60 μg,12%SDS聚丙烯酰胺凝胶电泳1.5 h,然后将蛋白质转移到硝酸纤维素膜(NC膜)上,用1% BSA 4 ℃封闭过夜,分别加入小鼠抗Bcl-2和β-actin单抗后温育2 h TBST漂洗,加马抗小鼠碱磷酶标记二抗后温育1 h,TBST及TBS漂洗,将NC膜浸于1 mL显色液中避光约10 min后观察结果,实验重复3次。
1.2.4 Hoechst 33258染色法观察细胞凋亡 将转染及未转染的细胞各分为两组,一组接受直线加速器4 Gy的X线照射,照射后培养48 h;另一组未接受X线照射作为对照组。去除培养液,加入0.5 mL固定液固定10 min后,以PBS清洗细胞2次,每次3 min。避光条件下加入0.5 mL Hoechst 33258后用摇床均匀晃动,染色5 min,于荧光显微镜下观察细胞。每个标本在高倍镜下用数码成像系统进行拍照,摄取相邻不重叠的4个视野,由经验资深实验技师阅片,计数凋亡细胞数和细胞总数,并计算细胞凋亡率。
1.2.5 细胞克隆形成实验 将对数生长期的转染及未转染细胞消化成单细胞悬液后,以不同数量的细胞分别接种于25 cm2培养瓶中培养24 h后,按由低到高的细胞密度分别接受0、2、4、6、8 Gy的X线照射,每组细胞的每个照射剂量点设3个复瓶。照射后继续培养14 d,用无水乙醇固定,结晶紫染色,计数≥50个细胞的克隆数,实验重复3次。采用多靶单击模型SF=1-(1-eD/Do)N绘制细胞存活曲线,并根据曲线计算D0、Dq、N和SF2值。
1.3 统计处理 用SAS 9.0统计软件分析,计量资料采用表示,多组均数的比较采用方差分析,组间比较用t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 Bcl-2/shRNA重组质粒的转染结果NCI-H460细胞转染质粒后,筛选获得阳性克隆,荧光显微镜下可见成克隆的发绿色荧光的NCI-H460转染后细胞,细胞呈多边形证明转染成功(图1)。
图1 转染Bcl-2/shRNA重组质粒前后NCI-H460细胞的比较Fig.1 Comparison of NCI-H460 cells untransfected and transfected with Bcl-2/shRNA
2.2 Western blot检测Bcl-2蛋白表达水平变化 Western blot检测结果显示H460、H460-Neg及H460-RNAi细胞的Bcl-2/β-actin蛋白表达水平分别为0.922±0.004、0.914±0.011和0.329±0.007。前两组比较差异无统计学意义(t=1.09,P=0.32),而H460-RNAi细胞与其余两组比较差异均有统计学意义(t=88.54,P<0.05;t=87.45,P<0. 05)。Western blot检测结果显示Bcl-2/shRNA重组质粒能显著抑制Bcl-2基因的蛋白表达水平,而Neg-shRNA质粒无明显的抑制作用(图2)。
2.3 细胞凋亡率变化情况 将Hoechst 33258染色后的细胞放置在荧光显微镜下观察,正常细胞核为圆形,呈淡蓝色;凋亡细胞的核由于染色质浓集而呈现亮蓝色,核呈分叶、碎片状等(图3)。X射线照射前,H460细胞的凋亡率为(2.3±0.7)%,与H460细胞组及H460-Neg细胞组比较明显增加(t=-17.99,P<0.05;t=-14.87,P<0.05)。X射线照射48 h后,H460-RNAi细胞的凋亡率高达(24.9±1.4)%,与其余两组细胞照射后相比,差异有统计学意义(t=-26.70,P<0.05;t=-24.95,P<0.05);同时与未照射的H460-RNAi细胞相比,凋亡率也有明显升高(t=-17.85,P<0.05)。结果表明,干扰质粒Bcl-2/shRNA能够促进NCI-H460细胞凋亡,同时提高细胞对X射线诱导的细胞凋亡(表1)。

图2 Western blot法检测各组细胞Bcl-2蛋白表达水平Fig.2 Effect of Bcl-2 shRNA on Bcl-2 protein levels in NCI-H460 cells by Western blot

图3 荧光显微镜下观察细胞凋亡的形态学变化Fig.3 Cell apoptosis of stable transfection with Bcl-2 shRNA by morphological observation
表1 4 Gy X射线照射前后的凋亡率比较Tab.1 Apoptosis rates at the dose of 4 Gy X-ray and without radiation[( )%]

表1 4 Gy X射线照射前后的凋亡率比较Tab.1 Apoptosis rates at the dose of 4 Gy X-ray and without radiation[( )%]
2.4 细胞克隆形成分析 根据多靶单击数学模型所拟合的细胞存活曲线显示H460-RNAi细胞较其余两组明显左移(图4)。而所得的细胞存活参数D0、Dq、N和SF2值H460细胞组分别为1.39、1.39、2.72、0.52;H460-Neg细胞组分别为1.21、1.28、2.87、0.46;H460-RNAi细胞组分别为0.97、0.75、2.18、0.26。可见H460-RNAi细胞组的所有细胞存活参数均低于其余两组,特别是D0、Dq值,而H460细胞组与H460-Neg细胞组比较差异无统计学意义。与对照组比较,提示H460-RNAi细胞对射线的抵抗能力低及细胞的亚致死损伤修复能力弱,即放射敏感性显著增高。
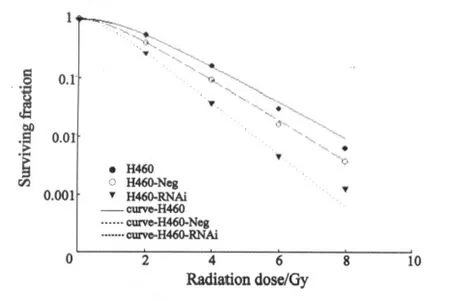
图4 不同细胞存活曲线Fig.4 Survival curves of different cells
3 讨 论
放射治疗是肺癌的主要治疗手段之一,但疗效仍不尽人意。影响肺癌放射治疗疗效的因素很多,如肿瘤的大小、乏氧细胞的多少、肿瘤细胞固有的放射敏感性等,其中肿瘤细胞固有的放射敏感性是最重要的因素,而放射敏感性是指肿瘤对射线不同程度的反应。影响肿瘤细胞固有放射敏感性的因素很多,凋亡是其中之一[7]。Bcl-2蛋白是Bcl家族中一种重要的抑制细胞凋亡蛋白,能通过线粒体凋亡途径抑制细胞色素C从线粒体中释放而抑制凋亡。研究表明,Bcl-2的高表达会抑制放疗诱导的凋亡,而抑制Bcl-2的表达可能会增加放射敏感性[2]。最早研究的Bcl-2反义寡核苷酸已经多次成功的应用于临床前及临床研究中,但反义寡核苷酸很容易降解,只能起一过性的瞬时作用,而RNAi技术可以克服这一缺点。RNAi是指在生物体细胞内外源性或内源性的双链RNA诱发的同源mRNA高效特异性降解所引起的序列特异性基因沉默现象。RNAi技术具有高效率、可以向子代遗传等优点,还可同时针对多个目标基因进行研究[8]。
之前已有报道非小细胞肺癌NCI-H460细胞株的Bcl-2含量较高[9-10],且细胞株比较适合转染。本研究旨在观察利用shRNA重组干扰质粒抑制NCI-H460细胞内的Bcl-2表达水平对细胞凋亡及放射敏感性的影响。Western blot检测结果显示与H460细胞和H460-Neg细胞比较,H460-RNAi细胞Bcl-2蛋白表达水平显著降低,说明Bcl-2/shRNA重组干扰质粒能有效的抑制NCI-H460细胞内的Bcl-2基因表达。
国外有学者发现,在整个细胞群体中,照射后以凋亡形式死亡的细胞所占比例越大,其放射敏感性越高,这是衡量放射敏感性的重要指标。Tanaka等[11]也报道称肿瘤细胞对射线的敏感性与放射导致的肿瘤细胞的凋亡有关。本研究通过形态学观察细胞凋亡实验显示,照射前H460-RNAi细胞凋亡率较对照组明显增加,说明抑制Bcl-2基因表达可以促进细胞凋亡;而照射后H460-RNAi细胞的凋亡率明显高于照射后的对照组及未放疗组,由此可以看出特异性抑制NCI-H460细胞的Bcl-2基因表达可以协同增加射线诱导的细胞凋亡,增强NCI-H460细胞的放射敏感性。以上观点同Anai等[12]及Nguyen等[13]的研究一致。
细胞存活曲线是放射生物学的一个重要参数,D0为平均致死量,同一种细胞D0值的改变标志着细胞放射敏感性的变化,D0值越小则说明细胞对射线的抵抗能力越低;而Dq反映肩区大小,表示细胞亚致死损伤修复能力的大小,Dq值越小,表明细胞对亚致死损伤修复能力越弱。N为外推数和靶数,反应肩区大小,N值越小则预示对放射线越敏感。SF2为细胞受到2 Gy照射后的存活分数,SF2值越小则放射抗拒性越低。本研究中的细胞克隆形成实验表明:H460-RNAi细胞组的D0、Dq、N和SF2值分别为0.97、0.75、2.18和0.26,均小于其余两组细胞,特别是D0、Dq值,提示转染Bcl-2/shRNA重组质粒后细胞放射抵抗性明显降低,能更有效地抑制NCI-H460细胞亚致死性损伤修复,这也可能是其放射增敏作用的原因之一,国外Kim等[14]的实验亦得出相同的结论。
综上所述,本研究结果证实了抑制Bcl-2表达能显著协同增强非小细胞肺癌NCI-H460细胞放疗所诱导的凋亡,增强细胞的放射敏感性,为非小细胞肺癌的基因治疗联合放射治疗研究提供了一些实验基础和理论依据。然而还有许多问题需要解决,例如,人体内实验是否和体外以及动物模型实验具有相同的实验结果,体内细胞的微环境是否适合干扰基因的转染及肺癌细胞是否会对其产生抗性,以及基因的转染途径及效率问题等。相信随着基因治疗和放疗联合治疗策略的优化,这些问题将会在以后的研究及工作中得到进一步的论证及改善。
[1] Huang Z. Bcl-2 family proteins as targets for anticancer drug design[J]. Oncogene, 2000, 19(56): 6627-6631.
[2] Tse C, Shoemaker AR, Adickes J, et al. ABT-263:A potent and orally bioavailable Bcl-2 family inhibitor[J]. Cancer Res, 2008, 68(9): 3421-3428.
[3] Koty PP, Tyurina YY, Tyurin VA, et al. Depletion of Bcl-2 by an antisense oligonucleotide induces apoptosis accompanied by oxidation and externalization of phosphatidylserine in NCI-H226 lung carcinoma cells[J]. Mol Cell Biochem,2002, 234-235(1-2) : 125-133.
[4] Li K, Lin SY, Brunicardi FC, et al. Use of RNA interference to target cyclin E overexpressing hepatocellular carcinoma[J].Cancer Res, 2003, 63(13) : 3593-3597.
[5] Ptasznik A, Nakata Y, Kalota A, et al. Short interfering RNA (siRNA) targeting the Lyn kinase induces apoptosis in primary,and drug- resistant,BCR- ABL1(+) leukemia cells[J]. Nat Med, 2004, 10(11): 1187-1189.
[6] Gondi CS, Lakka SS, Dinh DH, et al. RNAi-mediated inhibition of cathepsin B and uPAR leads to decreased cell invasion, angiogenesis and tumor growth in gliomas[J].Oncogene, 2004, 23(52): 8486- 8496.
[7] Lei L, Story M, Legerski RJ. Cellular responses to ionizing radiation damage[J]. Int J Radiat Oncol Biol Phys, 2001,49(4): 1157-1162.
[8] Pushparaj PN, Aarthi JJ, Manikandan J, et al. siRNA, miRNA and shRNA: In vivo applications[J]. J Dent Res, 2008, 87(11): 992-1003.
[9] Hu Y, Bebb G, Tan S, et al. Antitumor efficacy of oblimersen Bcl-2 antisense oligonucleotide alone and in combination with vinorelbine in xenograft models of human non-small cell lung cancer[J]. Clin Cancer Res, 2004, 10(22) : 7662-7670.
[10] Danesi R, de Braud F, Fogli S, et al. Pharmacogenetics of anticancer drug sensitivity in non-small cell lung cancer[J].Pharmacol Rev, 2003, 55(1): 57-103.
[11] Tanaka T, Bai T, Yukawa K, et al. Reduced radiosensitivity and increased CD40 expression in cyclophosphamideresistant subclones established from human cervical squamous cell carcinoma cells[J]. Oncol Rep, 2005, 14 (4): 941-948.
[12] Anai S, Goodison S, Shiverick K, et al. Knock-down of Bcl-2 by antisense oligodeoxynucleotides induces radiosensitization and inhibition of angiogenesis in human PC-3 prostate tumor xenografts[J]. Mol Cancer Ther, 2007, 6(1): 101-111.
[13] Nguyen LN, Munshi A, Hobbs ML, et al. Paclitaxel restores radiation-induced apoptosis in a Bcl-2-expressing, radiationresistant lymphoma cell line[J]. Int J Radiat Oncol, 2001,49(4): 1127-1132.
[14] Kim DW, Seo SW, Cho SK, et al. Targeting of cell survival genes using small interfering RNAs (siRNAs) enhances radiosensitivity of grade Ⅱ chondrosarcoma cells[J]. J Orthop Res, 2007, 25(6): 820-828.
