术中防止胃癌细胞血行播散的阻断技术及其操作方法
2010-08-14胡承恩甘军陈妍如张延龄黄广建
胡承恩 甘军 陈妍如 张延龄 黄广建
复旦大学附属华山医院普通外科,上海 200040
胃癌恶性程度高,治疗效果差,根治术后生存率仍偏低[1],即使近年来采用扩大区域切除及淋巴结清扫,5年生存率并未见明显提高[2],大多数患者仍死于肿瘤远处转移[3],因此需进一步寻求措施,以防止胃癌细胞自原发灶脱落进入静脉血流,特别是手术过程中医源性造癌细胞的远处转移和腹腔种植。CK起源于上皮细胞,是上皮细胞和上皮来源的恶性肿瘤细胞中间丝的组成成分,是上皮分化的最可靠的指标之一,对上皮组织的定性具有独特价值。其中CK19在血液、骨髓和淋巴结等间叶组织中不表达,而在乳癌、胃肠癌和肺癌等上皮性肿瘤组织中稳定表达,也是检测循环癌细胞的敏感标志物。本文在胃癌根治性切除术中尝试采用阻断癌细胞血行播散的技术(以下简称胃癌阻断技术),通过测定肝门静脉血内CK19 mRNA的表达情况,初步判断其在胃癌根治术中防止癌细胞血行播散的治疗效果,现报道如下。
1 资料和方法
1.1 患者资料 对2004年2月—2007年5月间本院收治的200余例胃癌阻断胃癌患者中,采用胃癌阻断技术切除并测定CK19 mRNA的患者及纳入对照组的患者共34例,其中男性19例,女性15例,平均年龄(61.4±12.5)岁。所有的患者均无肝脏和肺的远处转移,无腹膜种植结节。按随机表法分为对照组和阻断组各17例,其中对照组未采用胃癌阻断技术。对照组:男性10例,女性7例,平均年龄(62.2±10.1)岁;肿瘤分化程度为:Ⅱ级8例,Ⅲ级7例,Ⅳ级2例;肿瘤发生的部位,胃窦癌12例,胃体癌3例,贲门癌2例;TNM分期(日本胃癌处理规约第13版):Ⅱ期9例,Ⅲa期4例,Ⅲb期4例。阻断组:男性9例,女性8例,平均年龄(59.7±12.3)岁;按肿瘤分化程度,Ⅱ级6例,Ⅲ级11例;按肿瘤部位,胃窦癌10例,胃体癌4例,贲门癌3例; TNM分期:Ⅱ期8例,Ⅲa期6例,Ⅲb期3例。
1.2 治疗方法
1.2.1 胃癌阻断器材 胃癌阻断钳有直钳和弯钳两种,直钳用于胃窦癌、胃体癌的阻断,弯钳用于胃底贲门癌和高位胃体癌的阻断。每对阻断钳有长、短钳各一根,短钳长约9.5 cm,长钳约15 cm,对合面为无损伤齿槽。阻断钳必需保持合适的刚性和一定的弹性,当拧紧螺丝闭合钳子时保证从阻断钳的钳尖逐步向中央对合,以达到彻底阻断胃壁血流、淋巴流的目的。
1.2.2 胃癌阻断技术 进腹探查证实无肝脏、腹膜及盆腔种植后,不牵拉、触摸胃及大网膜,即以25 G细针穿刺肝门静脉抽静脉血2.5 mL,穿刺处以干纱布轻压止血。阻断组先以粗线缝扎肿瘤周围的胃左、右动静脉及胃网膜左、右动静脉4根主干血管,并逐一缝扎网膜血管弓通向大网膜的血管分支;于缝扎血管的肿瘤侧,以血管钳或钝头剪分离胃壁与血管之间的间隙,从大弯侧沿胃后壁向小弯侧潜行分离;插入胃癌阻断钳,拧紧螺丝夹闭肿瘤两侧正常胃壁。对于大多数高位胃体癌,可通过采用弯钳完成阻断而不需翻转脾胰。对于胃底癌、贲门癌及脾脏较大的高位胃体癌,胃壁阻断较前稍复杂,需先翻转脾脏及胰体尾部,缝扎胃左动静脉根部、胃冠状静脉、胃网膜左动静脉、胃短动静脉、胃后动静脉及左横膈动静脉,再以弯胃癌阻断钳夹闭食管下段及胃体部,整个操作过程均采用不接触技术。对照组按胃癌根治术常规操作,术中不采用胃癌阻断技术。对照组和阻断组的胃窦癌、胃体癌均选择在横断十二指肠球部并翻转胃时再次抽肝门静脉血2.5 mL,贲门癌在准备切断胃左动静脉前再次抽肝门静脉血。阻断组术中同时抽曲张的网膜血管弓内静脉血。所有血标本均立即注入PAXgene(PreAnalytiX公司)血液RNA试管中保存,测定CK19 mRNA表达情况。
1.2.3 CK19 mRNA测定 按常规抽提细胞总RNA,并测定波长260和280 nm处的吸光度值并计算RNA含量;采用Promega公司反转录试剂盒合成cDNA,并行巢式PCR扩增条件:95 ℃30 s、56 ℃ 30 s、72 ℃ 1 min,共扩增30个循环,最后72 ℃延伸7 min。以GADPH作为内参照,反应条件同前,2%琼脂糖凝胶电泳分析大小。CK19的扩增产物大小为281 bp,GADPH的扩增产物扩增产物为226 bp,可判断CK19 mRNA表达情况。
2 结 果
2.1 阻断效果 阻断组中17例患者均成功地进行了胃癌阻断,其中10例胃窦癌、4例胃体癌以直钳阻断,3例贲门癌翻转脾胰后以弯钳阻断,以阻断区域胃壁颜色转为暗紫色和静脉轻度曲张作为阻断成功的标志。剪开胃大弯侧可见阻断区域胃黏膜缺血、颜色转为暗黑。
在手术过程中,对照组及阻断组均选择对肿瘤牵拉和挤压最明显时抽肝门静脉血测定CK19 mRNA的表达情况,CK19 mRNA的扩增产物为281 bp,GADPH的扩增产物为226 bp。对照组中17例胃癌患者,9例患者肝门静脉血CK19 mRNA阳性,而阻断组中17例胃癌患者肝门静脉血CK19 mRNA均为阴性,提示采用胃癌阻断技术能防止癌细胞大量入血(图1)。
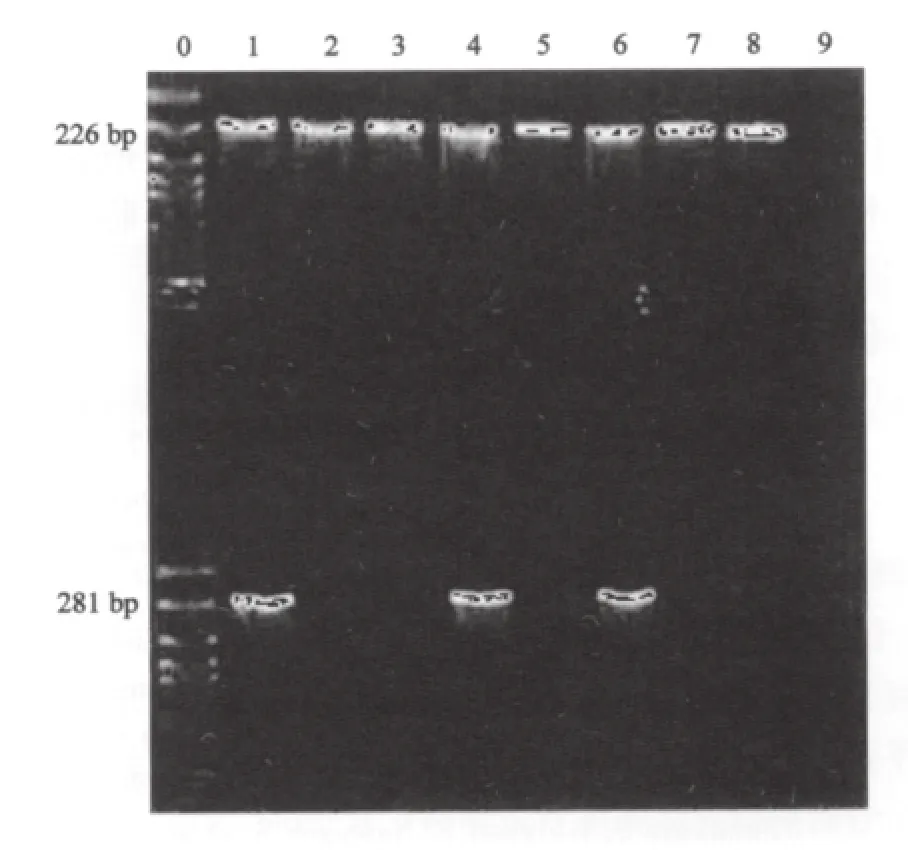
图1 RT-PCR检测静脉血中CK19 mRNA的表达Fig.1 CK19 mRNA expression in venous blood detected by RT-PCR
2.2 阻断时间 17例采用胃癌阻断技术的患者中,胃窦癌和胃体癌完成胃癌阻断技术所需时间最短为3 min,最长为20 min,平均时间为(8.1±3.5)min;3例贲门为癌采用阻断技术所需时间为33~42 min。
2.3 并发症 阻断组17例胃癌患者中,仅1例胃窦癌发生胃后壁破裂,由于胃后壁与胰腺粘连,分离胃后壁时发生胃后壁约1 cm的裂口,修补后直视下沿后壁逐步分离阻断成功;另1例胃窦部癌患者阻断成功后,在进行胃癌根治术的过程中,发生胃癌近侧阻断钳的螺丝划破脾脏包膜致脾脏出血,电凝止血并以止血纱布压迫止血成功。
2.4 随访 随访截止至2010年5月,两组34例胃癌患者均随访3年,阻断组3年生存率为58.8%(10/17),对照组3年生存率为47.1%(8/17)。
3 讨 论
研究显示,原发性肝癌、结肠癌、乳腺癌及恶性黑素瘤等恶性肿瘤患者全身血液均有游离癌细胞的存在,胃癌患者外周血液内采用RT-PCR方法也能检测到癌细胞[4-6];即使在病变的早期阶段,外周血和骨髓内已出现癌细胞[7-8]。目前已证实,影响胃癌预后的最主要因素为肿瘤的远处转移,且主要由血行转移引起。然而外周血液内有癌细胞并不代表有肿瘤的远处转移,并非所有的血液内癌细胞均能形成远处转移灶,转移灶的发生主要取决于癌细胞对靶组织的选择性及机体的免疫反应。入血后的癌细胞进入血液循环,被小血管捕获并转移出血管,在此过程中肿瘤细胞易被机体的免疫细胞攻击或被血液动力破坏,只有足够数量的癌细胞在短时间内集中入血才有可能形成微小转移灶。
胃癌根治的手术操作与生理状态下胃蠕动对肿瘤病灶的侵扰程度不同,由于手术操作不可避免地会对病灶部位发生牵拉和翻转,特别对于肿瘤较大或清扫深部淋巴脂肪组织时可能会直接触摸乃至挤压胃癌病灶,以及由此引起的胃强烈痉挛,均会引起胃癌细胞在短时间集中入血、导致术后微转移的发生。本研究在术中横断十二指肠并向上翻转胃时,抽肝门静脉血测定CK19 mRNA的表达情况,17例常规行胃癌根治术者,9例肝门静脉血内CK19 mRNA表达为阳性,说明肝门静脉内确有癌细胞的存在,采用现行的无瘤原则及理论上的轻柔操作,都无法保证癌细胞不会经血行播散。赵增顺等[5]报道在根治手术操作前,先结扎胃癌外周流向肝门静脉血流的网膜动静脉、胃右动脉及冠状静脉,采用EMA单抗进行免疫组化测定肝门静脉血内癌细胞,发现未采用结扎主干血管者肝门静脉内癌细胞的阳性率为60%,而结扎胃癌周围主干血管者肝门静脉内癌细胞的阳性率为27.1%。本研究认为,由于胃壁内丰富的血流及广泛的血管交通支,仅仅结扎肿瘤四周的主干血管无法达到彻底阻断癌细胞血行播散的目的,自原发灶脱落的癌细胞仍可经胃壁内静脉交通支通过胃短静脉、胃后静脉或左膈下静脉回流入肝门静脉;特别对于胃底贲门癌,由于其解剖的特殊性,有多支供血动脉及引流静脉且位置较深,很难达到有效阻断癌细胞播散的目的。笔者在采用胃癌阻断技术的过程中,先缝扎肿瘤四周主干血管,也发现癌灶及其周围胃壁仍呈正常的粉红色,无供血不良或静脉淤血现象,而加用了胃癌阻断钳夹闭癌灶两侧胃壁后,癌灶及阻断区域胃壁转为暗紫色,静脉有曲张淤血,达到了彻底隔绝血流的目的。采用胃癌阻断技术不仅能阻断胃壁的血流,还同时阻断胃壁的淋巴流和夹闭胃腔,防止癌细胞经淋巴管转移及经胃腔脱落种植。本研究对17例胃癌在根治术前先采用胃癌阻断技术,同样在翻转胃时抽肝门静脉血,发现肝门静脉血CK19 mRNA均为阴性,表明胃癌阻断技术能有效地防止癌细胞的血行播散。
本组数据显示,胃窦癌、胃体癌平均仅需(8.1±3.5)min即能完成阻断,贲门癌最长需42 min完成阻断,随着操作技术的熟练,一般胃窦胃体肿瘤在5 min内可完成阻断,贲门癌约30 min左右完成阻断。由于胃窦、胃体后壁与胰腺中间存在间隙,只需分离出网膜血管弓与胃壁之间、小弯侧血管与胃壁之间的组织间隙就可轻松进入小网膜囊间隙。本组有1例患者曾有急性胰腺炎病史,在以钝头剪从大弯侧沿胃后壁向小弯侧潜行分离阻断胃癌远侧时,由于没有意识到胃后壁与胰腺粘连明显,在剪刀分离、穿过胃后壁时造成胃后壁的破裂,因此对于有胰腺炎、严重胆囊炎及胃穿孔等病史者,需警惕有时胃后壁与胰腺之间可能有粘连,需沿胃后壁逐步分离胃与胰腺之间的间隙。对于胃窦癌侵及幽门管时,也需逐步分离十二指肠球后间隙,防止造成胃肠壁或胰腺的损伤。本组还有1例胃体癌患者,近侧胃癌阻断钳的螺丝刮伤脾门部包膜造成局部出血,因此对于阻断钳靠近脾脏者、高位胃体癌及脾脏较大者,在安置阻断钳后,用纱布将阻断钳与脾脏隔开,可防止脾脏的损伤。
总之,术中均顺利完成阻断,未有中途放弃者,亦未见其他明显的并发症,胃癌阻断技术是一种简便、安全的操作方法,有临床推广应用价值。
[1] Catalano V, Labianca R, Beretta GD, et al. Gastric cancer[J]. Crit Rev Oncol Hematol, 2009, 71(2): 127-164.
[2] Roviello F, Pedrazzani C, Marrelli D, et al. A Super-extended(D3) lymphadenectomy in advanced gastric cancer [J].Euro J Surg Oncol, 2010, 36(5): 439-446.
[3] Marrelli D, Roviello F, de Stefano A, et al. Risk factors for liver metastases after curative surgical procedures for gastric cancer: a prospective study of 208 patients treated with surgical resection [J]. Am Coll Surg, 2004, 198(1): 51-58.
[4] Sumikura S, Ishigami S, Natsugoe S, et al. Disseminated cancer cells in the blood and expression of sialylated antigen in gastric cancer [J]. Cancer Lett, 2003, 200(1): 77-83.
[5] 赵增顺, 王少文, 焦喜林, 等. 胃肠道癌手术与门静脉单细胞转移的相关性研究 [J] .中华外科杂志, 1999, 37(6):331-332.
[6] 王文秀, 方立萍, 路丹, 等. 模拟胃癌外周血微转移免疫磁珠检测法的建立 [J]. 中国癌症杂志, 2004, 14(2): 113-115.
[7] 王贵英, 王士杰, 李勇, 等. 胃癌患者骨髓微转移细胞的形态及其临床意义 [J] .实用肿瘤杂志, 2006, 21(4): 348-351.
[8] Matsunami K, Nakamura T, Oguma H, et al. Detection of bone marrow micrometastasis in gastric cancer patients by immunomagnetic separation [J]. Ann Surg Oncol, 2003,10(2): 171-175.
