依西美坦在非甾体类芳香化酶抑制剂经治失败的晚期乳腺癌患者中的临床应用
2010-08-14宋国红邸立军宛凤玲任军
宋国红 邸立军 宛凤玲 任军
北京大学临床肿瘤学院,北京肿瘤医院暨北京市肿瘤防治研究所乳腺肿瘤内科,恶性肿瘤发病机制及转化研究教育部重点实验室,北京 100142
晚期乳腺癌治疗的主要目的是提高生活质量,改善临床症状,延长生存期。内分泌治疗因其较化疗不良反应少,疗效好,而成为晚期乳腺癌的重要治疗手段。第三代芳香化酶抑制剂(阿那曲唑、来曲唑和依西美坦)的出现使乳腺癌的治疗出现新的契机,对复发转移乳腺癌具有明显的疗效[1-3],NCCN指南提出对于激素受体阳性,仅有皮肤软组织骨转移或没有症状的内脏转移者首选内分泌治疗。
依西美坦为甾体类芳香化酶灭活剂,它能不可逆地结合到芳香化酶与雄激素底物的结合位点上,引起酶永久失活,阻断雄烯二酮向雌酮和睾丸酮向雌二醇的转化,降低体内雌激素水平,达到治疗乳腺癌的目的。国外有研究表明,依西美坦与其他内分泌药物包括非甾体类芳香化酶抑制剂之间无明显交叉耐药反应,对于第三代非甾体类芳香化酶抑制剂治疗失败的患者仍能取得较好的疗效[4-6]。本研究旨在进一步评价依西美坦在非甾体类芳香化酶抑制剂治疗失败的晚期乳腺癌患者中的临床应用价值。
1 资料和方法
1.1 研究对象 患者入选标准:⑴病理确诊为乳腺癌;⑵有可测量或可评价的病灶;⑶雌激素受体(estrogen receptor,ER)和(或)孕激素受体(progesterone receptor,PR)阳性或不明;⑷自然绝经或人工绝经的复发转移患者;⑸血象、肝肾功能大致正常;⑹既往接受过非甾体类芳香化酶抑制剂治疗进展的患者。
1.2 临床资料 全组33例女性晚期乳腺癌患者,中位年龄57岁(40~75岁),中位无病生存期(disease free survivor,DFS)53个月(0~144个月),患者临床资料见表1。
1.3 治疗方法 每日口服1次依西美坦25 mg,28 d为1个周期,每2个周期进行疗效评定。
1.4 疗效评价 参照实体肿瘤疗效评估标准(Response Evaluation Criteria in Solid Tumors,RECIST)进行肿瘤疗效评价,主要评价指标包括:总缓解率(overall response rate,ORR)[完全缓解(complete response,CR)+部分缓解(partial response,PR)]、临床获益率(clinical benefit rate,CBR) (CR+PR+SD≥24周)、无进展生存时间(progression free survival,PFS),不良反应根据WHO制定的抗癌药物毒性分度标准。

表1 患者一般临床资料Tab.1 Baseline demographics of patients
1.5 统计处理 采用SPSS 15.0软件,对定性资料进行χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 临床疗效 全组33例患者,CR 0例(0%),PR 2例(6.0 %),有效率6.0%,SD 19例(57.6%),其中持续时间≥24周者13例,临床获益率为45.5%,PD 12例(36.4%),中位PFS 5.9个月(1~29.3个月)。客观缓解及临床获益的中位持续时间分别为19.6和8.4个月。
2.2 影响疗效的因素 各类患者疗效分析显示年龄≥60岁的患者的CBR高于年龄<60岁的患者,既往未接受过化疗(不包括辅助化疗)的患者出现进展的比例低于接受过化疗的患者,差异均有统计学意义(P<0.05)。依西美坦的临床疗效在不同无病间期、有无内脏转移及不同受体状态的患者中差异无统计学意义(P>0.05,表2)。
2.3 不良反应 全组33例患者中无严重不良反应,主要不良反应包括:乏力3例(9.1%),潮热4例(12.1%),关节疼痛1例(3.0 %),转氨酶升高(Ⅰ度) 1例(3.0%)。必要时给予对症处理,无需调整用药。
3 讨 论
乳腺癌细胞的生长依赖于雌激素的存在,女性绝经后循环中的雌激素(雌酮和雌二醇)主要通过外周组织中的芳香化酶将肾上腺、肝脏、肌肉和脂肪中的雄激素(雄烯二酮和睾酮)转化而来。因此通过抑制芳香化酶来阻止雌激素生成是一种有效的选择性治疗绝经后激素依赖性乳腺癌的方法。依西美坦与来曲唑、阿那曲唑等不同,系甾体类药物,其特点包括:⑴与体内芳香化酶的结合是不可逆的,为芳香化酶灭活剂;⑵对芳香化酶的灭活作用无反复;⑶底物选择性高,对肾上腺内皮质类固醇和醛固酮的生物合成无明显影响[7-9]。
Paridaens等[3]报道认为依西美坦作为绝经后转移性乳腺癌患者一线内分泌治疗药物的疗效优于三苯氧胺,其研究共入组382例患者,其中依西美坦组入组190例,其平均PFS为9.95个月,192例纳入三苯氧胺组,其平均PFS为5.72个月。另外,有研究表明,依西美坦与其他内分泌药物之间包括非甾体类芳香化酶抑制剂无明显交叉耐药作用[4-6]。Lonning等[4]报道的241例经非甾体类芳香化酶抑制剂治疗失败的转移性乳腺癌患者,应用依西美坦25 mg/d治疗,ORR为6.6%,CBR为24.3%,客观缓解及临床获益的中位持续时间分别为58.4和37.0周。Steele等[5]报道114例同样入组条件患者,采用依西美坦治疗后ORR为5%,CBR为46%,PFS和OS分别为18和61周。Chin等[6]报道的31例患者,ORR为19.4%,CBR为54.8%,客观缓解及临床获益的中位持续时间分别为18和14个月。这些资料均证实依西美坦对于非甾体类芳香化酶抑制剂经治失败的绝经后内分泌治疗反应型晚期乳腺癌患者仍是一个有效的治疗药物。
本研究显示33例雌激素和(或)孕激素受体阳性或不明的绝经后晚期乳腺癌患者,既往均接受过非甾体类芳香化酶抑制剂治疗进展,采用口服依西美坦每日1次,每次25 mg,仍能取得较明显的临床获益,有效率(CR+PR)为6.0%,临床获益率(CR+PR+SD≥24周)为45.5 %,中位PFS为5.9个月,ORR及CBR的中位持续时间分别为19.6和8.4个月。本研究结论与国外文献报道基本一致,均提示甾体类芳香化酶灭活剂依西美坦与非甾体类芳香化酶抑制剂之间无明显交叉耐药作用,在非甾体类芳香化酶抑制剂经治过的晚期乳腺癌患者中依西美坦的治疗虽然不如一线该药治疗的疗效高,但仍能获得明显的临床获益,值得在晚期患者中推广。
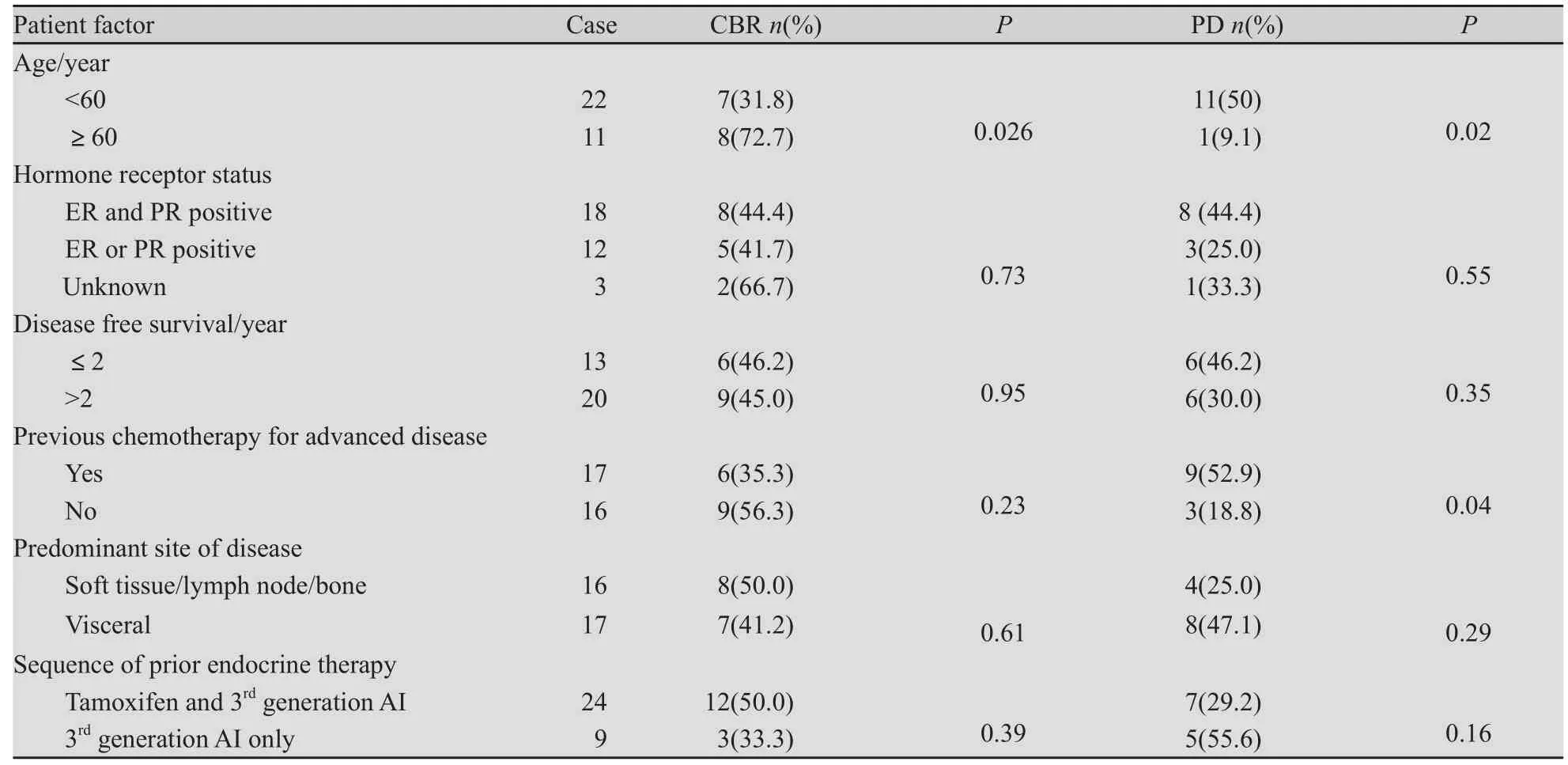
表2 各类患者疗效分析Tab.2 Tumour responses according to patient factors
两类药物之间缺乏交叉耐药性的原理目前还不甚清楚,有资料显示[10],不同个体的肿瘤对这两类药物的敏感性不同,体内示踪研究表明[11]这两类药物的芳香化酶抑制作用相同,均可达到98%或以上,因此不能用循环血中雌激素水平的差别解释二者的无交叉耐药性,也许肿瘤内部的芳香化酶抑制作用不同,确切机制有待今后进一步研究加以明确。目前有关无交叉耐药性的临床研究主要是在先用芳香化酶抑制剂后用灭活剂的患者中进行,至于相反用药顺序只有1项研究报道[12],先用依西美坦失败后再采用非甾体类芳香化酶抑制剂也显示出同样的疗效。最佳用药顺序目前尚不确定,需严谨的随机双盲对照临床研究给予明确的答案。
本研究中显示,年龄≥60岁患者的临床获益率高于年龄<60岁患者,说明年龄大患者更容易从内分泌治疗中获益,因此对这类患者决不能放弃内分泌治疗这一有效的治疗手段。本研究中依西美坦的临床疗效在不同无病间期、不同内分泌用药方式、有无内脏转移及不同受体状态的患者中差异无统计学意义。文献报道有内脏转移的患者临床疗效差[4,13],但也有相反的报道[6],这有待进一步扩大病例数加以评价。本研究中所有患者均无严重不良反应发生,可见依西美坦的耐受性好。
总之,本研究结果显示依西美坦与其他内分泌药物包括非甾体类芳香化酶抑制剂之间无明显交叉耐药作用,依西美坦在非甾体类芳香化酶抑制剂经治失败的绝经后内分泌治疗反应型晚期乳腺癌患者中仍能取得较好的临床疗效,仍是一个可以选择的安全有效的治疗手段。
[1] Nabholtz JM, Buzdar A, Pollak M, et al. Anastrozole is superior to tamoxifen as first-line therapy for advanced breast cancer in postmenopausal women: results of a north american multicenter randomized trial[J]. J Clin Oncol, 2000, 18(22):3758-3767.
[2] Mouridsen HT. Letrozole in advanced breast cancer: the PO25 trial[J]. Breast Cancer Res Treat, 2007, 105(Suppl 1): 19-29.
[3] Paridaens RJ, Dirix LY, Beex LV, et al. Phase Ⅲ study comparing exemestane with tamoxifen as first-line hormonal treatment of metastatic breast cancer in postmenopausal women: The European Organisation for Research and Treatment of Cancer Breast Cancer Cooperative Group[J].J Clin Oncol, 2008, 26(30): 4883-4890.
[4] Lonning PE, Bajetta E, Murray R, et al. Activity of exemestane in metastatic breast cancer after failure of nonsteroidal aromatase inhibitors: a phase Ⅱ trial[J]. J Clin Oncol,2000, 18(11): 2234-2244.
[5] Steele N, Zekri J, Coleman R, et al. Exemestane in metastatic breast cancer: Effective therapy after third-generation nonsteroidal aromatase inhibitor failure[J]. Breast, 2006, 15(3):430-436.
[6] Chin YS, Beresford MJ, Ravichandran D, et al. Exemestane after non-steroidal aromatase inhibitors for post-menopausal women with advanced breast cancer[J]. Breast, 2007,16(4): 436-439.
[7] Higa GM. Exemestane: treatment of breast cancer with selective inactivation of aromatase[J]. Am J Health Syst Pharm, 2002, 59(22): 2194-2201.
[8] Brueggemeier RW. Overview of the pharmacology of the aromatase inactivator exemestane[J]. Breast Cancer Res Treat, 2002, 74(2): 177-185.
[9] Buzdar AU, Robertson JF, Eiermann W, et al. An overview of the pharmacology and pharmacokinetics of the newer generation aromatase inhibitors anastrozole, letrozole and exemestane[J]. Cancer, 2002, 95(9): 2006-2016.
[10] Miller WR, Anderson TJ, Evans DB, et al. An integrated view of aromatase and its inhibition[J]. J Steroid Biochem Mol Biol, 2003, 86(3-5): 413-421.
[11] Lonning PE. Comparison between aromatase inhibitors and sequential use[J]. J Steroid Biochem Mol Biol, 2003, 86(3-5): 275-282.
[12] Bertelli G, Garrone O, Merlano M, et al. Sequential treatment with exemestane and non-steroidal aromatase inhibitors in advanced breast cancer[J]. Oncology, 2005, 69(6): 471-477.
[13] 刘晓晴, 宋三泰, 刘基巍, 等. 依西美坦治疗绝经后晚期乳腺癌的临床研究[J]. 中华肿瘤杂志, 2003, 25(5): 741-744.
