VEGF及EGFR在非小细胞肺癌组织中的表达及临床意义
2010-08-14宋懿懿顾爱琴韩宝惠张少俊
宋懿懿 顾爱琴 韩宝惠 张少俊
1.上海交通大学附属胸科医院呼吸内科 ,上海 200030;2.上海交通大学研究生院医学院分院,上海 200025;3.上海同济大学附属肺科医院结核科,上海 200433
血管内皮生长因子(vascular endothelial growth factor,VEGF)是一种重要的血管生成调控因子,其与受体结合后会导致血管内皮细胞的分裂、增殖和迁移,促进肿瘤新生血管形成,其过度表达往往与肿瘤细胞的生长活跃程度密切相关[1]。表皮生长因子受体(epidermal growth factor receptor,EGFR)是Ⅰ型酪氨酸激酶受体基因家族成员之一,酪氨酸激酶受体RTKs是细胞膜表面的一种蛋白,主要参与细胞的信号转导,一旦被激活就会导致细胞的分化、增殖、浸润和血管发生[2]。近年来研究发现,EGFR与70%以上的恶性肿瘤有关,在NSCLC、乳腺癌、前列腺癌和胃肠道肿瘤组织中均有EGFR的过度表达。Byers等[3]将VEGF和EGFR作为NSCLC的重要治疗靶点,通过抑制两者,可以明显阻止肿瘤细胞的生长和转移。本研究应用免疫组织化学方法观察NSCLC肿瘤组织中VEGF和EGFR的表达,分析两者的相关性,并探讨两者表达水平与NSCLC临床、病理特征以及预后的关系。
1 资料和方法
1.1 标本来源 收集本院2003年11月—2004年12月间手术切除的,术后病理诊断确诊为NSCLC的存档石蜡组织标本186例。所有患者术前均未接受化疗、放疗或其他抗癌治疗。186例患者,年龄25~70岁,平均年龄(51±10)岁;男性123例,女性63例;其中非吸烟患者70例,吸烟患者116例;鳞癌111例,腺癌75例;中央型肺癌97例,周围型肺癌89例;中、高分化者148例,低分化者38例;有淋巴结转移的114例,无淋巴结转移的72例;生存时间<3年的75例,≥3年的111例,生存时间<5年的119例,≥5年的67例。TNM分期根据1997年国际抗癌联盟(UICC)分期标准进行,其中Ⅰ~Ⅱ期106例, Ⅲ~Ⅳ期80例。全部病例采取电话或信件随访方式,随访截止日期到2009年12月31日。
1.2 试剂 Dako REALTMEnVisionTM为Dako公司产品,人抗VEGF和EGFR单克隆抗体(浓缩型1∶50稀释),poly-L-lysine多聚赖氨酸(GLV-0040),trypsin胰蛋白酶,显色剂DAB Kit均购自福州迈新生物技术开发有限公司。
1.3 检测方法 采用EnVision法,首先用poly-L-lysine 处理载玻片,连续石蜡切片4 μm,60 ℃烘干处理1 h,常规脱蜡、水化组织切片;pH=6.0的柠檬酸修复液修复VEGF抗原,胰蛋白酶消化、修复处理EGFR抗原;切片用蒸馏水冲洗1次(每次3 min),PBS冲洗2次(每次3 min);3%H2O2处理片子10 min,以抑制内源性过氧化物酶,再用PBS冲洗片子3次(每次3 min);滴加一抗,置于湿盒内,4 ℃反应过夜;PBS冲洗片子3次(每次3 min),滴加EnVisionTM反应30 min,PBS冲洗片子3次(每次3 min);DAB显色3~5 min;苏木精对比复染,中性树脂封固。
1.4 结果判断标准 阳性肿瘤细胞判定标准:VEGF主要表达于肿瘤细胞的细胞质中,EGFR主要表达于肿瘤细胞的细胞膜上,光学显微镜下细胞质或细胞膜有棕黄色颗粒且细胞形态结构清晰;细胞着色明显高于背景底色;棕黄色颗粒明确,定位性好,不向外扩散[4]。采用染色指数法计算阳性结果,综合考虑阳性细胞百分数和染色强度。阳性细胞数计分方法:0~5%为0分,5%~25%为1分,26%~50%为2分,51%~75%为3分,76%以上为4分;染色强度计分方法:肿瘤细胞不着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。如在同一病变中存在不同评分标准的视野,则取最大值和最小值的平均值作为评分结果。上述2项之和即为该肿瘤细胞的染色指数评分,染色指数0~2分定义为阴性表达,3~7分定义为阳性表达。
1.5 统计处理 应用SPSS 13. 0统计软件进行统计分析,NSCLC组织中EGFR和VEGF的表达与患者临床病理特征之间的关系用χ2检验,生存分析采用Kaplan-Meier法,配对资料采用Spearman等级相关分析,检验水准α=0.05,以P<0.05为差异有统计学意义。
2 结 果
2.1 VEGF和EGFR蛋白的表达 VEGF主要表达于肿瘤细胞的细胞质中,阳性表达位于肿瘤细胞的细胞质或细胞膜上,呈棕黄色或棕褐色,阳性产物呈弥漫或散在的棕黄或褐色颗粒(图1A和图1B)。EGFR主要表达于肿瘤细胞的细胞膜上,阳性表达位于肿瘤细胞的细胞膜或细胞质中,呈棕黄色或棕褐色,阳性产物呈弥漫或散在的棕黄或褐色颗粒(图1C和图1D)。NSCLC组织中VEGF阳性表达率为35.48%(66/186),EGFR阳性表达率为55.91%(104/186)。
2.2 VEGF和EGFR表达与临床及病理特征的关系 VEGF阳性表达率在有无淋巴结转移分别为41.23%和26.39%,两者经比较,差异有统计学意义(P=0.039),而与患者的性别、年龄、是否吸烟、肿瘤病理类型、肿瘤生长部位、肿瘤分期(TNM分期)和肿瘤分化程度等,差异无统计学意义。EGFR阳性表达率在男性、吸烟和鳞癌患者中,明显低于女性、未吸烟和腺癌患者(P<0.05),在N1~N3、Ⅲ~Ⅳ期患者中明显高于N0、Ⅰ~Ⅱ期患者(P<0.05),而与患者的年龄、肿瘤生长部位和肿瘤分化程度等无相关性(表1)。

图1 NSCLC组织中VEGF及EGFR的表达Fig.1 Expression of VEGF(A-B) and EGFR(C-D) in NSCLC(DAB, ×200)
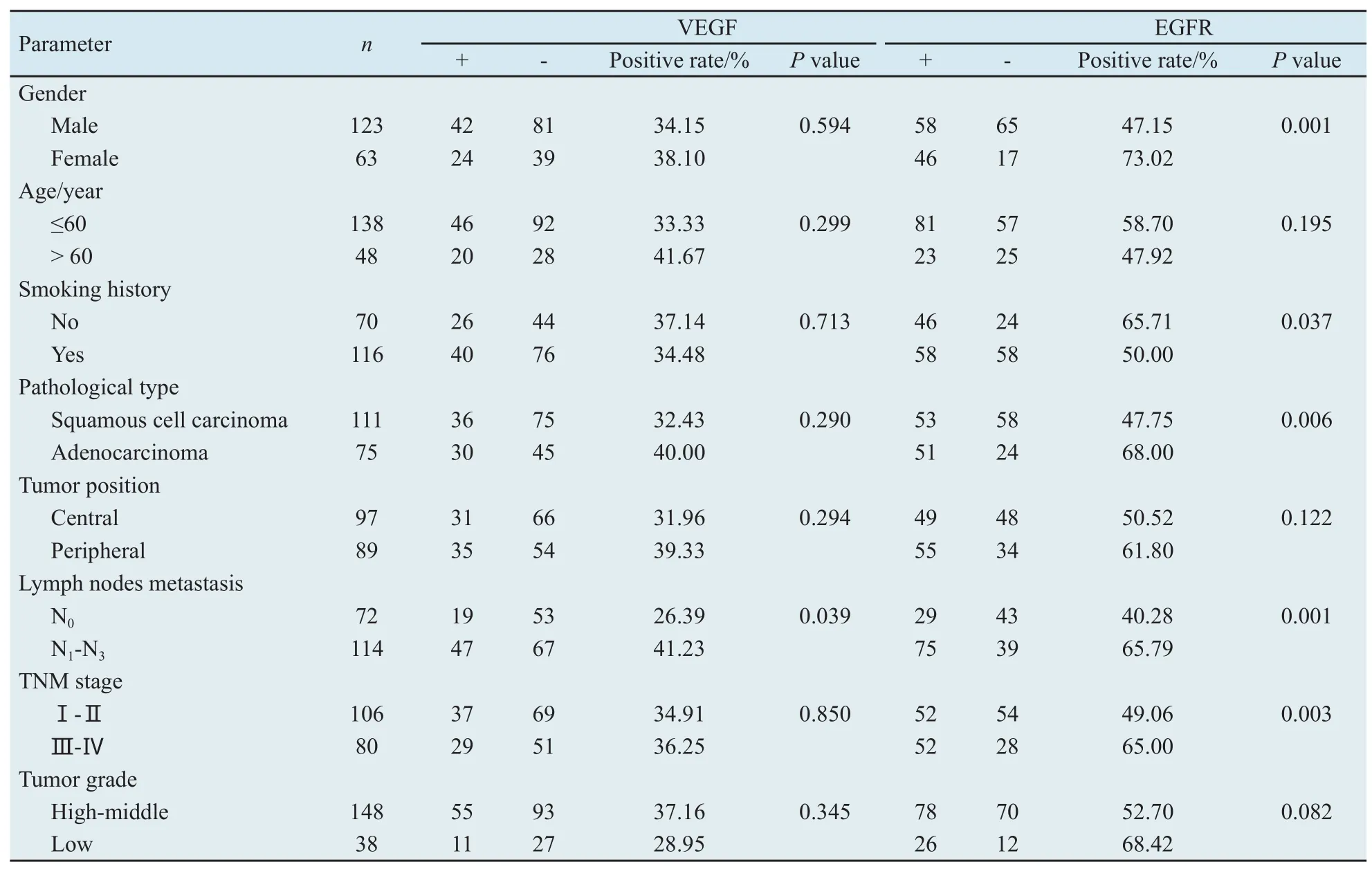
表1 VEGF和EGFR的表达与NSCLC患者临床、病理特征之间的关系Tab.1 Relationship between expression of VEGF and EGFR, and clinical pathological characteristics of NSCLC patients
2.3 VEGF及EGFR的表达与预后的关系VEGF表达阴性组患者3年生存期明显优于VEGF表达阳性组患者,两者差异具有统计学意义(P=0.021)。EGFR表达阴性组患者3年生存期亦优于EGFR表达阳性组患者,两者差异有统计学意义(P=0.033)。同样,VEGF表达阴性组患者5年生存期明显优于VEGF表达阳性组患者,两者差异有统计学意义(P=0.031)。EGFR表达阴性组患者5年生存期亦优于EGFR表达阳性组患者,两者差异有统计学意义(P=0.047,表2)。对VEGF表达阳性组和VEGF表达阴性组作Kaplan-Meier生存分析,进行Generalized Wilcoxon检验(P=0.012),VEGF蛋白表达对患者的生存率有显著的影响,VEGF表达阳性组患者的生存率明显小于VEGF表达阴性组患者(图2A)。同样,对EGFR表达阳性组和EGFR表达阴性组作Kaplan-Meier生存分析曲线,同样行Generalized Wilcoxon检验(P=0.009),EGFR蛋白表达对生存率有极显著影响,EGFR表达阳性组患者的生存率小于EGFR表达阴性组患者(图2B)。
2.4 NSCLC患者肿瘤组织中VEGF和EGFR表达的相关性 186例NSCLC患者中,VEGF、EGFR同时阳性表达的是44例,同时为阴性表达的60例,VEGF阳性表达而EGFR阴性表达者22例,VEGF阴性表达而EGFR阳性表达者60例。经Spearman等级相关分析显示,NSCLC组织中VEGF与EGFR的表达具有相关性(rs=0.161,P<0.05)。
3 讨 论
有文献报道原位杂交检测结果显示,VEGF mRNA主要分布在肿瘤细胞中,而肿瘤细胞外缺乏VEGF mRNA,提示VEGF是由肿瘤细胞产生的。VEGF的表达与NSCLC患者是否有淋巴结转移密切相关,VEGF表达阳性者,淋巴结转移明显增高[5]。多数研究显示[6],VEGF的表达与NSCLC的预后有显著的相关性,高表达者预后较差。一般认为,在NSCLC中VEGF的表达与性别、年龄及肿瘤分期没有明显相关性。本研究186例NSCLC患者中,VEGF的阳性表达率为35.48%(66/186),其表达水平在有淋巴结转移的患者中明显高于无淋巴结转移者,两者比较,差异有统计学意义(P<0.05);且VEGF表达阴性组患者3年和5年生存期明显优于VEGF表达阳性组患者,二者差异同样有统计学意义(P<0.05);VEGF蛋白表达对生存率有显著影响,VEGF表达阳性组患者的生存率小于VEGF表达阴性组患者(P=0.012)。
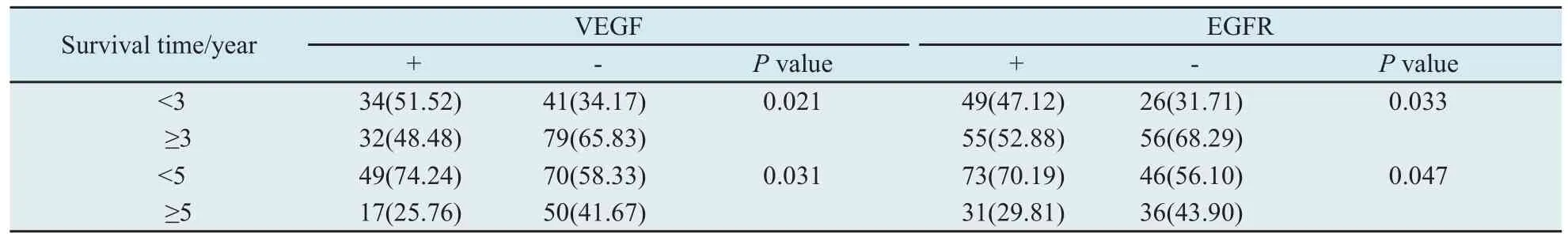
表2 VEGF、EGFR的表达与NSCLC患者生存期的关系Tab.2 Relationship between expression of VEGF, EGFR and survival of NSCLC patients n(%)

图2 VEGF、EGFR在NSCLC组织中高表达的生存分析Fig.2 Survival analysis of expression of VEGF, EGFR in NSCLC tissues
EGFR的高表达可导致癌变,促进肿瘤细胞生长、侵袭、新生血管形成及远处转移[7]。最近国内外的研究发现[8],EGFR在女性NSCLC患者中表达高于男性患者,可能与女性患者EGFR的基因突变高于男性有关。女性NSCLC患者中EGFR的表达与病理类型、TNM分期及是否有淋巴结转移有密切的关系,可作为判断女性NSCLC病情进展及预后的重要指标之一,还对其靶向治疗的选择有一定的指导意义。本研究结果证实上述结果,186例NSCLC患者中,EGFR的阳性表达率为55.91%(104/186),发现EGFR阳性表达率在男性、吸烟和鳞癌患者中明显低于女性、未吸烟和腺癌患者(P<0.05),在N1~N3、Ⅲ~Ⅳ期患者中明显高于N0、Ⅰ~Ⅱ期患者(P<0.05);且EGFR表达阴性组患者3年和5年生存期优于EGFR表达阳性组患者,二者差异具有统计学意义(P<0.05);EGFR蛋白表达对生存率有极显著影响,EGFR表达阳性组患者的生存率小于EGFR表达阴性组(P=0.009)。
VEGF和EGFR是恶性肿瘤细胞形成过程中的重要基因调控靶点,二者促进了肿瘤的发展并参与了肿瘤的浸润和转移[3]。本研究发现186例NSCLC患者VEGF和EGFR同时阳性表达者为44例,同时阴性表达者为60例,VEGF阳性表达而EGFR阴性表达者22例,VEGF阴性表达而EGFR阳性表达者60例,VEGF与EGFR在NSCLC组织中的表达具有相关性,这与赵学维等[9]报道的结论一致。可能由于癌基因EGFR的激活引起了细胞过度增殖,使细胞对氧的需求增加,从而促使VEGF表达上调。VEGF一方面通过旁分泌的方式作用于血管内皮细胞,与血管内皮细胞上的受体结合,引发一系列信号转导,刺激内皮细胞分化和血管生成。另一方面,VEGF可能通过VEGF/NRP-1自分泌信号途径增强肿瘤自身的存活能力和侵袭活性。同时,VEGF可诱导抗凋亡蛋白Bcl-2的表达,直接抑制肿瘤细胞的凋亡。在NSCLC的靶向治疗中,VEGF和EGFR是非常重要的靶点。ZD6474是一种口服的、小分子量的VEGFR酪氨酸激酶抑制剂,同时具有抑制EGFR酪氨酸激酶活性作用,既可以通过阻断VEGF活性而抑制肿瘤血管生成,又可以抑制肿瘤增生和存活。此外,EGFR抑制剂本身可以减低肿瘤组织表达VEGF及其他促血管生成因子,并可以抑制肿瘤内皮细胞上的EGFR,因此也表现出抗肿瘤血管生成的作用。Matsumori等[10]应用ZD6474,成功抑制了NSCLC模型肿瘤的生长。
总之,NSCLC组织中VEGF和EGFR存在过度表达,两者表达具有相关性;可作为判断NSCLC患者病情及预后的参考指标,也为肺癌患者采用个体化治疗提供新的依据。
[1] Hainsworth JD, Spigel DR, Farley C, et al. Phase Ⅱ trial of bevacizumab and erlotinib in carcinomas of unknown primary site: the Minnie Pearl Cancer Research Network[J]. J Clin Oncol, 2007, 25: 1747-1752.
[2] Krause DS, Richard A, Etten V, et al. Tyrosine kinases as targets for cancer therapy[J]. New Engl J Med, 2005,2(353): 172-187.
[3] Byers LA, Heymach JV. Dual targeting of the vascular endothelial growth factor and epidermal growth factor receptor pathways: rationale and clinical applications for non-smallcell lung cancer[J]. Clin Lung Cancer, 2007, 8(Suppl 2):79-85.
[4] Mukohara T, Kudoh S, Yamauchi S, et al. Expression of epidermal growth factor receptor (EGFR) and downstream activated peptides in surgically excised non-small cell lung cancer(NSCLC)[J]. Lung Cancer, 2003, 41: 123-130.
[5] Li Q, Dong X, Gu W, et al. Clinical significance of coexpression of VEGF2C and VEGFR23 in non-small cell lung cancer[J]. Chin Med, 2003, 116: 727-730.
[6] Yano T, Tanikawa S, Fujie T, et al. Vascular endothelial growth factor expression and neovascularization in non-small cell lung cancer[J]. Eur J Cancer, 2000, 36(5): 601.
[7] Herbst RS, Shin DM. Monoclonal antibodies to target epidermal growth factor receptor-positive tumors: a new paradigm for cancer therapy[J]. Cancer, 2002, 94: 1593-1611.
[8] Wu YL, Zhong WZ, Li LY, et al. Epidermal growth factor receptor mutations and their correlation wit h gefitinib therapy in patients with non-small cell lung cancer: a meta-analysis based on updated individual patient data from six medical centers in mainland China[J]. J Thorac Oncol, 2007, 2:430-439.
[9] 赵学维, 孙光远, 李兵, 等. 非小细胞肺癌组织中表皮生长因子受体和血管内皮生长因子的表达及临床意义[J].第二军医大学学报, 2008, 29(1): 72-76.
[10] Matsumori Y, Yano S, Goto H, et al. ZD6474, an inhibitor of vascular endothelial growth factor receptor tyrosine kinase,inhibits growth of experimental lung metastasis and production of malignant pleural effusions in a non-small cell lung cancer model[J]. Oncol Res, 2006, 16: 15-26.
