次级淋巴组织趋化因子和甲胎蛋白共修饰的树突状细胞诱导特异性抗肝癌免疫作用的研究
2010-08-14侯静李明峰熊伟民何新颖邸立军任军
侯静 李明峰 熊伟民 何新颖 邸立军 任军
1.中国人民解放军第四五五医院消化肿瘤科,上海 200052;2.北京大学临床肿瘤学院,北京肿瘤医院肿瘤内科,北京 100036
树突状细胞(dendritic cell,DC)是体内功能最强的专职抗原递呈细胞(antigen-presenting cell,APC),也是惟一能诱导初次免疫应答的APC,在机体免疫反应中发挥着重要作用。次级淋巴组织趋化因子(secondary lymphoid tissue chemokine,SLC),是一种CC族趋化因子,定位于人染色体9p13,其前体蛋白由134个氨基酸组成,且其N端有23个氨基酸组成的信号肽,高表达于人次级淋巴组织中的小静脉内皮上[1]。其受体CCR7不仅表达于初始T细胞、B细胞和DC[2-3],且在多种肿瘤细胞中亦高表达,如乳腺癌、胃癌、胰腺癌和黑色素瘤等。Kikuchi等[4]研究发现,SLC不仅促使成熟DC由周缘组织向区域淋巴结迁移,而且还能增强成熟DC对不同抗原的吞噬作用。对多种免疫细胞特别是T淋巴细胞、成熟DC、天然杀伤细胞(natural killer cell,NK)及B淋巴细胞均有趋化作用。正是由于SLC对DC的巨大趋化作用,可以通过SLC基因修饰DC疫苗的方法来提高DC抗肿瘤的免疫应答性。
甲胎蛋白(alpha-fetoprotein,AFP),是一种重要的胚胎期及肝癌相关蛋白, 正常情况下新生儿出生后,AFP表达即关闭。但如果肝细胞发生癌变或发生化学或物理损伤时,AFP基因又可重新表达。AFP表达量的异常增高,临床上可作为肝癌的一个诊断和预后指标。因此,制备AFP特异性的疫苗,诱导针对AFP的特异性的免疫反应,可为肝细胞癌的治疗提供一种新思路。
本研究组前期已构建获得携带人AFP基因的慢病毒表达载体,并应用该载体感染DC,激发特异性细胞毒性T淋巴细胞(cytotoxic lymphocyte,CTL)的活性[5],本实验拟进一步探讨SLC联合AFP共转染DC是否可起到协同的作用,增强CTL效应,.提高对肝癌细胞株体外杀伤力,为临床肝癌治疗提供实验依据。
1 材料和方法
1.1 材料 慢病毒载体系统(Tronolab)由中国科学院上海生命科学研究院生物化学与细胞生物学研究所提供,该病毒包装系统为4质粒系统,其中包括载体质粒Pwpxl-MOD2,能表达绿色荧光蛋白(green fluorecent protein,GFP)及质粒pRsv-REV、pMDlg-pRRE和pMD2G,含有病毒包装所必须的元件;人肝癌细胞系HepG2和人T淋巴细胞白血病细胞A3购自美国BioHermes公司;293T细胞购自美国典型培养物保藏中心(American Type Culture Collection,ATCC);限制性内切酶BamHⅠ和SalⅠ购自日本TaKaRa公司;DMEM、RPMI1640干粉、Ficoll淋巴细胞分离液和Opti-MEM无血清培养液购自美国Gibco公司;IL-4、GM-CSF和TNF-α购自美国Bioscience公司;胎牛血清购自美国Hyclone公司。
1.2 方法
1.2.1 CD34+造血干细胞来源DC的体外培养和扩增 以多西他赛120 mg/m2单药动员肝癌患者外周造血干细胞,当WBC<1.0×109个/L时,给予G-CSF动员干细胞,WBC>3.0×109个/L时用MCS+血细胞分离机采集外周血CD34+干细胞,当CD34+细胞>1.5×106个/kg为采集成功。取CD34+细胞采集物,PBS洗涤去除RBC。以2×106个/孔的细胞密度接种6孔平板,加入含5%人AB血清、100 IU/mL青霉素、链霉素 2 μmol/L、L-谷氨酰胺30 μg/L、IL-4 10 ng/mL和GM-CSF 4 ng/mL的RPMI1640,37 ℃、CO2体积分数为5%的培养箱中培养,第3天半量补充IL-4和GM-CSF,5~7 d后加入TNF-α 50 ng/mL继续培养以促使DC成熟[6]。
1.2.2 DC的致敏或诱导 体外培养HepG2细胞,调整细胞密度为1×108个/mL,反复快速冻融4次后,5 000 r/min离心30 min,取上清液与培养到第7天的DC混合培养,以肿瘤抗原致敏DC。
按照参照文献提供的方法构建携带AFP基因的慢病毒表达载体[5],并以Lenti-EGFP慢病毒(MOI=10)作为对照组,倒置荧光显微镜每隔12 h观察,72 h后收集细胞,FACs检测GFP阳性细胞数。
构建携带SLC基因的慢病毒表达载体,方法同上,将慢病毒载体Lenti-AFP和Lenti-SLC采取分别和同时的方法转染DC继续培养,方法同上。
1.2.3 T淋巴细胞的制备及混合淋巴细胞反应 取同一个体外周血,Ficoll常规分离单个核细胞,在37 ℃、CO2体积分数为5%的培养箱中培养2 h后,吸出悬浮细胞,用培养液调整其细胞密度为1×107个/mL,分以下几组按照淋巴细胞与DC细胞数量比为10∶1的比例混合培养:Ⅰ组为T细胞(空白对照),Ⅱ组加正常的DC,Ⅲ组加肿瘤抗原致敏的DC,Ⅳ组加慢病毒载体Lenti-AFP转染的DC,Ⅴ组加慢病毒载体Lenti-SLC转染的DC,Ⅵ组加慢病毒载体Lenti-AFP和Lenti-SLC共转染的DC。共培养3 d,上清液通过ELISA法检测IL-2、IL-12和IL-18等细胞因子的含量,收集的细胞作为效应细胞。每3 d半量换液,补充PHA和rhIL-2(促进DC的成熟,增强DC的抗原提呈能力),于37 ℃、CO2体积分数为5%的饱和湿度培养箱中培养7 d。MTT法测定波长570 nm的吸光度值(A),按下列公式计算刺激指数(stimulating index,SI):SI=A实验组/A空白对照组。然后调整淋巴细胞与DC数量比分别至20∶1、50∶1和100∶1,同样按照上述Ⅰ至Ⅵ的分组重复以上实验步骤,以比较不同比率下淋巴细胞的增殖能力。每组计数3次,取平均值。
1.2.4 CTL杀伤效应的检测 HepG2于37 ℃解冻后,接种于含10%胎牛血清的DMEM培养液的50 mL培养瓶中,隔日换液1次。收集对数生长期的HepG2细胞作为靶细胞加于96孔板中,每孔50 μL,含1×104个细胞。ELISA方法检测AFP,具体步骤按照试剂盒说明书进行操作。以Unpulsed DC-primed T cell,HepG2 tumor lysate-primed T cell,Lenti-AFP-DC-primed T cell,Lenti-SLC-DC-primed T cell,Lenti-AFP/Lenti-SLC-DC-primed T cell分别作为效应细胞,按不同效靶比(20∶1、50∶1、100∶1)分别加入相应数量的效应细胞。另设培养液为对照孔,效、靶细胞自然释放孔,各组均设3个复孔。于温箱中培养4 h,靶细胞最大释放孔提前45 min加10 μL裂解液,离心,每孔吸取上清液50 μL转入另一96孔板中,加入50 μL LDH底物反应液,室温避光放置30 min,每孔加50 μL反应终止液,酶标仪490 nm处测A值。CTL杀伤率=(A实验组平均值-A靶细胞自然释放组平均值-A效应细胞自然释放组平均值)/(A靶细胞最大释放组平均值-A靶细胞自然释放组平均值)×100%。
为了检测肿瘤杀伤的特异性,将人T淋巴细胞白血病细胞A3解冻培养后与肿瘤抗原致敏的DC诱导的CTL进行反应,用相同的方式处理表达AFP的HepG2,收集两种样品的上清液分别用ELISA试剂盒检测IFN-γ含量。
2 结 果
2.1 CD34+造血干细胞诱导DC形态和表型CD34+造血干细胞接种6孔板培养3 d,观察到细胞表面伸出毛刺样突起,细胞体积明显增大,呈集落样生长;IL-4、GM-CSF 和TNF-α培养7~9 d后细胞出现典型树枝状突起(图1A)。流式细胞仪检测培养细胞表型。CD1a、CD11c、CD80、CD86、CD40和HLA-DR高表达(图1B),说明培养细胞为成熟DC。
2.2 致敏DC荧光图 慢病毒载体感染DC(MOI=10)48 h荧光显微镜荧光下的DC细胞。通过流式细胞仪检测,感染效率较高,均为78.91%左右(图2)。
2.3 混合淋巴细胞反应检测 将同源淋巴细胞与致敏DC混合培养7 d后,结果显示:经抗原冲击的DC和未经冲击的DC均能刺激淋巴细胞增殖,有大的细胞克隆形成。经MTT法检测,肿瘤抗原致敏的DC和Lenti-AFP转染的DC刺激淋巴细胞增殖的能力无明显差异(P>0.05),Lenti-SLC转染的DC和Lenti-AFP/Lenti-SLC转染DC刺激淋巴细胞增殖的能力也无明显差异(P>0.05),但较前两者有明显增强(P<0.05)。淋巴细胞与DC的数量比为50∶1时,DC刺激淋巴细胞增殖的效果最为显著(P<0.05)。
2.4 致敏DC诱导的CTL对肝癌细胞株的杀伤作用 经Lenti-SLC转染的DC和Lenti-AFP/Lenti-SLC 转染的DC和T淋巴细胞混合培养作为效应细胞,表达AFP的肝癌细胞株HepG2作为靶细胞,不同效靶比(20∶1、50∶1和100∶1)LDH法诱导的CTL杀伤率显著高于未经冲击的DC、肿瘤抗原致敏的DC和Lenti-AFP转染的DC和T淋巴细胞混合培养组(P<0.05,P<0.01)。从效靶比来看,前3组随着效靶比增加,CTL对表达AFP的HepG2的杀伤作用逐渐增强,于效靶比50∶1时达到最高峰(P<0.01,图3)。

图1 CD34+造血干细胞诱导的DCFig.1 Characteristics of the dendritic cells originated from CD34+ cells
刺激增殖的T淋巴细胞分别和HepG2、A3肿瘤细胞共培养20 h。当用表达AFP的HepG2细胞株进行杀伤实验时,上清液中含有高浓度的IFN-γ,而用A3细胞株进行杀伤实验时,测得上清液中IFN-γ含量极少(图5A)。另外,MHC-Ⅰ抗体可阻断其溶细胞作用(图5B)。这些结果表明,表达AFP的HepG2肿瘤抗原致敏的DC只能诱导具有MHC-Ⅰ限制性特异肿瘤细胞的免疫反应。

图3 各组DC刺激T淋巴细胞增殖的刺激指数Fig.3 Stimulation index of DC in stimulating lymphocyte proliferation in different groups
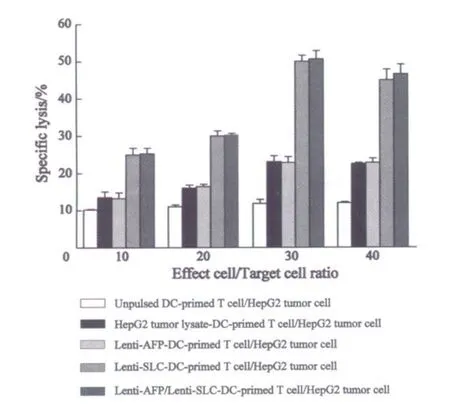
图4 不同效靶比下诱导的CTL对HepG2细胞的杀伤作用Fig.4 Anti-tumor activity of CTL on HepG2 cells
3 讨 论
近年来,随着免疫学、分子生物学的发展,以肿瘤免疫治疗为代表的生物治疗已成为肿瘤治疗的热点,其通过调节和增强机体免疫力来抑制和杀伤癌细胞,激发特异性抗肿瘤免疫,尤其可能在控制肿瘤复发转移过程中发挥重要作用,可作为肿瘤常规治疗后重要的辅助治疗手段之一[7]。
原发性肝癌(primary hepatic carcinoma,PHC)是发病率高、治疗困难且死亡率高的恶性肿瘤之一,目前尚无根治的方法,特别是肝癌到了中晚期,现有的治疗手段更不尽人意。AFP是诊断PHC公认的肿瘤标志物,是人胚胎时期肝细胞和卵黄囊细胞产生(胃肠道黏膜也可产生)的一种特殊糖蛋白。正常肝细胞不产生AFP,癌变的肝细胞则重新获得合成AFP的能力,且随着病程呈持续阳性。本实验中用表达AFP的HepG2细胞株进行杀伤实验时,测得上清液中含有高含量的IFN-γ,而用人T淋巴细胞白血病A3细胞株进行杀伤实验时,上清液中IFN-γ含量极少,说明诱导的CTL特异杀伤AFP阳性的肝癌细胞株。因此,肝癌相关性抗原AFP可作为治疗肝癌的靶目标,应用AFP基因转染DC制备疫苗有望成为肝癌的一种免疫治疗手段,同时也为进一步研究DC疫苗在肝癌中的临床应用创造了条件。
SLC是CC亚族的趋化因子,主要在高内皮静脉、脾脏以及淋巴结等次级淋巴组织内有较高的表达。SLC是被论证的第一个具有介导淋巴细胞归巢到外周淋巴器官特性的趋化因子。淋巴细胞表面趋化因子受体CCR7的表达调控淋巴细胞向次级淋巴组织的归巢。SLC对DC也有关键的作用。在DC的分化成熟过程中,趋化因子受体表达谱发生改变,所有非成熟DC在受到炎性刺激后,原来所表达的受体CCR、CCR2、CCR5和CCR6等均下降,并都出现CCR7表达的上调,后者是成熟DC唯一表达的趋化因子受体。目前认为外周DC向淋巴组织的迁移都是通过ELC/SLC[8]与CCR7作用这条途径。SLC还可与其他细胞因子联合应用于免疫治疗。正因为SLC有如此强大的趋化作用,所以可通过募集APC和淋巴细胞、改变肿瘤微环境的免疫抑制状态来实现有效的抗肿瘤免疫应答。

图5 IFN-γ的检测和肿瘤特异性细胞免疫反应Fig.5 IFN-γ detection and tumor-specific cytotoxicity
本研究首次将构建的含人AFP基因和SLC的慢性病毒同时转染DC,并获得了较高的感染效率。本研究将同源淋巴细胞与致敏DC混合培养后发现,经抗原冲击的DC和未经冲击的DC均能刺激T淋巴细胞增殖,经MTT法检测,Lenti-SLC转染的DC和Lenti-AFP/Lenti-SLC共转染DC刺激T淋巴细胞增殖的能力较肿瘤抗原致敏的DC和Lenti-AFP转染的DC明显增强,且对肝癌细胞株HepG2的杀伤率也得到了显著的提高,说明SLC对DC强大的趋化作用在抗肿瘤免疫中起到了关键作用,为应用SLC实现抗肿瘤免疫提供了实验依据,也为临床肿瘤的免疫治疗提供一条可行性方案。
综上所述,作为一种小分子免疫活性物质,SLC有着许多独特功能,其对淋巴细胞、DC的趋化作用[9]和血管抑制活性[10]及对某些Th1细胞因子的促分泌作用,使其有着很强的抗肿瘤免疫功效。实验证实,SLC单独使用虽然有效,但不十分理想,若与其他因子或治疗方法联合应用可明显提高抗肿瘤作用。因此,其可被视为一种良好的免疫佐剂,但其在机体使用的安全性尚待进一步证实,而且对于SLC生物学功能及其在抗肿瘤方面活性的测定等方面目前国内没有相关报道,这些都有待于更深层次的研究,相信对SLC的研究将为肿瘤生物免疫治疗提供广阔的前景。
[1] NagiraM, Imai T, Hieshima K, et al. Molecular cloning of a novel human CC chemokine secondary lymphoid tissue chemokine that is a potent chemoattractant for lymphocytes and mapped to chromosome 9p13 [J]. J Biol Chem, 1997,272(31): 19518-19524.
[2] Kwan J, Killeen N. CCR7 directs the migration of thymocytes into the thymic medulla [J]. J Immunol, 2004, 172(7):3999-4007.
[3] Ueno T, Saito F, Gray DH, et al. CCR7 signals are essential for cortex2 medulla migration of developing thymocytes [J]. J Exp Med, 2004, 200(4): 493-505.
[4] Kikuchi K, Yanagawa Y, Onoe K. CCR7 ligand enhanced phagocytosis of various antigens in mature dendritic cells-time course and antigen distribution different from phagocytosis in immature dendritic cells [J]. Microbiol Immunol, 2005,49(6): 535-544.
[5] 李明峰, 侯静. 携带AFP基因慢病毒载体制备并感染树突状细胞的实验研究[J]. 细胞与分子免疫学杂志, 2009,25(9): 791-793.
[6] He S, Cao Q, Yoneyama H, et al. MIP-3α and MIP-1α rapidly mobilize dendritic cell precursors into the peripheral blood [J]. J Leukoc Biol, 2008, 84(6): 1549-1556.
[7] 曲强, 周立. 肝细胞肝癌免疫治疗进展 [J]. 细胞与分子免疫学杂志, 2008, 24(4): 319-320.
[8] Luther SA, Bidgol A, Hargreaves DC, et a1. Defering activities of homeostatic chemokines CCL19, CCL21 and CXCL12 in lymphocyte and dendritic cell recruitment and lymphoid neogenesis [J]. J Immunol, 2002, 169(1): 424-433.
[9] Yoneyama H, Matsuno K, Zhang Y, et al. Regulation by chemokines of circulating dendritic cell precursors, and the formation of portal tract-associated lymphoid tissue, in a granulomatous liver disease[J]. J Exp Med, 2001, 193(1):35-49.
[10] Arenberg DA, Zlotnick A, Strom SR, et al. The murine CC chemokine, 6C-kine, inhibits tumor growth and angiogenesis in a human lung cancer SCID mouse model[J]. Cancer Immunol Immunother, 2001, 49(11): 587-692.
