霍尔多巴吉白鹅小鹅瘟病毒的分离与鉴定
2010-08-08单晓枫胡桂学
董 浩,马 磊,单晓枫,胡桂学
(1.吉林农业大学生命科学学院,吉林 长春 130118;2.吉林农业大学动物科学技术学院,吉林 长春 130118)
小鹅瘟即鹅的细小病毒病(GPV),又称Derzsy′s病,是雏鹅和雏番鸭的一种急性或亚急性败血性传染病,主要侵害3~20日龄雏鹅和雏番鸭,以出血性、纤维素性、渗出性肠炎为主要特征。该病传染快,发病率和死亡率高,是严重危害养鹅业的重要传染病之一。
近几年,吉林省多个地区的鹅业公司从匈牙利引进霍尔多巴吉白鹅种蛋进行孵化,扩充商品鹅资源。霍尔多巴吉白鹅具有个体大、体质健壮、抗病力强,可供多次活体拔毛,产绒率高、羽绒品质好,与当地普通白鹅相比具有明显的优势。本试验是在吉林省某鹅厂病死的霍尔多巴吉雏鹅体内进行采样鉴定,以确定其病因。
1 材料与方法
1.1 病料与鹅胚 病料取自吉林省某鹅厂10日龄霍尔多巴吉病死雏鹅组织;10日龄鹅胚由吉林省兽医研究所提供。
1.2 主要试剂与工具酶 小鹅瘟标准阳性血清由本实验室收藏;Tag酶,PCR相关试剂盒,胶回收试剂盒均购于TaKaRa(宝生物工程(大连)有限公司)。
1.3 病毒分离 无菌采集雏鹅肝、脾、胰腺等组织,剪碎,十字匀浆器研磨,以生理盐水制成1∶1匀浆;低温冻融3次,加双抗1000 IU(μg),37℃感做30 min;10000 r/min离心20 min,取上清液待检。取9~11日龄鹅胚,划蛋,打孔,取处理好的上清液接种0.2 mL/枚,封孔,37℃孵化。孵化期间每8 h观察1次,弃去24 h内死亡鹅胚,24 h后死亡的以及5 d后仍未死的鹅胚取出4℃保存。将保存的致死鹅胚和未死亡鹅胚无菌操作收集鹅胚尿囊液,-70℃保存备用。
1.4 病毒的电镜观察 取鹅胚尿囊液,12000 r/min离心10 min,取上清液置于铜网上,2%磷钨酸负染1~2min,电镜观察并照相。
1.5 小鹅瘟病毒的PCR检测
1.5.1 引物的设计 根据鹅细小病毒基因序列(Gen Bank登录号为GPU25749)设计并合成了1对引物P1/P2,扩增 GPV VP3基因片段 375 bp,由大连TaKaRa公司合成[1]。
P1:5′-CCAAGCTACAACAACCACATCTAC-3′;P2:5′-CTGCGGCAGGGCATAGACATCCGAC-3′
1.5.2 目的基因的扩增 以待检病毒鹅胚尿囊液为模板,以P 1、P2为引物,进行PCR扩增目的基因。PCR反应体系如下:10×Ex Taq Buffer 2.5μL,P1(20 pmol/μL)0.5 μL,P2(20 pmol/μL)0.5 μL,dNTP 2μL,模板DNA 2.5μL,四馏水 16.5μL,Ex TaqTMDNA聚合酶0.5μL,PCR反应条件为:95℃预变性 5 min,94℃变性 1 min、54℃退火 1 min、72℃延伸2 min,共30个循环;最后72℃彻底延伸10 min。PCR产物经1%琼脂糖凝胶电泳分析。
1.6 ELD50的检测 取1.3分离的病毒尿囊液,进行10倍系列稀释,并加入适量抗生素,过滤除菌。按0.2 m L/胚的接种量进行尿囊腔接种,每个稀释度接种6枚鹅胚,37℃孵育7 d。记录每个稀释度的死胚数。按Reed和Muench法[2]计算ELD50。
1.7 琼脂扩散试验[3]琼脂平板制作按参考文献[3]配制,打孔、封底。中心孔加入抗GPV标准阳性血清,周围孔分别加入接病料后的待测鹅胚尿囊液,以及空白对照和新城疫病毒阴性对照,湿盒37℃孵育18~36 h,观察试验结果。
2 结果
2.1 病毒分离结果 接种病料后鹅胚绒毛尿囊膜增厚,胚胎充血,翅膀、胸部、背部和头部均有出血点。大多数鹅胚死亡时间为3~5 d。
2.2 电镜观察结果 由电镜负染结果可知,病毒粒子直径约为20~22 nm左右,无囊膜,呈圆形或多角形,具有典型的鹅细小病毒特征。
2.3 PCR扩增结果 对样品进行PCR扩增,经过琼脂糖凝胶电泳在紫外灯下可见375 bp左右大小的片段,见图1。
2.4 ELD50测定结果 病毒的ELD50结果见表1,按 Reed和Muench法计算 ELD50。
根据表1,得到A株的ELD50:距离比值=(76.9-50)/(76.9-33.3)=0.62;lg ELD50=-5+0.62×(-1)=-5.62;ELD50=10-5.62/0.2 m L。
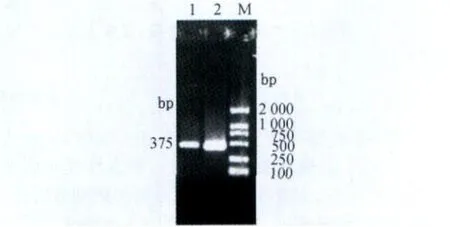
图1 PCR扩增结果
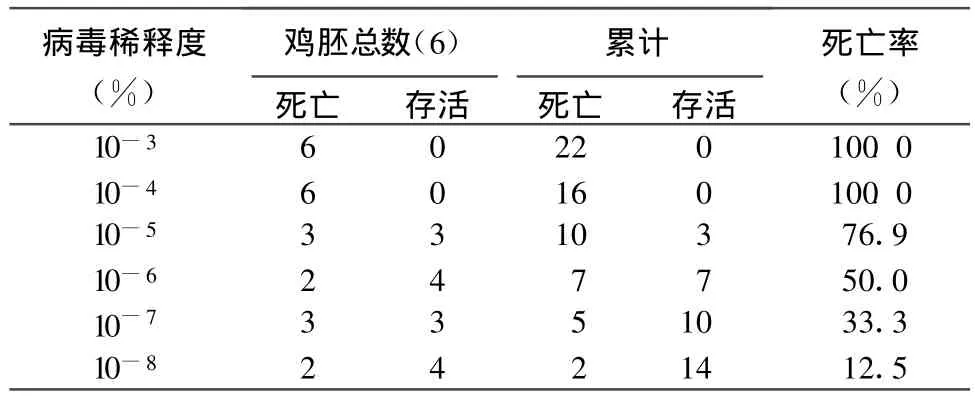
表1 A株ELD50的测定结果
2.5 琼脂扩散试验结果 待检病毒与GPV标准阳性血清出现比较清晰的沉淀线,而空白对照和新城疫病毒阴性对照均未出现沉淀线。
3 讨论
本次试验分离到的病毒株可以使鹅胚产生特征性病变并致死,通过电镜观察、PCR检测、血清学检查,均表明该病毒具有小鹅瘟病毒的典型特征,从而确认所分离到的病毒为小鹅瘟病毒。ELD50的测定结果为10-5.62/0.2 mL,与其他地区相关报道的小鹅瘟病毒的毒力相比要略高一些,这也正说明了小鹅瘟毒力的多变,对预防和治疗都增加了不小难度[4]。
本次发病的鹅群为霍尔多巴吉白鹅,此品种白鹅从匈牙利以种蛋形式引进我省,此次小鹅瘟病毒来源尚不能确定,种蛋带毒的可能也是存在的,需要进一步检验。
[1] 胡桂学,高光,邹啸环,等.小鹅瘟病毒分离与初步鉴定[J].经济动物学报,2002,6(2):411-433.
[2] 李桂霞,刘胜旺,孔宪刚,等.鹅细小病毒HG5/82株的分离鉴定及生物学特性的研究[J].中国预防兽医学报,2005,27(3):196-201.
[3] 霍峰,惠观涛.应用琼脂扩散法检测小鹅瘟抗原抗体[J].中国兽医杂志,2000,26(2):21-22.
[4] Karsten Hueffer.Th e natu ral host range shift and sub sequent evolu tion of canin e parvovirus resulted from viru s-specific binding to the canine transfer in receptor[J].Journalof Virology,2003,2:1718-1726.
