牛血清白蛋白对鲁米诺电化学发光的增敏作用
2010-08-06万明怡周梦云龙玉梅严吉林屠一锋
万明怡,周梦云,龙玉梅,严吉林,屠一锋
(苏州大学 材料与化学化工学部,江苏 苏州 215123)
电化学发光(ECL)分析是基于电化学反应引发的化学发光而建立起来的一种分析方法[1-3],常用的发光试剂有鲁米诺、联吡啶钌等,电化学氧化可使这些发光试剂氧化激发而发光,也可以通过氧化其它物质再与发光试剂发生化学氧化反应而发光,因此电化学发光可以有不同的发光历程,形成多种方式的分析机理.相对于较为经典的化学发光分析法,电化学发光分析有较为显著的优势,化学发光分析通过试剂混合发生化学反应产生发光,因而发光过程可控性较差,一般主要通过对反应试剂流路的控制来实现对发光信号的可重复的测量,但这种流路控制技术需要有较高的自动化程度和精度,需要较为复杂和较高成本的仪器设备,而电化学发光分析由于是以电化学氧化作为发光的能量源,因此发光过程可控性好,通过施加电压的方式来调节发光过程,可以实现在时间和空间上对发光过程的控制,测量易于实施,使用普通形式的电化学池即可实现分析目的,其灵敏度、重现性和稳定性等性能都十分优越,目前研究工作比较丰富,也已经有一定范围的应用,作为一种高灵敏的分析检测技术也越来越多地应用于生物体系.由于以鲁米诺为发光试剂的发光体系在中性介质中的ECL较弱,因此寻找更多可靠而实用的增敏剂很有研究意义.已有文献报道增敏剂如溶解氧[4]、H2O2[5]、氨基酸[6]及I-[7]等能增强其发光,并应用于一些生物活性分子的检测[8].本文将报道牛血清白蛋白(BSA)对鲁米诺ECL的增敏作用,实验发现,在pH8.0的缓冲溶液中,牛血清白蛋白对鲁米诺的电化学发光有较明显的增敏作用,本研究为探索一种新方法用于测定蛋白质提供了可能,也将扩大电化学发光分析的研究和应用范围.
1 实验部分
1.1 实验试剂及仪器
鲁米诺购自Fluka,牛血清白蛋白(BSA)购自Sigma.实验用水均为二次亚沸水,其它试剂均为分析纯.
仪器装置见参考文献[9],以数字脉冲发生器为信号源,经恒电位仪施加于三电极系统,以Pt电极为工作电极,Ag/AgCl为参比电极,Pt丝为对电极.微弱光测量仪采用光电倍增管测量电化学发光信号,负高压为800V,光电流经放大转换后由数字化接口传入计算机进行记录.
电极预处理:Pt电极经抛光剂抛光、亚沸水清洗即可.
1.2 实验条件及方法
脉冲幅值1.15V,上限电位0.85V,下限电位-0.3V;脉冲周期2s.
在电化学发光池中加入1mL待测溶液,用微量进样器注入20μL 10-4mol/L鲁米诺溶液,将电极系统置入其中并施加电压,用微弱光测量仪检测光强.
1.3 研究内容
1.3.1 pH值及牛血清白蛋白浓度对鲁米诺电化学发光强度的影响
文献表明蛋白质在pH=7.4左右时活性最大,pH过大或过小都容易使蛋白质失活.而鲁米诺的电化学发光以在较强的碱性溶液中发光强度较大,因此测定牛血清白蛋白需要选择一个合适的化学环境,既要使蛋白质保持活性,又要使鲁米诺有足够的发光强度,在pH6.0-10.0的缓冲溶液中测试相同浓度BSA的增敏效益,选取最佳条件.在所选定的最佳pH条件下,测定加入不同浓度BSA时鲁米诺ECL强度与BSA浓度之间的关系,考察BSA对鲁米诺ECL的增敏性能.
1.3.2 循环伏安法研究BSA对鲁米诺氧化还原的影响
在电化学池中加入1mL含鲁米诺的磷酸缓冲溶液,用微量注射器加入BSA,将电极置入其中并施加电压,扫描循环伏安曲线,并讨论两者之间的相互作用.
2 结果与讨论
2.1 BSA测定条件的选择
由于溶液酸碱度一方面影响鲁米诺的ECL强度,同时又影响BSA的活性,因此是本研究中最主要考察的影响因素.较高的pH值条件下鲁米诺具有较强的ECL,产生很大的测量背景,同时也可能造成BSA的变性而失去其原有的功能;过低的pH值条件下,鲁米诺所产生的ECL信号很弱,同样对测定不利.研究中在pH6.0-10.0范围内,检测不同pH缓冲溶液中BSA对鲁米诺电化学发光的增敏作用,结果表明在pH=8.0时BSA对鲁米诺电化学发光信号增敏效果最佳,如图1所示.因此将此pH值的磷酸盐缓冲溶液作为研究中使用的支持电解质溶液.
2.2 BSA浓度与发光强度的关系
在pH=8.0的磷酸盐缓冲溶液中,不同浓度BSA对鲁米诺电化学发光的影响见图2.随着BSA浓度的增加,ECL信号增强,在BSA浓度达到1.2×10-8g/mL时,ECL达到信号最强.随后浓度增加信号减弱,这可能是由于BSA为生物大分子,浓度过高时可能会发生散射,导致ECL强度降低.
2.3 BSA对鲁米诺氧化还原行为的影响

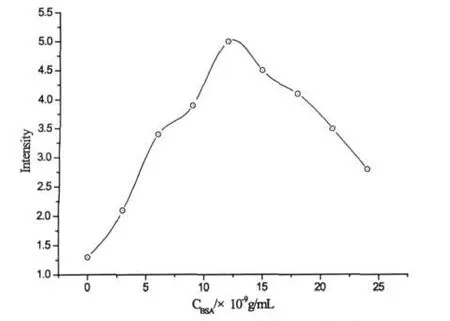
图2 不同浓度BSA对鲁米诺电化学发光的影响c(Luminol)=2.0×10-6mol/L
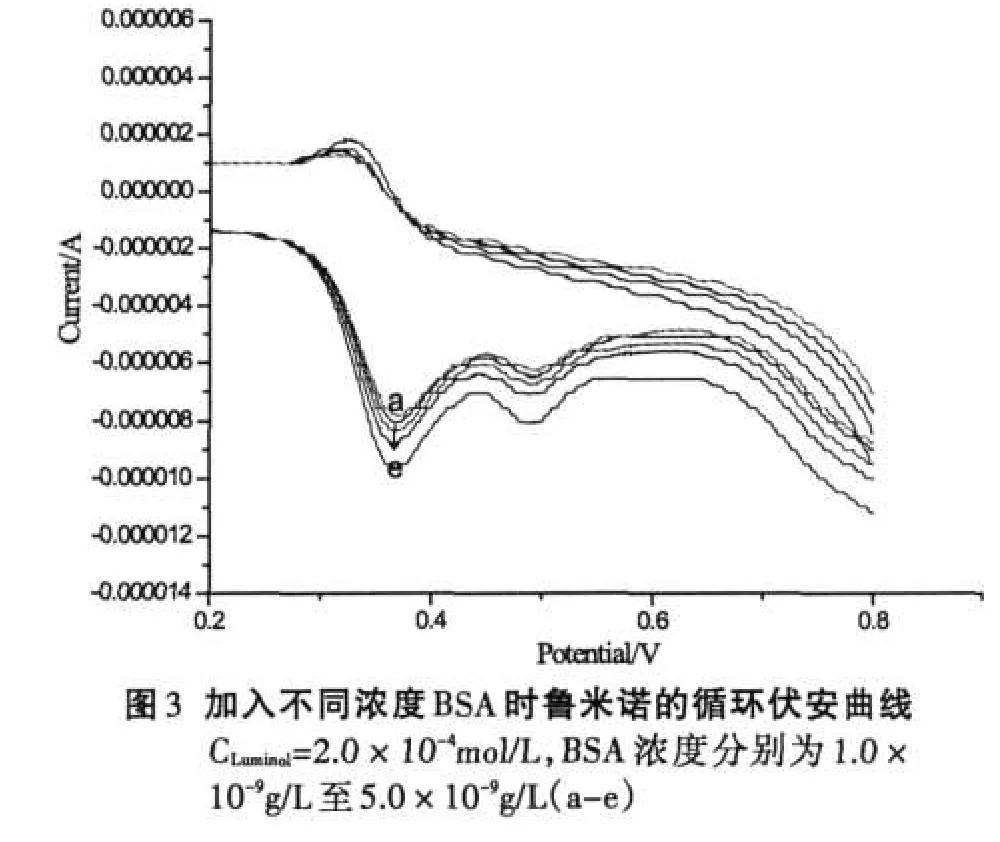
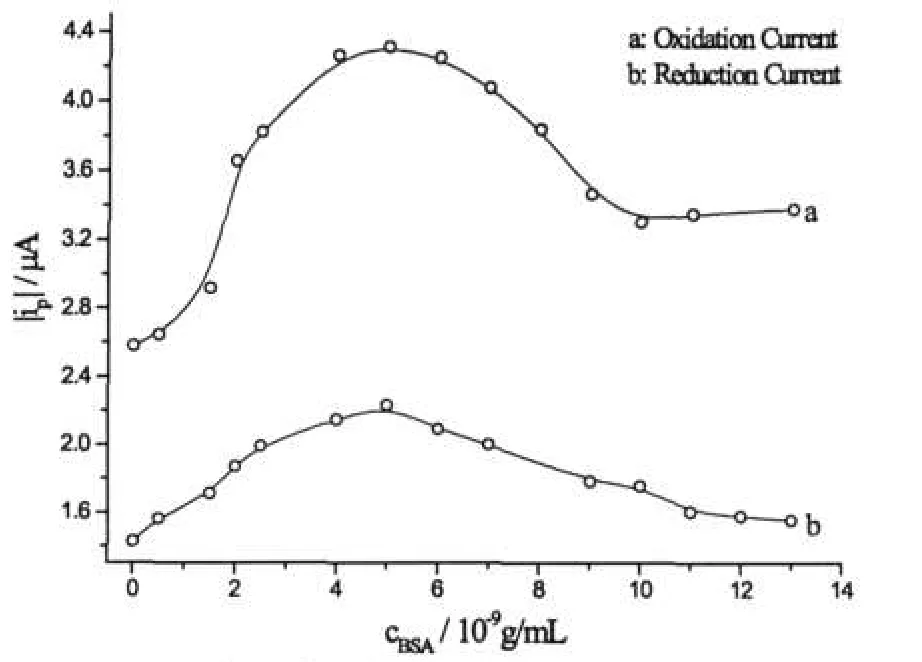
图4 BSA浓度对鲁米诺氧化还原峰电流的影响c(Luminol)=2×10-4mol/L
采用循环伏安法研究BSA存在时鲁米诺的氧化还原行为有助于理解BSA增敏鲁米诺ECL的原因,当在鲁米诺溶液中加入较低浓度BSA时,可以明显观察到鲁米诺的氧化还原电流增大,其循环伏安曲线见图3,但峰电位及形状未发生变化,表明其电化学行为未发生任何变化,只是氧化还原反应发生的程度有所提高.但随着BSA浓度的增加,鲁米诺的氧化还原峰电流又趋于减小,图4所示为鲁米诺氧化还原峰电流随BSA浓度的变化.
由图3、4可以看出,鲁米诺的氧化还原峰电流随着BSA浓度的增加而增加,但当加入BSA的浓度过大时,氧化还原峰电流又会逐渐减小.上述实验尽管在测定中由于灵敏度等因素而选择使用不同的鲁米诺浓度,因此BSA对鲁米诺的ECL或CV行为产生影响的浓度上略有差异,但表现出的规律是一致的,即低浓度BSA的加入无论对鲁米诺的电化学氧化还原还是电化学发光都具有明显的促进作用,而当BSA浓度较大时,这种促进作用逐步减弱.
在上述条件下,在BSA浓度为1.00×10-9~1.20×10-8g/mL的范围内,鲁米诺的电化学发光强度和BSA的浓度成线性关系,线性方程为I=0.87+0.37CBSA,r=0.9941,这为利用鲁米诺的ECL测定蛋白质提供了一种灵敏的新方法.
3 机理讨论及结论
由上述实验结果可知,在pH8.0的磷酸缓冲溶液中,BSA对鲁米诺的电化学氧化还原过程表现出了一定程度的促进作用,但这种促进作用并不改变鲁米诺的氧化还原机理,因此可以推测为当在鲁米诺溶液中加入一定浓度BSA时,鲁米诺分子被吸附于BSA表面,同时由于BSA在电极上有一定的吸附性,从而使电极表面对鲁米诺发生一定程度的富集,使鲁米诺的电化学氧化还原得以增强,同时,由于鲁米诺的ECL过程是基于鲁米诺的氧化激发,因此电极表面有更多鲁米诺发生氧化时,其激发态的数量也相应增加,从而导致ECL强度的增强.而当BSA浓度进一步增加时,BSA分子间可能发生聚合,则上述由于吸附引起的对鲁米诺的氧化还原的促进作用减弱,同时由于BSA聚合体体积增大、数量增加,溶液的散射程度也会增加,导致所检测到的ECL强度逐步减小.该研究为测定蛋白质提供了一个新方法,同时也扩大了电化学发光分析的应用范围.
[1]尹学博,杨秀荣,汪尔康.毛细管电泳-电化学/电化学发光及其微芯片技术[J].化学进展,2005,17(2):181-185.
[2]张成孝,漆红兰.电化学发光分析研究进展[J].世界科技研究与发展,2004,26(4):7-13.
[3]混旭,章竹君.纳米粒子修饰电极电化学发光传感器的研究进展[J].陕西师范大学学报,2009,37(5):56-66.
[4]黄炳强,郭文英,徐扬,等.溶解氧对鲁米诺电化学发光的增强效应研究[J].光谱学与光谱分析,2003,23(5):849-851.
[5]Sakura S.Electrochemiluminescence of hydrogen peroxide-luminol at a carbon electrode[J].Anal Chim Acta,1992,262:49-57.
[6]储海虹,郭文英,狄俊伟,等.半胱氨酸对鲁米诺电化学发光的增敏作用[J].分析科学学报,2005,21(6):676-678.
[7]Seitz W R,Hercules D M.Quantitative study of chemiluminescence from the iodine-luminol reaction[J].J Am Chem Soc,1974,26:4094-4098.
[8]Tu Y F,Qi Y Y,Wu Y,et al.Quenching electrochemiluminescential analysis of pico-molar level glutathione[J].Chem J Internet,2003,5(12):97.
[9]屠一锋,郭文英,黄炳强,等.影响鲁米诺体系电致化学发光因素的研究[J].光谱实验室,2001,18(2):185-188.
