盐酸氟西汀微乳的制备及其离体大鼠透皮作用研究
2010-08-06蔡霞吕竹芬陈燕忠广东药学院广东省药物新剂型重点实验室广州市510006
蔡霞,吕竹芬,陈燕忠(广东药学院/广东省药物新剂型重点实验室,广州市510006)
微乳是一种外观透明、液滴粒径小于100 nm、热力学稳定的体系[1,2]。微乳作为药物载体,还具有低黏度、吸收迅速、靶向释药的特点,并可提高药物的生物利用度,降低毒副作用[3],因此,近年来微乳在经皮给药方面逐渐成为研究的热点。
盐酸氟西汀(Fluoxetine hydrochloride,FLU),化学名为(±)-N-甲基-γ-[4-(三氟甲基)-苯氧基]-苯丙胺盐酸盐。分子量为345.8,熔点为155~158℃,易溶于乙醇和氯仿,微溶于水,乙醚中不溶。FLU是亲脂类药物,易透过血脑屏障进入中枢神经系统,是一种神经中枢5-羟色胺特异性重摄取抑制剂,目前在临床上是治疗重度抑郁症的首选药物。但是FLU由于需要长期给药,且有胃肠刺激副反应,因此,患者依从性较差,易致维持治疗失败[4]。为克服此缺点,依据透皮给药途径对药物的理化性质要求[5],可将其制成透皮给药制剂,并具有使用舒适方便、剂量调整简单的优点。基于此,本实验室制备了含FLU的O/W微乳,用改进的Franz扩散池对FLU微乳经离体大鼠皮的透皮速率进行了研究,评价了FLU微乳的透皮作用。
1 材料
Ultimate3000高效液相色谱仪(戴安公司);TK-12B透皮扩散试验仪(上海凯锴科技贸易有限公司);Zetasize Nano-ZS90多功能电位/粒度分析仪(英国马尔文仪器有限公司)。
FLU原料药(上海华理生物医药有限公司,批号:810001,含量:99.54%);FLU对照品(澳大利亚Alphapharm Pty Ltd Company,批号:B0590ME,含量:99.7%);FLU微乳(自制,规格:9.95 mg·mL-1)。
肉豆蔻酸异丙酯(IPM)、油酸乙酯(EO)、油酸(OA)均由国药集团化学试剂有限公司提供;聚乙二醇羟硬脂酸酯15(Solutol®SH15)、聚氧乙烯蓖麻油(Cremophor EL35)、聚氧乙烯氢化蓖麻油(Cremophor RH40)均由德国BASF Chemical Company提供;聚乙二醇400(PEG400,广东汕头市西陇化工厂);三辛酸/癸酸甘油酯(GTCC,英国禾大公司);四氢呋喃、甲醇均为色谱纯,其余试剂均为分析纯。
Wistar大鼠,广州中医药大学实验动物中心提供,♂,体质量(220±20)g。许可证号:SCXK(粤)2008-0020,粤监证字2008A003。
2 方法与结果
2.1 空白微乳处方组成的筛选
以Solutol®SH15、Cremophor RH40、Cremophor EL35、吐温-80为表面活性剂,甘油、丙二醇、PEG400为助表面活性剂,EO、OA、GTTC、IPM为油相,根据三者不同的质量配比,利用伪三元相图初步筛选出表面活性剂、助表面活性剂、油相和表面活性剂/助表面活性剂的质量比(Km值)。质量配比见表1。

表1 表面活性剂/助表面活性剂与油相质量配比Tab 1 The mass ratio of surfactant/cosurfactant to oil phase
分别将表面活性剂与助表面活性剂混匀后,室温下搅拌10 min,再依次与油相按不同质量比均匀混合,用蒸馏水滴定3种成分的混合物,观察是否形成澄清透明的微乳,并绘制伪三元相图。通过伪三元相图确筛选出空白微乳处方的组成为IPM/Solutol®SH15/PEG400/水,Km为1∶1。
2.2 FLU微乳的制备
在室温下将IPM、Solutol®SH15、PEG400按比例充分混合后,加入FLU原料药,充分搅拌,使之溶解,然后在搅拌的条件下缓慢滴入处方量的水,即得透明的FLU微乳样品。
2.3 微乳类型的鉴定
染色法:亚甲蓝染料为水溶性溶液,易在水溶液中扩散:苏丹红染料为油性染料,易在油相中扩散。如果亚甲蓝染料的扩散速度大于苏丹红染料的扩散速度,则为O/W型微乳;相反则为W/O型微乳。
取相同体积的空白微乳和FLU微乳,同时分别加入亚甲蓝染料和苏丹红,静止放置,结果,空白微乳和FLU微乳中水溶性亚甲蓝染料的扩散速度大于油溶性的苏丹红染料的扩散速度,故确证制备的空白微乳和FLU微乳为O/W型微乳。
2.4 微乳的粒径及分布
用粒度分析仪测得微乳的平均粒径为44.6 nm,呈正态分布,多分散系数为0.317,详见图1。
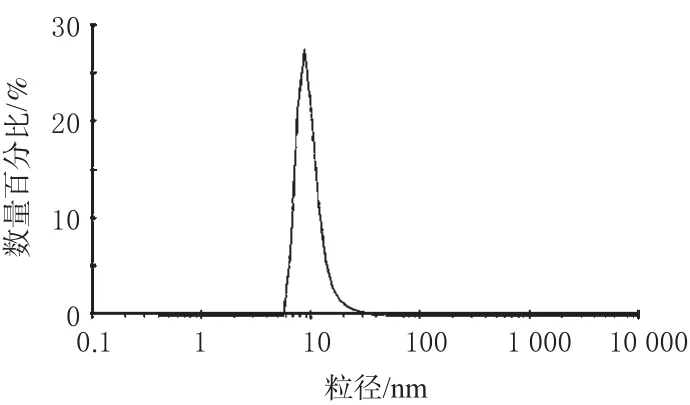
图1 微乳粒度正态分布图Fig 1 Normal distribution of particle diameter
2.5 微乳的离心试验
通过离心试验评价微乳的物理稳定性。取适量FLU微乳置于离心试管中,以10 000 r·min-1的速度离心15 min,观察微乳的外观和沉降情况。结果表明,微乳澄清透明,不分层,不沉降,符合微乳稳定性的要求。
2.6 含量测定方法的建立
2.6.1 色谱条件。色谱柱:Kromasil 100-5 C8(250 mm×4.60 mm,5 μm);流动相:1.0%三乙胺(用磷酸调pH值为6.0)-四氢呋喃-甲醇(40∶40∶20);流速:1.0 mL·min-1;检测波长:227 nm;进样体积:20 μL。在此色谱条件下,取“2.6.2”项下对照品溶液及“2.8”项下空白皮肤接收液、供试品接收液进样分析,结果,辅料及皮肤内源性物质不干扰FLU的测定,色谱详见图2。
2.6.2 线性关系。精密称取FLU对照品10 mg,置于100 mL容量瓶中,以甲醇溶解,得浓度为100µg·mL-1的对照品贮备液。精密量取对照品贮备液,用甲醇稀释成浓度为10、25、50、75、100 µg·mL-1的对照品溶液,精密吸取20 µL,注入液相色谱仪,以峰面积(A)对浓度(C)作线性回归,得标准曲线方程为A=0.704 9C-0.844 8(r=0.999 7),表明FLU检测浓度线性范围为10~100 µg·mL-1。
2.6.3 回收率试验。制备低、中、高3个浓度(相当于200、250、300µg·mL-1)的对照品溶液,精密移取上述溶液与空白微乳各1 mL,分别置于5 mL容量瓶中,加适量甲醇溶液超声20 min,定容,过滤,精密吸取20µL,注入液相色谱仪,记录结果分别计算。结果,低、中、高浓度的样品回收率分别为100.6%、106%、102.8%,RSD分别为1.89%、1.02%、1.73%。
2.6.4 精密度试验。取浓度为40、50、60 µg·mL-1的FLU对照品溶液,分别于与同日内重复进样6次,考察日内精密度;连续6 d重复进样6次,考察日间精密度。结果表明,低、中、高3个浓度的日内、日间RSD均小于2%,表明精密度符合方法学要求。
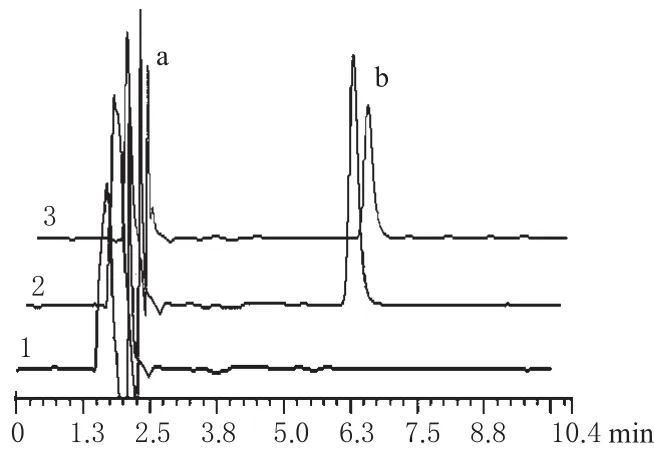
图2 高效液相色谱图1.空白皮肤接收液;2.对照品;3.供试品接收液;a.溶剂;b.FLUFig 2 HPLC chromatograms1.blank skin receiving solution;2.reference substance;3.test receiving solution;a.solvent;b.fluxetine hydrochloride
2.7 微乳初步稳定性考察
将FLU微乳密封后在室温条件下(相对湿度为75%)放置,于0、2、4个月取样观察,测定各项指标。结果,微乳在室温条件下放置外观澄清透明,无沉淀析出,离心后也未见分层,含量分别为100%、99.7%、99.5%,无明显降低。
2.8 透皮试验
2.8.1 离体鼠皮的制备。将大鼠处死,用脱毛剂脱毛,剥离腹部皮肤,在玻璃板上小心刮去皮下脂肪和粘连物,用蒸馏水和生理盐水冲洗干净,冷冻保存,待用。
2.8.2 透皮方法。将大鼠腹部皮肤固定在Franz扩散池的2个半池之间,角质层面向供给池,有效渗透面积2.92 cm2,接受液体积为7 mL,温度为37℃,转速为250 r·min-1。接收液为0.02%叠氮化钠生理盐水。取1 mL FLU(9.95 mg·mL-1)微乳适量均匀涂布于皮肤表面,分别于1、2、4、6、8、10、12 h取样1 mL(同时补充等量同温接收液),样品适量稀释,用0.45µm微孔滤膜过滤,取续滤液进样测定,计算单位面积累积透皮量(Q)和稳态透皮速率(J)。
用公式Qn=CnV/A计算药物累积透皮量,其中Qn为t时间单位面积累积透皮量,Cn为t时间药物的浓度,V为接受液总体积,A为有效扩散面积,以Qn对t采用Higuchi方程拟合,所得直线斜率即为平均透皮速率Jss(µg·cm-2·h-1)。
2.8.3 油相含量对FLU透皮吸收的影响。以IPM占体系质量分数分别为4%、7%、11%、20%、25%制备FLU微乳液,进行体外透皮试验,考察不同油相含量对FLU透皮吸收的影响,绘制Q-t曲线,结果详见图3。
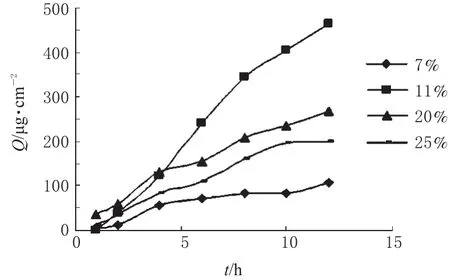
图3 油相含量对FLU透皮吸收的影响Fig 3 Effect of the content of oil phase on the percutanous penetration of FLU
从图3可见,在药物浓度相同情况下,当体系中IPM含量为4%时,12 h内无药物透过(故在图3中无此曲线);当IPM含量由7%增大到11%时,J值和Q值骤然增加;当IPM含量为11%时J和Q值均达到最大值,随后二者均随含量增大而降低。可见IPM虽然是一种有效的透皮吸收促进剂,其促进效果并不随含量增大而线性增加,存在最佳浓度值,当其浓度超过该值时,透皮吸收促进效果反而下降。
2.8.4 混合表面活性剂含量对FLU透皮吸收的影响。当油相的量固定为11%,混合表面活性剂的总量(Smix,即表面活性剂Solutol®SH15和助表面活性剂PEG400质量之和)分别为35%、43%、48%、52%、55%时,考察不同Smix对FLU透皮吸收的影响,绘制Q-t曲线,结果详见图4。

图4 混合表面活性剂含量对FLU透皮吸收的影响Fig 4 Effect of the content of mixed surfactants on the percutanous penetration of FLU
由图4可见,随着Smix的增加,药物的J值先增大后减小;当Smix为43%时,J和Q值均达到最大值。这可能是因为连续相中药物的浓度决定药物透皮吸收,表面活性剂的浓度过高会使连续相中分子存在的药物浓度降低,导致药物的扩散速度下降,从而使药物在皮肤的滞留量下降[6]。
2.8.5 载药量对FLU透皮吸收的影响。制备含FLU分别为0.5%、0.7%、1%、2%、4%(W/W)的微乳液,按“2.8.2”项下方法进行离体大鼠皮肤体外透皮试验。考察不同载药量对FLU透皮吸收的影响,绘制Q-t曲线,结果详见图5。
图5所示,微乳的载药量由0.5%增加到1%时,J值明显增加(P<0.05);而当载药量增加至2%时,J值则下降。这表明皮肤的吸收过程存在“饱和”现象,随着体系载药量的增加,药物与载体的亲和力可能亦相应增加,从而使药物的热力学活性降低,J值下降。
对以上结果综合分析,得到微乳经皮渗透的处方为FLU/IPM/Solutol®SH15/PEG400/水(1∶9∶20∶20∶39)。
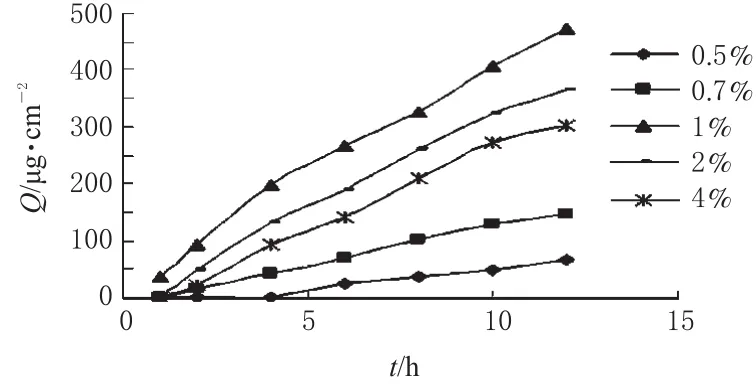
图5 载药量对FLU透皮吸收的影响Fig 5 Effect of drug-loading amount on the percutanous penetration of FLU
2.8.6 处方验证试验。根据以上结果,即以油相含量为11%、混合表面活性剂含量为43%、载药量为1%,制备3批FLU微乳。以Q对t采用Higuchi方程拟合,得3批样品的平均J值为(128.96±0.32)µg·cm-2·h-1,详见表2。
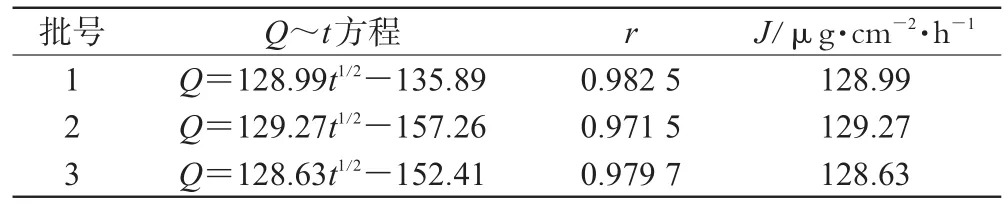
表2 3批FLU微乳的透皮试验结果Tab 2 Permeation parameters of 3 batches of FLU microemulsion
3 讨论
油相、表面活性剂及助表面活性剂是形成微乳所必需的组分,但由于种类繁多,本文利用伪三元相图进行处方筛选,得到空白微乳的处方组成为IPM/Solutol®SH15/PEG400/水。
微乳透皮性能高低与油相的种类、含量直接相关,研究表明IPM既可作为微乳的油相,又可以增加角质间的脂质流动性,使药物更易透过角质层,具有强大的促透效果[7];表面活性剂可能是通过改变角质层、胆甾醇和类脂的结构甚至移除从而起到促进透皮吸收的作用;助表面活性剂可插入到表面活性剂的界面膜中,形成复合凝聚膜,提高膜的牢固性和柔顺性,又可大大增加表面活性剂的溶解度,同时形成更小的乳滴,并增加纳米乳的透皮性;微乳中药物的溶解量也会影响载药系统的透皮吸收能力。
[1]Aviram S,Abraham A.Microemulsions as carries for drugs and nutraceuticals[J].Advance in Colloid and Interface Science,2006,21(5):47.
[2]王晓黎,蒋雪涛.微乳在药剂学上的应用[J].解放军药学学报,2004,16(2):88.
[3]张立超,胡晋红.微乳透皮给药系统的研究进展[J].国外医学-药学分册,2004,31(1):44.
[4]胡岱丽,王洪建,张翠莲.氟西汀的临床应用进展[J].社区医学杂志,2008,6(1):54.
[5]狄平平,徐 远,张 圩.盐酸氟西汀化学结构确证及其理化性质的研究[J].中国医药工业杂志,1996,27(7):317.
[6]Changz M,Varshney M.Aerosol OT microemulsions as transdermal carries of tetracaine hydrochloride[J].Drug Dev Ind Pharm,2000,26(5):507.
[7]赵永哲,刘继勇,胡晋红,等.苦参碱微乳的制备及透皮研究[J].药学服务与研究,2008,8(4):252.
