正交设计优化尿素软膏质量控制工艺
2010-07-30陈渝军管红珍李琳琳
陈渝军,杨 杰,梅 艳,管红珍,李琳琳
(武汉市妇女儿童医疗保健中心,湖北武汉 430016)
尿素软膏作为皮肤外用药,主要适用于皮肤角化症、手足皲裂、干皮症、鱼鳞病等。其主要成分为尿素,可溶解角蛋白,增加蛋白质的水合作用,从而使角质软化和溶解。我院制剂室配制的尿素软膏是临床皮肤科常用的药物。本文采用正交试验设计法,根据中国医院制剂规范[1]收载的紫外分光光度法测定尿素的含量方法,考察提取次数、水浴温度、加10%氯化钠溶液量及提取时间的影响,确定尿素软膏中尿素质量控制的最佳提取工艺。
1 仪器与试药
UV-160A紫外分光光度计(日本岛津);AB204十万分之一电子分析天平(瑞士梅特勒托利多)。尿素对照品(中国生物制品检定所,批号:100288-200201);尿素(湖南省芙蓉联合制药厂,批号:20080712),甘油、羊毛脂、凡士林等辅料均为药用级,其余均为分析纯。
2 方法与结果
2.1 正交试验设计
影响提取工艺的因素主要有:提取次数、水浴温度、加10%氯化钠溶液量及提取时间等因素,各取三个水平,按L9(34)设计正交试验。 见表 1。

表1 正交试验因素水平Tab.1 The different factors of orthogonal test
2.2 含量测定
2.2.1 专属性试验 按处方相当于尿素25 mg的量的尿素、甘油、羊毛脂、凡士林分别用10%氯化钠溶液溶解定容于100 ml量瓶中,分别于350~600 nm处扫描,见图1,在此范围均无吸收;分别按照“2.2.3”项下规定自“精密量取”到“15 min”操作并同样扫描,见图2,可见仅尿素在此范围内有吸收,且其最大吸收波长为430 nm。故本文选择430 nm为尿素含量的测定波长。

2.2.2 标准曲线的绘制 精密称取尿素对照品适量,用10%氯化钠溶液溶解成0.25 g/L的溶液,备用。按照“2.2.3”项下规定自“精密量取”到“15 min”操作并在430 nm的波长处测定吸光度,以其吸收度对浓度进行线性回归,得回归方程C=220.7413A-0.4864(r=0.9999,n=7)。 结果,尿素检测浓度在50~350 μg/ml范围内呈良好线性关系。

2.2.3 含量测定 精密称取样品0.25 g,按表2所列条件进行提取,合并提取液,定容至100 ml作供试品溶液。精密量取供试品溶液与对照品溶液各4 ml,分别置具塞试管中,各精密加入对二甲氨基苯甲醛溶液4 ml,摇匀,暗处放置15 min,立即照紫外分光光度法,在430 nm波长处测定吸光度,按(A供×C对)/(A对×C供)×100%计算尿素百分含量, 即得。方差分析见表3。

表2 正交试验结果Tab.2 The results of orthogonal test

表3 方差分析结果Tab.3 The results of variance test
从表2结果可以看出,对于提取工艺影响大小顺序为B>A>D>C;由表 3可知,A、B 因素水平变化对实验结果有显著影响,C、D因素对实验影响不大。结合直观分析,拟定最佳提取工艺为A1B1C3D1,即精密称取样品0.25 g,采用提取次数4次、水浴温度60℃、每次加15 ml 10%氯化钠溶液提取15 min,合并提取液,定容至100 ml量瓶中,作供试品溶液。
2.3 提取工艺的验证试验
取样品(批号:091208)5份,按最佳工艺提取测定尿素含量,实验结果较为理想,样品编号1的尿素含量为92.45%;样品编号2的尿素含量为97.47%;编号3的尿素含量为94.59%;编号4的尿素含量为98.03%;编号5的尿素含量为95.62%,所有数据的(±s)为(95.63±2.25)。
2.4 与《中国药典》2005年版[2]方法比较
取样品(批号:091208)适量(约相当于尿素 50 mg),共5份,加乙醇20 ml,水浴加热,溶解后置冰浴中冷却30 min,过滤至100 ml量瓶中,用乙醇洗涤容器及滤器并入量瓶中,稀释至刻度,摇匀,滤过,续滤液作为供试品溶液。另精取尿素对照品适量,用乙醇稀释成每毫升约含0.5 mg尿素,为对照品溶液。精密量取供试品与对照品溶液各3 ml,分别置25 ml量瓶中,各精密加对二甲氨基苯甲醛溶液10 ml,用乙醇稀释至刻度,摇匀,暗处放置15 min,必要时滤过,立即照紫外分光光度法,在430 nm波长处测定吸光度,计算,即得。结果与优选最佳工艺比较,两种方法有显著性差异,见表4。
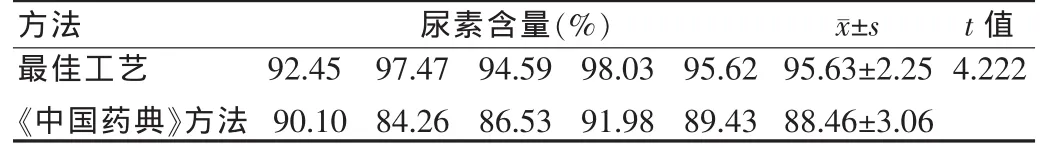
表4 两种提取方法结果比较Tab.4 Compare with two kinds of extract method
3 讨论
在中国医院制剂规范收载了测定尿素乳膏含量的方法,没有明确规定水浴温度,然而在实际的操作过程中发现其重现性并不理想,故在此对其提取的方法进行了探讨。
近几年的文献不管用何种方法提取均采用与对照品或原料对比计算尿素含量,本文在反复实验中探索也认为反应受外界条件影响较大,采用对比法计算尿素含量较为准确,故在含量测定时也采用对比法计算。
《中国药典》2005年版中尿素乳膏采用乙醇为溶剂一次提取,方法较为简单,但所用试剂成本较高,且与本文所选最佳工艺比较,结果有显著性差异,以最佳工艺方法提取率高,更为接近真实值,故采用本文提取工艺更佳。
[1]中华人民共和国卫生部药政局.中国医院制剂规范[S].二版.北京:中国医药科技出版社,1995:140.
[2]朱莉,吴奥玲.氢化可的松尿素乳膏的制备及质量控制[J].中国医院药学杂志,2007,27(2):254-255.
[3]盛国荣,于葆华.复方环磷腺苷乳膏的制备及质量控制[J].中国药房,2007,18(7):531-533.
[4]吴英娇,李成.复方尿素硅油乳膏的制备及质量控制[J].中国现代药物应用,2009,3(10):8-9.
[5]国家药典委员会.中国药典[S].二部.化学工业出版社,2005:279.
[6]李世根,谢少玲,苏锡潭.丹皮酚凝胶的制备及质量控制[J].中国药房,2006,14(10):145-146.
[7]周慧,李正国,王红.HPLC测定双丹颗粒中丹皮酚的含量[J];中成药,2005,17(05),156-157.
[8]温利明,倪海华.金胆片全水型薄膜包衣的生产工艺研究[J].中国药业,2005,18(10):156-157.
