组织工程化骨修复下颌骨缺损(附3例报告)
2010-07-25周晓曹谊林崔磊喻建军李赞陈杰左朝晖刘广鹏莫逸胡炳强吴胜其
周晓 曹谊林 崔磊 喻建军 李赞 陈杰 左朝晖 刘广鹏 莫逸 胡炳强 吴胜其
下颌骨位于面下中1/3,颌面部肿瘤切除手术常导致下颌骨缺损,传统的修补方法主要是骨移植,但由于骨源的限制和自体供区的损伤,仍不是理想的修复方法。组织工程是利用种子细胞和与可降解支架材料复合的方法,在体内形成具有生理功能的组织,该方法有望成为骨缺损修复的理想方法[1]。在多种大型哺乳动物体内的实验证实,骨髓基质干细胞(Bone marrow stromal cells,BMSCs)在体外能被诱导为具有成骨特征的细胞,利用其作为种子细胞所形成的组织工程化骨能成功地修复骨缺损[2]。上海市组织工程研究重点实验室应用自体BMSCs形成的组织工程化骨成功修复了犬下颌骨缺损[3],在此基础上,我们应用患者自身的骨髓基质干细胞(hBMSCs)为种子细胞,修复了人颌面部肿瘤切除术后的下颌骨缺损,并通过PET-CT检测了组织工程化骨在人体内的形成过程,取得了满意的治疗效果。
1 资料与方法
1.1 一般资料
本组3例,均为男性,年龄25~44岁,术前三维CT检查示下颌骨囊肿,均采用组织工程技术修复骨缺损。
1.2 方法
1.2.1 组织工程骨的体外培养
1.2.1.1 自体hBMSC的体外诱导和培养
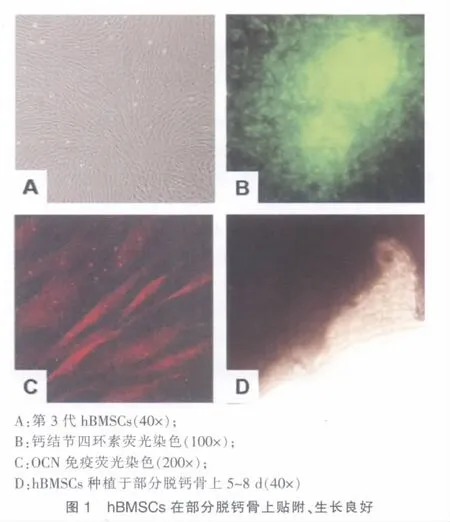
从患者髂前上棘经穿刺取得骨髓5~8 mL,将获取的骨髓置于Percoll分离液(密度1.073 g/L),骨髓与分离液的比例为1∶2,2 550 r/min离心30 min,吸取中间云雾状细胞层,PBS洗1次,1 550 r/min离心后弃上清,获取有核细胞,以2×107cells/cm2接种于培养皿,进行体外细胞扩增,以成骨条件培养液进行成骨诱导。使用的培养液为DMEM,加入β-磷酸甘油钠(10 nmol/L)、地塞米松(10-8mol/L)、L-α-磷酸抗坏血酸(50 μmol/L)、L-谷氨酰胺(300 mg/L)、1,25(OH)2VD3(10 nmol/L)和10%自体血清。原代细胞接种后48 h换液,细胞达80%~90%融合后,采用0.25%胰酶消化,2×103cells/cm2传代培养,置于37℃、5%CO2培养箱培养至第3代,血球板细胞计数。
1.2.1.2 成骨诱导后的hBMSC的成骨表型鉴定
倒置相差显微镜观察细胞形态,第3代细胞行钙结节四环素荧光染色,并采用免疫荧光法检测骨钙蛋白(Osteocalcin,OCN)。
1.2.1.3 hBMSC复合人部分脱钙骨体外培养
人部分脱钙骨由国家组织工程工程中心提供,脱钙比例为30%~40%,孔隙率为62%~70%,平均孔径280 μm,主要成分为Ⅰ型胶原。成骨诱导后的hBMSCs以3.5×107cells/g的浓度接种于人部分脱钙骨上,体外培养1个月,倒置显微镜观察细胞生长情况。
1.2.2 手术方法
患者全麻,常规消毒术野,切除下颌骨囊肿,彻底止血,显露骨缺损,植入细胞-材料复合物,使其边缘和周围正常骨密切接触。用可吸收缝线将细胞-材料复合物与周围骨组织固定后,严密缝合软组织并关闭创面。术前、术中和术后使用抗生素抗感染。采用的治疗方法经过湖南省肿瘤医院医学伦理委员会通过,并征得患者及家属同意。
1.3 随访
所有患者分别于手术后2周、3个月、6个月进行临床检查和PET-CT检查。
2 结果
2.1 细胞-材料复合物
第3代hBMSCs形态均匀,增殖旺盛(图1A),经成骨诱导2周后钙结节四环素荧光染色和OCN免疫荧光检测均为阳性(图1B,C)。接种部分脱钙骨体外构建组织工程化骨后,倒置显微镜下观察,部分脱钙骨有良好的生物相容性,细胞接种3~4 h可见hBMSCs在脱钙骨表面贴附生长,细胞在脱钙骨孔隙中粘附良好;5~8 d可见细胞和其分泌基质充满脱钙骨的孔隙(图1D)。
2.2 组织工程化骨治疗下颌骨缺损
全部患者术后PET-CT检查示,植入的细胞材料复合物形成高密度影,提示组织工程骨形成并修复骨缺损区。表明术后外形明显改善,且能维持长期稳定的疗效。
3 典型病例
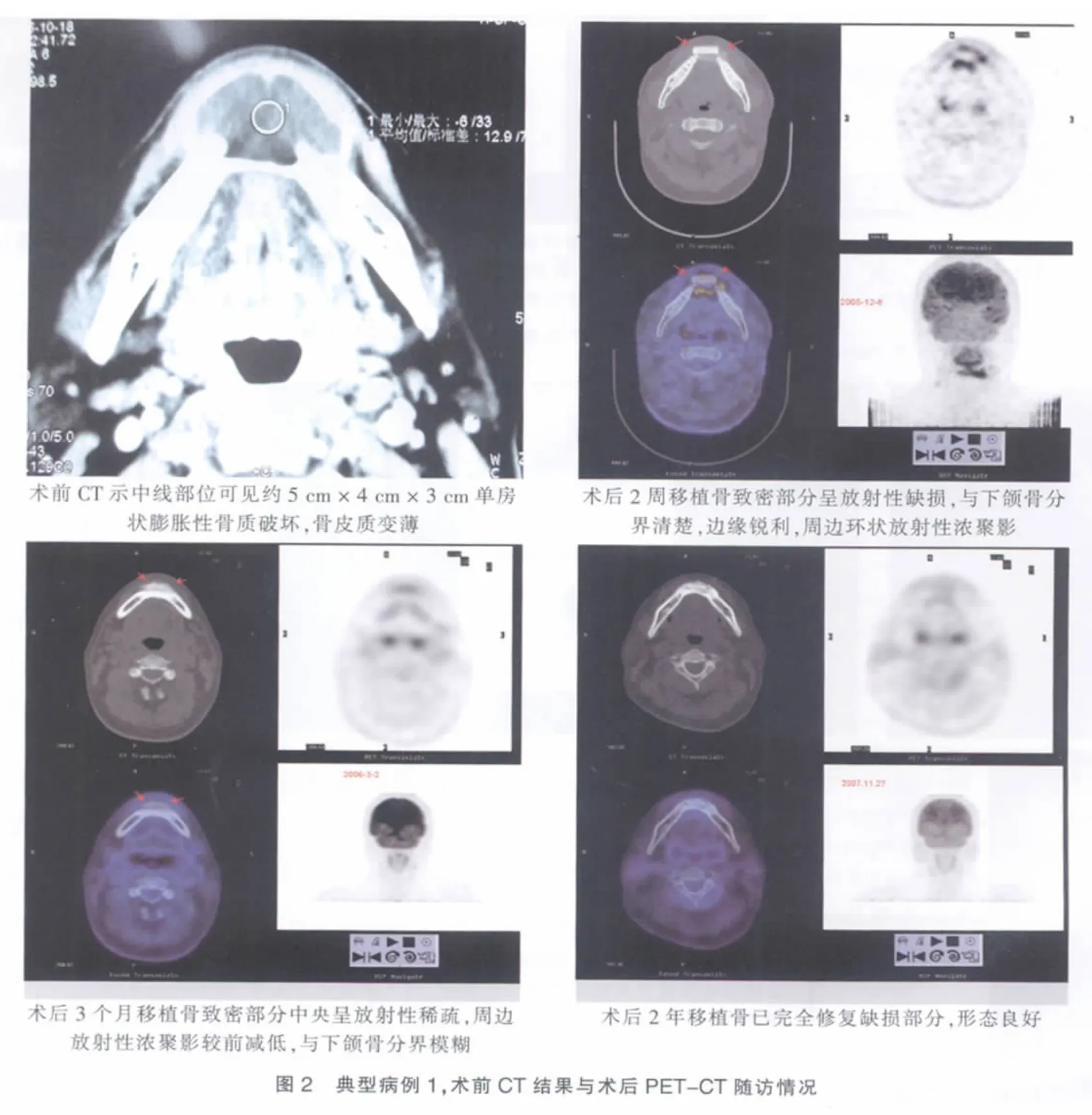
患者,男,43岁。2005年10月14日入院,CT检查示中线部位见约5 cm×4 cm×3 cm单房状膨胀性骨质破坏,骨皮质变薄,牙槽侧骨质稍稀疏,左右第1、2根尖骨质吸收,左右第3牙根尖受压移位。诊断:下颌骨囊肿。2005年11月24日,在全麻下行下颌骨颏部囊肿切除术加体外构建的组织工程化骨修复术,术中将囊肿壁和少量骨壁完整切除,测量下颌骨实际缺损明显小于囊肿大小,根据骨缺损范围,将4周前在上海市组织工程研究重点实验室就开始准备的6块自体骨髓干细胞体外构建的组织工程化骨(大小4.5 cm×2.0 cm×2.5cm)植于缺损处。留置负压引流,逐层缝合伤口。患者术后康复顺利,伤口愈合良好,术后病检:下颌骨符合牙源性角化囊肿。随访2年,下颌骨缺损已修复,形态良好(图2)。
患者,男,24岁。2005年12月20日入院,CT检查示下颌骨改变,右下颌骨可见多个囊性骨质破坏、缺失。该患者3年前曾因右下颌骨囊肿在外院手术治疗,故诊断为右下颌骨囊肿术后复发。2005年12月22日,全麻下行下颌囊肿切除加组织工程化骨植入术。术中见下颌骨体部有2 cm×2 cm和2 cm×1.5 cm大小囊肿两个,囊肿与牙龈黏膜粘连,将两个囊肿和粘连的牙龈黏膜切除,骨床用磨钻磨除部分骨质后下颌骨缺损3.5 cm×2 cm×1 cm。冲洗伤口,将4周前在上海市组织工程研究重点实验室就开始准备的以自体骨髓干细胞体外构建的组织工程化骨约3 cm×2 cm×1 cm大小植于缺损处。留置负压引流,逐层缝合伤口。术后病检:右下颌骨造釉细胞瘤。术后1月发现下颌骨黏膜缺损,组织工程化骨有0.5 cm×0.5 cm外露。术后2个月伤口发生感染,经抗生素治疗,保留脱钙骨。组织工程骨部分成活,伤口逐渐愈合,治愈出院。随访2年,组织工程化骨已修复下颌缺损,形态良好(图3)。
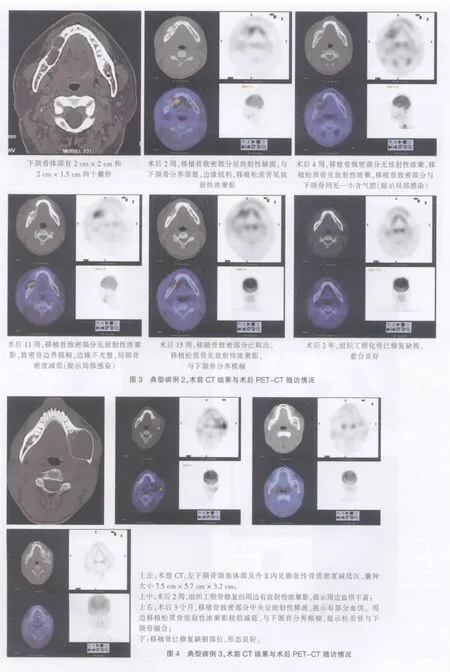
患者,男,17岁。2007年12月19日入院。CT检查示左下颌骨颌角体部及升支内见膨胀性骨质密度减低区,囊肿大小为7.5 cm×5.7 cm×3.2 cm,左下第6、7牙根伸入囊内。诊断为左下颌骨囊肿。2007年12月24日,全麻下行左下颌骨囊肿刮除术加体外构建的组织工程化骨修复术。术中,切开部分变薄的骨皮质,将囊肿壁完整切除,冲洗伤口。根据骨缺损范围,将事先准备的6块以自体骨髓干细胞体外构建的组织工程化骨植于缺损处。留置负压引流,逐层缝合伤口。术后13 d拔除引流管,次日发现左面部肿胀,行探查术,术中见组织工程化骨颜色红润,无特殊异常发现,再放置引流管。12 d后再次拔除引流管。伤口愈合良好。术后病检:左下颌骨牙源性囊肿。随访2年,组织工程化骨成活良好,下颌骨缺损区修复(图4)。
3 讨论
1993年,Vacanti等[4]将牛成骨细胞接种于聚羟基乙酸后,植入裸鼠皮下,形成组织工程化骨,证实了以组织工程技术构建骨组织的可能性。袁捷等[3]研究证实了经诱导的自体BMSC复合珊瑚、羟基磷灰石构建组织工程化骨能修复犬下颌骨缺损。Schliephake等[7]以煅烧牛骨为支架,复合BMSCs,修复羊的下颌骨节段缺损,组织学结果显示,新骨形成量较单纯材料组有显著增加。Krzy-manski等[8]将经培养的BMSC与纤维蛋白复合修复兔下颌骨部分缺损,结果显示经培养的BMSCs移植较异体冻干骨移植时修复能力显著增强,与自体骨移植无显著性差异,表明BMSCs与成骨细胞具有同样的成骨效率;与骨髓混合,可能骨髓不仅提供前体细胞,还提供生长因子,后者的出现会提高BMSC在体内的增殖。这些研究成果为开展临床应用研究提供了依据。但是,以组织工程化骨修复骨缺损,在临床应用前必须解决两个关键的问题①组织工程化骨能否在人体内形成;②形成的组织工程化骨在人体内的转归和远期效果能否达到临床修复骨缺损的目的。
组织工程化骨体内构建的关键是种子细胞和支架材料。hBMSCs具有能诱导分化为成骨细胞的特性及良好的体外增殖能力,能满足体内形成组织工程化骨对种子细胞“质和量”的要求[5]。同时采用自体细胞可避免疾病传播和免疫排斥的风险。现有多种生物材料可作为骨组织工程的支架材料[6],如部分脱钙骨、珊瑚、磷酸三钙等。脱钙骨单纯临床应用存在体内吸收过早,在降低免疫源性的同时,易保持骨诱导性等优点,本组患者均采用人部分脱钙骨作为支架材料。术后2周的PET-CT示:移植骨致密部分呈放射性缺损,与下颌骨分界清楚,边缘锐利,移植松质骨见放射性浓聚影,提示移植松质骨血供丰富。术后3个月的PET-CT检查提示:组织工程化骨与下颌骨分界模糊,提示组织工程化骨与下颌骨已融为一体,生长良好。尤其是本组的第二位患者,在伤口感染的情况下,组织工程化骨仍能存活,并最终修复了骨缺损区。本组患者术后2年随访提示,组织工程化骨已完全修复缺损区,形态良好,效果稳定。
组织工程化骨在骨缺损修复中的应用具有明显优势:从少量骨髓中分离hBMSCs,经体外大规模扩增后可修复大范围的缺损,改变目前骨缺损治疗中供区骨来源不足的问题,避免对自体骨供区的损伤。形成的组织工程化骨稳定存在,并发挥其生理功能。和传统自体骨移植相比,组织工程技术修复缺损可不受缺损面积、形状等的限制,不造成供区的组织缺损和功能障碍,因此可达到无创修复大范围骨缺损的目的,易于被患者接受。德国Warnke等[9]在动物实验基础上,应用组织工程化骨修复人下颌骨缺损取得了满意的临床疗效。充分证明了hBMSCs在人体内可形成组织工程化骨,并能修复骨缺损,展示了组织工程骨组织构建在临床具有广阔的应用前景。
但是,本临床研究并未从组织学上来检测组织工程化骨的成骨过程,而是应用PET-CT动态观察下颌部组织工程骨的成骨过程。因此,对于组织工程化骨在体内建立血液循环的原理,其在局部愈合和塑形过程中的变化等尚待进一步的研究。
[1]Crane GM,Lshang SL,Mikos AG,et al.Bone tissue engineening[J].Nature Medicine,1995,1:322-324.
[2]Petite H,Viateau V,Bensaid W,et al.Tissue-enginneered bone regeneration[J].Nat Biotechnol,2000,18(6):959-963.
[3]袁捷,祝联,王敏,等.自体骨髓基质干细胞珊瑚羟基磷灰石修复下颌骨节段缺抽的实验研究[J].中华口腔医学杂志,2006,41(2):94-97.
[4]Vacanti CA,Kim WS,Mooney D,et al.Tissue engineered composites of bone and cartilage using synthetic poly mers seeded with two cell types[J].Orthop Trans,1993,18(5):276-277.
[5]Prockop DJ.Marrow stromal cells as stem cells for nonhe matopoietic tissues[J].Sci,1997,276(2):71-74.
[6]Bauer TW,Muschler GF.Bone graft materials.An overview of the basic science[J].Clin Orthop,2000,371(1):10-27.
[7]Schliephake H,Knebel JW,Aufderheide M,et al.Use of cultivated osteoprogenitor cells to increase bone formation in segmental mandibular defects:an experimental pilot study in sheep[J].Int J Oral Maxillofac Surg,2001,30(6):513-537.
[8]Krzymanski G,Kalczak M,Wiktor-Jedrzejczak W.The use of bone-marrow derived fibroblastoid cells and fresh bone marrow in the treatment of bone defects:an experimental study[J].Int J Oral Maxillofac Surg,1997,26(1):55-60.
[9]Warnke PH,Wiltfang J,Springer I,et al.Man as living bioreactor:fate of an exogenously prepared customized customized tissueengineered mandible[J].Biomater,2006,27(17)3163-3165.
