线形程序性坏死在不同肿瘤局部微环境中分布的初步观察*
2010-07-21刘艳荣张丹芳张诗武赵秀兰韩春荣孙保存
刘艳荣 古 强 张丹芳 孙 涛 张诗武 赵秀兰 韩春荣 孙保存
经典理论认为,细胞凋亡是程序化的主动死亡过程[1],而细胞坏死则是突发性的、被动的死亡形式[2]。目前研究表明,在某些情况下坏死也可能是群体细胞在基因调控下发生的主动性死亡过程[3]。在小鼠黑色素移植瘤HE染色切片中可观察到肿瘤组织内出现线形分布或网状分布的一群胞核深染、胞浆浓缩且细胞间彼此分离的瘤细胞,这些条带结构按一定的空间距离分布且彼此连接,免疫组化和电镜观察结果提示这些瘤细胞可能为肿瘤细胞的一种特殊的程序性死亡形式,笔者将其命名为“线形程序性坏死”(linearly patterned programmed cell necrosis,LPPCN)[4]。本研究通过建立荷瘤小鼠缺血模型和生物力学模型,初步探讨肿瘤局部微环境对肿瘤细胞发生LPPCN的影响。
1 材料与方法
1.1 实验动物和细胞系 实验动物采用6~8周龄,20~22 g,C57BL小鼠,雄性,SPF级,购自中国医学科学院实验动物研究所;鼠源性黑色素瘤细胞B16(C57BL/6小鼠来源黑色素瘤)单细胞悬液由天津医科大学病理教研室提供。
1.2 方法
1.2.1 制作小鼠缺血后肢移植瘤模型 腹腔注射氯氨酮40 μL麻醉小鼠。乙醇消毒小鼠局部皮肤,在其左侧鼠蹊部横行切开小鼠皮肤分离肌肉,见股动脉及其分支。游离左侧股动脉主干,6.0号丝线分别结扎股动脉远端和近端,从中间剪断股动脉,4.0号丝线毯边缝合伤口,碘伏清洁伤口。股动脉结扎术后5 h,取冻存B16单细胞悬液,复苏后将0.2 mL瘤细胞悬液(注射细胞数为0.2×107)接种至小鼠左右后肢。接种时由小鼠大腿向脚踝方向进针,以防瘤细胞接种至鼠蹊部。分组:C57BL小鼠9只,左后肢移植瘤为缺血组,右后肢移植瘤为对照组,每天观察小鼠双后肢皮肤颜色、温度、活动度和手术伤口,每天测量肿瘤长径和短径。接种移植瘤后15 d处死小鼠,观察肿瘤组织局部侵袭情况和生长方式,取瘤组织及近鼠蹊部侧骨骼肌组织常规石蜡包埋并制作4 μm组织切片[5]。
1.2.2 制作小鼠生物力学模型 扩增并传代B16细胞,胰酶消化,0.9%NaCl重悬,调整细胞浓度至1×107个/mL。75%乙醇消毒并提起小鼠腹部皮肤,注射器吸取细胞悬液0.2 mL进行接种,保证瘤细胞进入腹腔。腹腔接种完成后75%乙醇消毒小鼠左后肢皮肤,将0.2 mL瘤细胞悬液接种于小鼠左后肢肌肉,注意由小鼠大腿向脚踝方向进针,防止瘤细胞悬液回流至鼠蹊部。分组:C57BL小鼠10只,腹腔组即腹腔移植瘤,后肢组即左后肢移植瘤。接种移植瘤后9 d处死小鼠,观察肿瘤组织局部侵袭情况和生长方式,取瘤组织常规石蜡包埋并制作4 μm组织切片。
1.2.3 HE染色和免疫组织化学染色 HE染色按常规步骤进行。用于免疫组化的基质金属蛋白酶(MMP)-2、MMP-9兔抗小鼠多克隆抗体购自labvision公司。免疫组化实验步骤:4 μm连续切片常规脱蜡水化;3%过氧化氢灭活内源性过氧化物酶;0.01 mol/L枸橼酸盐缓冲液(pH 6.0)微波热修复15 min;室温下滴加正常血清封闭20 min,滴加一抗4℃过夜;次日晨恢复至室温,PBS冲洗,滴加PV6001(兔即用型非生物素两步法检测试剂盒,北京中杉金桥生物有限公司);DAB显色,苏木素浅染细胞核;脱水透明,中性树胶封片。采用已知阳性片作阳性对照,PBS代替一抗作为阴性对照。
1.2.4 计数方法 (1)LPPCN细胞百分率:先用100倍光镜进行观察,寻找LPPCN最多的区域,然后在400倍光镜下随机抽取HE切片的5个LPPCN视野,每个视野之间至少间隔1个视野大小的距离,然后计数每个高倍视野下每100个肿瘤细胞中的LPPCN细胞数目,取其均值计算LPPCN细胞百分率。(2)免疫组化计数方法:400倍光镜下随机抽取免疫组化染色切片上的5个视野,每个视野计数100个细胞,计数其中的阳性细胞数,取其均值计算阳性细胞百分率。
2 结果
2.1 肿瘤生长情况 (1)缺血模型。接种B16细胞悬液后第15天处死全部小鼠。缺血组和对照组分别有8只小鼠肉眼可见黑色素移植瘤于肌间生长(缺血组和对照组未成瘤的并非同一只小鼠)。缺血组瘤组织多成条索状,对照组瘤组织呈球状。(2)生物力学模型。不同压力环境中黑色素瘤生长情况:移植瘤接种第9天,处死小鼠剖开腹腔,9只小鼠肉眼可见黑色素瘤在腹腔内弥漫生长,瘤组织呈黑色、质软,坏死较少。10只小鼠均有移植瘤生长于后肢肌肉间隙,呈球状或条索状,黑色,表面见血管匍行,瘤组织与周围肌肉紧密相连;镜下可见瘤细胞生长活跃,侵入周围肌纤维间隙,将肌梭冲断。缺血组、对照组、后肢组、腹腔组小鼠黑色素移植癌的HE染色切片中均可观察到呈线形或网状分布的一群胞核深染、碎裂溶解的肿瘤细胞,这些条带结构彼此连接且按一定的空间距离分布。
2.2 各组LPPCN细胞百分率比较 缺血组LPPCN细胞百分率高于对照组,差异有统计学意义(t=3.926,P<0.01);后肢组 LPPCN 细胞百分率高于腹腔组,差异有统计学意义(t=4.190,P<0.01),见图 1。
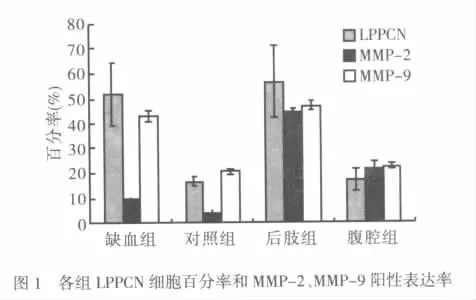
2.3 肿瘤组织MMP-2、MMP-9免疫组化结果比较 MMPs主要表达于肿瘤细胞和间质细胞的细胞浆内,阳性反应产物呈棕黄色,呈弥漫状分布。MMP-2、MMP-9在缺血组瘤组织的阳性率分别高于对照组,差异有统计学意义(t分别为8.978、12.830,均 P < 0.01);MMP-2、MMP-9 在后肢组瘤组织的阳性率高于腹腔组,差异有统计学意义(t分别为8.817、16.970,均 P < 0.01),见图 1。
3 讨论
1999年,Maniotis等[6]在研究高度恶性黑色素瘤时报道了一种不依赖于内皮细胞的全新的肿瘤内血液供应模式:血管生成拟态(VM)。其特点是血管壁的内侧全部由肿瘤细胞衬覆,而非内皮细胞。目前国内外对VM的研究尚处于起步阶段,其确切的分子机制尚不清楚。但大量研究表明肿瘤基质重塑是VM形成的关键,肿瘤细胞表达一些蛋白酶类物质(如MMP-2、MMP-9等),这些蛋白酶类物质可通过降解细胞外基质,参与VM形成过程中的基质重塑[7]。
程序性坏死是近年被提出的一种既不同于凋亡,又有别于坏死的细胞死亡形式[3]。这种死亡细胞在形态学上同样表现为坏死形态,如细胞核出现固缩、碎裂和溶解,没有凋亡小体的出现,然而却受到机体多种信号传导通路的主动调控[8]。此外,凋亡为单个细胞的死亡,其分布较为分散,坏死为群体细胞的死亡,而程序性坏死的细胞则有其特殊的分布形式。
本研究将黑色素瘤细胞株B16接种到C57BL小鼠体内,在肿瘤直径达2~3 mm时(15 d),HE染色切片中可观察到大片实体的肿瘤组织内出现条带样(线形分布)的一群胞核深染、胞浆浓缩且细胞间彼此分离的瘤细胞。这些核固缩的细胞从形态、基因调控和超微结构等不同于传统意义上的凋亡、坏死。免疫组化和电镜观察提示这些瘤细胞可能为肿瘤细胞的另一种特殊的程序性死亡形式,笔者称之为“LPPCN”[4]。随后这些条带结构内的肿瘤细胞发生核碎裂、溶解,细胞解体,在肿瘤组织内出现了一些分布呈网络状的线形空间结构,并出现与内皮依赖性血管相通的现象,有时在一个内皮依赖性血管的周围可见数个呈网络状分布的线形结构。LPPCN和VM的空间分布呈网络状,类似于内皮依赖性血管的空间分布。根据上述现象,笔者推测,在肿瘤快速生长期,由于缺氧和组织压力不断升高,肿瘤组织中的部分肿瘤细胞死亡,诱导基因活化,通过一系列信号传导途径使部分肿瘤细胞发生LPPCN,这些发生LPPCN的肿瘤细胞死亡后残留的空间框架可以作为VM形成的空间结构基础。
本研究利用2个经典的动物移植瘤模型,研究了缺氧、压力与LPPCN形成之间的关系。结果表明,肿瘤组织局部缺氧以及肿瘤生长过程中体积不断增大,挤压肿瘤周围组织所造成的肿瘤组织内的“高压力”微环境均可以促进LPPCN的形成。进一步研究表明,MMP-2,MMP-9在缺血组和后肢组明显高表达,提示LPPCN的形成与细胞侵袭能力的提高有关,而MMP-2,MMP-9又是VM形成过程的重要功能性分子。因此,可以推测LPPCN与VM的形成存在重要的相似性和相关性。
作为一种新的肿瘤细胞死亡模式,目前对LPPCN形成的相关理论仅仅局限在描述性的研究,其分子机制尚不清楚。对LPPCN这种肿瘤细胞的特殊死亡形式的研究有可能解释在肿瘤组织内的缺氧和高压环境下如何形成血管所需的空间结构。因此如能通过抑制LPPCN,使快速生长的肿瘤中无法形成VM和内皮依赖性血管生成所需的空间,则有可能找到抗血管治疗肿瘤的新途径和新靶点。
[1] Kerr JFR,Wyllie AH,Currie AR.Apoptosis:a basic biological phenomenon with wide-ranging implications in tissue kinetics[J].Br J Cancer,1972,26(4):239-257.
[2] Wyllie AH,Kerr JFR,Currie AR.Cell death:the significance of apoptosis[J].Int Rev Cytol,1980,68:251-306.
[3] Zong WX,Ditsworth D,Bauer DE,et al.Alkylating DNA damage stimulates a regulated form of necrotic cell death[J].Genes Dev,2004,18(11):1272-1282.
[4] Zhang S,Li M,Zhang D,et al.Hypoxia influences linearly patterned programmed cell necrosis and tumor blood supply patterns formation in melanoma[J].Lab Invest,2009,89(5):575-586.
[5] Hendrix MJ,Seftor RE,Seftor EA,et al.Transendothelial function of human metastatic melanoma cells:role of the micro-environment in cell-fate determination[J].Cancer Res,2002,62(3):665-668.
[6] Maniotis AJ,Folberg R,Hess A,et al.Vascular channel formation by human melanoma cells in vivo and in vitro:vasculogenic mimicry[J].Am J Pathol,1999,155(3):739-752.
[7] Sood AK,Fletcher MS,Coffin JE,et al.Functional role of matrix metalloproteinases in ovarian tumor cell plasticity[J].Am J Obstet Gynecol,2004,190(4):899-909.
[8] Kitanaka C,Kuchino Y.Caspase-independent programmed cell death with necrotic morphology[J].Cell Death Differ,1999,6(6):508-515.
