电化学沉积法制备Cu2O/CS纳米复合材料的机理研究
2010-07-17陈金毅李宛怡海婷婷
陈金毅,彭 梦,李 念,李宛怡,海婷婷,李 薇
电化学沉积法制备Cu2O/CS纳米复合材料的机理研究
陈金毅1,彭 梦2,李 念1,李宛怡1,海婷婷1,李 薇1
(1. 武汉工程大学 环境与城市建设学院,湖北 武汉 430073; 2. 武汉工程大学 化工与制药学院,湖北 武汉 430073)
采用沉淀析出法,通过加入去溶剂化试剂硫酸钠制备壳聚糖(CS)纳米粒子;通过电化学沉积法制备了Cu2O/CS纳米复合材料. 研究表明,随着反应条件的改变,Cu2O能够在CS纳米颗粒上形成针状或球形等不同形貌. 电化学沉积机理通过透射电子显微镜、X射线光电子能谱技术对二者的结合机制进行了探讨,为Cu2O/CS纳米复合材料的制备和应用研究提供了理论依据.
Cu2O;壳聚糖;纳米复合材料;X射线光电子能谱
Cu2O是一种p型半导体,其直接带宽为2.0 eV,在分解水制氢、超导材料、太阳能电池和负极材料等方面具有重要的应用前景,在可见光催化降解有机污染物方面也具有潜在的应用价值. 因此,选择一种既能够固定和分散纳米Cu2O,又能够去除在光催化降解污染物过程中产生的铜离子的载体材料,是Cu2O能否在水处理中得到广泛应用的关键. 研究者们曾经对多壁碳纳米管[1]、活性炭[2]、玻璃[3]、玻璃纤维[4]、聚碳酸酯膜[5]、漂珠[6]等等作为载体进行过一些尝试. 但上述材料都难以同时解决Cu2O纳米颗粒的控制生长、固定,以及对有机污染物的吸附和对可能出现的残留铜离子的去除等问题.
壳聚糖(CS)是一种优良的生物材料,与大多数生物聚合物一样,CS也因螯合作用而具有离子交换剂的性能. 但与简单的离子交换不同,螯合离子交换是利用其三维分子结构去除特定尺寸的离子[7],故CS对水溶液中铜离子的去除显示出了极好的性能[8-9]. 同时,CS用于纳米半导体光催化剂的负载研究也有了较大进展,研究者分别合成了TiO2/CS[10-11]、CdS/CS[12]、Nb2O5/CS[13]等纳米复合光催化材料.
本研究找到了一种形貌可控的Cu2O/CS纳米复合材料的制备方法,并对二者的结合机理进行研究,以期能为这种新型纳米复合材料的应用研究奠定基础.
1 实验部分
CS购自浙江玉环海洋生物化学公司,脱乙酰度为92%,分子量为210 kDa. 纳米CS制备方法为:2 gCS在磁力搅拌下溶解于100 mL2%(体积比)的乙酸溶液. 待溶液变澄清后,加入一定量的十六烷基三甲基溴化铵(CTAB). 然后在搅拌下缓慢加入一定浓度的硫酸钠溶液. 当出现乳白色悬浊时停止搅拌,过滤,用蒸馏水洗涤3次,再用乙醇洗涤,最后在333 K下真空干燥2 h. 本实验采用自制电解槽[14],铜板作阳极,钛网作阴极,中间用阳离子膜将两极隔开. 向阳极槽里加入250 g/L的NaCl溶液150 mL和15 mg CTAB,向阴极槽里加入1 mol/L的NaOH溶液150 mL.
2 结果与讨论
2.1 Cu2O/CS纳米复合颗粒的分散性
对不同电流下Cu2O/CS纳米复合颗粒的透射电子显微镜(TEM)照片进行分析,结果如图1所示. 可以看出:电流较小(0.05 A)时,针状纳米Cu2O(深色部分)附着在CS颗粒的表面,CS呈现不规则形状,颗粒大小在50~100 nm之间;当电流增大(0.1 A)时,CS表面Cu2O附着量明显增多,且形貌也出现变化,变为颗粒状;当电解电流继续增大至0.6 A后,CS表面Cu2O覆盖度进一步增大,且有多种形貌出现.

图1 不同电解电流下Cu2O/CS纳米复合物的TEM照片
2.2 XPS技术分析复合前后氧元素、氮元素、铜元素的结合能变化
原子内壳层电子的结合能同时受到核内电荷与核外电荷分布的影响,当这些电荷分布发生变化时,就会引起结合能的变化. 同种原子处于不同的化学环境而引起的内壳层电子结合能的变化在谱图上表现为谱线的化学位移. 引起化学位移的原因主要有两方面:一是原子氧化态的变化,二是原子与不同电负性元素的结合. 其中,与其结合的原子的电负性对化学位移的影响较大. 因此,借助光电子能谱及元素的电负性可以分析元素或离子之间的结合状态. 对氧化态来说,原子内壳层电子的结合能随原子氧化态的增高而增大;氧化态越高,化学位移越大. 但二者之间并不存在数值上的绝对关系,在测得原子的结合能后,还应当与标准数据或谱线对照. 一般认为,如果在实验中测得某一元素的化学位移,就可以从理论上推测出该化合物的结构或该元素与周围其它元素的结合状态. 因此,在通过FTIR获得Cu2O和CS之间发生化学作用的初步证据之后,尝试采用XPS技术,通过分析复合前后各元素的结合能的化学位移,进一步验证这种化学作用的存在.
2.2.1 复合前后氧元素的结合能变化
CS与Cu2O复合前后O1s的XPS的变化如图2所示. 从图2-a可以看出:复合前,CS中O1s的结合能在532.6 eV左右,从分子结构和化学键来看,主要体现的是C—O—H[15-16]键的结合能;复合后(图2-b),由于引入了Cu2O,O1s的结合能出现了较大变化,由单个对称峰形变化为宽的不对称峰形. 通过拟合发现,存在3种O1s结合能,即位于531.5 eV处的Cu2O中的晶格氧Cu—O—Cu[17]键的结合能(如图2-b-1所示)、位于532.6 eV左右的CS中未键合的C—O—H[18]中的氧(如图2-b-2所示)和位于533.7 eV左右的C—O—M键的结合能(图2-b-3所示). 由此可见,在复合后,CS上的部分OH与Cu2O发生了相互作用.
2.2.2 复合前后氮元素的结合能变化
CS与Cu2O复合前后N1s的XPS的变化如图3所示. 从图3-a可以看出:复合前,N1s的结合能为399.8 eV;复合后的CS中的N1s 峰在高结合能端出现了一个峰. 经过分峰拟合处理(图3-b),分峰的结合能分别是399.8 eV和401.6 eV,也就是说从N原子的结合能看,部分N原子从吸附前的399.8 eV变化到吸附后的401.6 eV,结合能升高1.8 eV,所以在吸附过程中N原子有明显的失电子或孤对电子被共用的倾向. 从原子结构看,N 原子外层有5个电子,其中3个已配对成键,剩下1对孤对电子失去电子的可能性较小,但很容易提供孤对电子对而形成络合物.

图2 CS与Cu2O/CS复合物的O1s结合能比较

图3 CS与Cu2O/CS复合物的N1s结合能比较
2.2.3 复合前后铜元素的结合能变化


图4 复合前后Cu2p3/2结合能变化
3 电化学沉积法制备Cu2O/CS纳米复合材料的机理
随着反应条件和沉积的改变,Cu2O出现不同的形貌,其反应机理[19]可以解释如下:
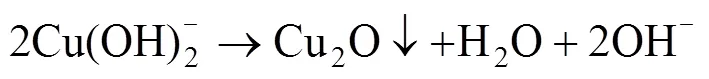
因此,电解反应是等式(1)~(4)的总包反应,即:

4 结论
本文以沉淀析出法制备的纳米壳聚糖为载体,采用电化学沉积法制备了Cu2O/CS纳米复合物. 表征分析发现,壳聚糖通过氨基和羟基与Cu2O发生了相互作用,这为控制实验条件制备不同形貌和性能的复合材料提供了可能.
[1] YU Y, MA L L, HUANG W Y, et al. Coating MWNTs with Cu2O of different morphology by a polyol process[J]. Journal of Solid State Chemistry, 2005, 178: 1 488-1 494.
[2] CHU H P, LEI L, HU X, et al. Metallo-organic chemical vapor deposition (MOCVD) for the development of heterogeneous catalysts[J]. Energy & Fuels, 1998, 12(6): 1 108-1 113.
[3] LU Y M, CHEN C Y, LIN M H. Effect of hydrogen plasma treatment on the electrical properties of sputtered N-doped cuprous oxide films[J]. Thin Solid Films, 2005, 480/481: 482-485.
[4] JORGE M V, SERGIO C, FACUNDO R. Formation of copper oxide films on fiberglass by adsorption and reaction of cuprous ions[J]. Thin Solid Films, 2004, 460: 58-61.
[5] DALTINA A L, ADDADB A, CHOPART J P. Potentiostatic deposition and characterization of cuprous oxide films and nanowires[J]. Journal of Crystal Growth, 2005, 282: 414-420.
[6] 钟爱国. 负载Cu2O可见光催化分解亚甲基蓝[J]. 科学技术与工程,2006, 6(17): 2 733-2 734.
[7] JI J H. Behaviors and mechanism of chitosan adsorbing Cu(II) in solution[J]. Ion Exchange Adsorption, 1999, 15: 511-517.
[8] LIMA I S, AIROLDI C. A thermodynamic investigation on chitosan–divalent cation interactions[J]. Thermochimica Acta, 2004, 421: 133-139.
[9] JUANG R S, SHAO H J. A simplified equilibrium model for sorption of heavy metal ions from aqueous solutions on chitosan[J]. Water Research, 2002, 36: 2 999-3 008.
[10] KIM T Y, LEE Y H, PARK K H, et al. A study of photocatalysis of TiO2coated onto chitosan beads and activated carbon[J]. Research on Chemical Intermediates, 2005, 31(4-6): 343-358.
[11] SU H, LI Q, TAN T. Double-functional characteristics of a surface molecular imprinted adsorbent with immobilization of nano-TiO2[J]. Journal of Chemical Technology and Biotechnology, 2006, 81: 1 797-1 802.

[13] JOCILENE D T, ELAINE A F, JURANDIR R S, et al. Preparation of photoactive chitosan–niobium (V) oxide composites for dye degradation[J]. Journal of Photochemistry and Photobiology A: Chemistry, 2006, 182: 202-206.
[14] YU Y, MA L L, HUANG W Y, et al. Coating MWNTs with Cu2O of different morphology by a polyol process[J]. Journal of Solid State Chemistry, 2005, 178: 1 488-1 494.
[15] BROWN N M D, HEWITT J A, MEENAN B J. X-ray-induced beam damage observed during x-ray photoelectron spectroscopy (XPS) studies of palladium electrode ink materials[J]. Surface and Interface Analysis, 1992 18(3): 187-198.
[16] JOUAN P Y, PEIGNON M C, CARDINAUD Ch, et al. Characterisation of TiN coatings and of the TiN/Si interface by X-ray photoelectron spectroscopy and Auger electron spectroscopy[J]. Applied Surface Science, 1993, 68(4): 595-603.
[17] HAEMERS G, VERBIST J J, MAROIE S. Surface oxidation of polycrystalline “alpha” (75% Cu et 25% Zn) and “beta” (53% Cu et 47% Zn) brass as studied by XPS: influence of oxygen pressure[J]. Applications of Surface Science, 1984, 17: 463-476.
[18] BRIAN J, MEENAN-JANET A, HEWITT-N, et al. X-ray induced beam damage observed during X-ray photoelectron spectroscopy (XPS) studies of palladium electrode ink materials[J]. Surface and Interface Analysis, 1992, 18: 187-198.
[19] CHEN J Y, ZHOU P J, LI J L, et al. Depositing Cu2O of different morphology on chitosan nanoparticles by an electrochemical method[J]. Carbohydrate Polymers, 2007, 67(4): 623-629.
[责任编辑:熊玉涛]
A Study of the Mechanism of Preparing Cu2O/CS Nanocomposites by Electrochemical Deposition
CHENJin-yi1,PENGMeng2,LINian1,LIWan-yi1,HAITing-ting1,LIWei1
Chitosan (CS) nanoparticles were prepared with the precipitation method by adding sodium sulfate; Cu2O/CS nano-composites were prepared by electrochemical deposition. Experiments showed that with the change of the reaction conditions, Cu2O nanoparticles could form needle-like or spherical formations on the surface of chitosan nanoparticles. The electrochemical deposition mechanism was studied with the help of electron microscopy and X-ray photoelectron spectroscopy and it provided the theoretical basis for the preparation and application of the nanocomposite Cu2O/CS.
Cuprous oxide; chitosan; nano-composite materials; X-ray photoelectron spectroscopy
1006-7302(2010)01-0008-06
O614
A
2009-10-31
国家自然科学基金资助项目(50804035),湖北省自然科学基金资助项目(2008CDB375),武汉市青年科技晨光计划项目(200950431194),武汉工程大学青年基金项目(Q0806),武汉工程大学第四届大学生校长基金项目
陈金毅(1974—),男,湖北荆门人,副教授,博士,主要从事纳米环境材料研究,E-mail: clg5998@163.com.
