白念珠菌MAb03.2C1-C2特异性验证及临床研究
2010-07-12宋秋荷邢晓婧钟白玉
宋秋荷,王 鲁,葛 兰,邢晓婧,钟白玉,郝 飞

现阶段流行病学调查研究表明,早期快速、准确检测白念珠菌对于念珠菌感染的确诊及制定有效的治疗方案十分重要。已有研究对抗白念珠菌芽管胞壁外膜单克隆抗体MAb03.2 C1-C2的早期快速实验室诊断白念珠菌感染打下了一定的基础,但对于不同实验室中保存的菌种或不同地域分离的临床菌株是否能得到同样的结论还需要进一步验证。此外,还需要扩展并确定该单抗在临床中检测白念珠菌的意义。为此,本文对该单克隆抗体特异性及临床的拓展应用进行较大样本的研究,以探讨其应用于实验室检测的可行性。
1 资料与方法
1.1 菌株来源及鉴定
白念珠菌标准株ATCC-90028、都柏林念珠菌CCCCM IDC8a及类星形念珠菌CCCCM IDC7为第三军医大学西南医院皮肤科保存菌株。白念珠菌及其他非白念珠菌的酵母菌为重庆市第一人民医院真菌室和九江学院临床医院皮肤科的临床分离株。金黄色葡萄球菌、绿脓假单胞菌由第三军医大学临床微生物教研室赠送。临床分离株通过血清芽管试验及厚壁孢子试验初步鉴定为白念珠菌及非白念念珠菌。白念珠菌通过45℃温度生长及木糖同化试验后进一步鉴定 ,非白念念珠菌通过API 20C AUX 鉴定板条进行鉴定。
1.2 静止态ATCC-90028孢子诱导芽管形成 参考方法[1]。
1.3 临床分离白念珠菌孢子诱导芽管形成 参考方法[1]。
1.4 非白念念珠菌菌丝诱导 参考孙仁美等[2]方法。
1.5 金黄色葡萄球菌和绿脓假单胞菌的培养和鉴定
1.5.1 金黄色葡萄球菌培养和鉴定 将金黄色葡萄球菌接种入7.5%NaCl肉汤中,37℃增菌培养24h;再将上述稀释液或培养液分别划线血平板和Baird-Parker平板,置37℃分离培养24h。从平板上挑取可疑菌落进行革兰氏染色观察、血浆凝固酶试验、耐热核酸酶试验。
1.5.2 绿脓假单胞菌培养和鉴定
普通肉汤培养基中培养24h观察,并继续培养至72h可产生菌膜。
1. 6 临床标本采集
1.6.1 分别在重庆和九江两地收集临床口腔念珠菌病患者口腔真菌涂片标本和阴道念珠菌病患者阴道真菌涂片标本中镜检菌丝阳性标本,并将其涂片风干,4℃保存备用。标本进行常规的真菌培养鉴定。
1.6.2 留取系统性真菌感染患者分泌物或血样标本真菌培养阳性者的静脉血,离心后取血清,-20℃冻存备用。
1.7 腹水单抗的制备与纯化
采用第三军医大学西南医院皮肤科自制的抗白念珠菌芽管胞壁外膜抗原杂交瘤细胞株[1],诱导并纯化腹水单抗MAb03.2 C1-C2,具体操作参考徐志凯等[1,3]方法。
1.7.1 动物种类与来源 6~8 周雌性BALB/c 小鼠,购于重庆医科大学动物实验中心。
1.7.2 小鼠体内诱导-腹水法,参考方法[1]。
1. 8 间接免疫荧光
1.8.1 抗原包被 用带不完全1640液诱导的ATCC-90028带芽管孢子作抗原包被载玻片,阴性及阳性对照。临床分离的念珠菌孢子和菌丝、常见酵母菌孢子、金黄色葡萄球菌、绿脓假单胞菌、临床口腔念珠菌感染患者假膜涂片及阴道念珠菌病患者白带涂片作抗原包被玻片。
1.8.2 间接免疫荧光(IIF)法 腹水单抗为一抗(1︰100稀释),异硫氰酸荧光素(FITC)标记的羊抗鼠IgG (工作浓度1︰100)为二抗,行常规的IIF法。
1.9 酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)
用确定的临床冻存的系统性真菌感染患者血清为抗原包被酶标板,封闭后与腹水单抗37℃孵育1 h,洗涤后加辣根过氧化物(HRP)标记的羊抗鼠IgG(工作浓度1︰5000),孵育及洗涤同上,加邻-苯二胺(orth-phenylene diamine,OPD)底物显色20min后终止反应,以上每步均用PBS加Tween20洗涤液洗涤3次,每次3min,同时设阴性和空白对照。
2 结果
2.1 菌株鉴定结果
临床分离株共计135株白念珠菌,61 株8种非白念念珠菌,4株新型隐球菌。
2.2 ATCC-90028静止态孢子诱导芽管结果
得到ATCC-90028带芽管孢子,芽管诱导率>95%。
2.3 临床分离白念珠菌芽管或菌丝诱导结果
得到临床分离白念珠菌带芽管孢子,芽管诱导率>68%。
2.4 非白念念珠菌、新型隐球菌菌丝诱导
61例8种非白念念珠菌中除光滑念珠菌外均可诱导出菌丝。新型隐球菌未见芽管或菌丝形成(表1)。

表1 临床分离的非白念念珠菌(61例)及新型隐球菌(4例)菌丝诱导结果
2.5 腹水单抗的制备
诱生小鼠腹水单抗,并用IIF检测到腹水抗体滴度可达1: 25600。
2.6 间接免疫荧光
2.6.1 135例临床分离白念珠菌孢子表面荧光均为阴性,芽管或菌丝表面荧光均为阳性(图1)。
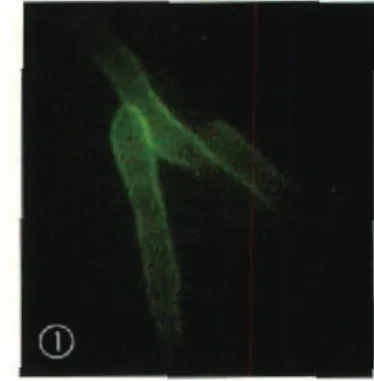
图1 白念珠菌芽管显示荧光,孢子不显示荧光
2.6.2 新型隐球菌、金黄色葡萄球菌、绿脓假单胞菌表面均不存在荧光。
2.6.3 口腔念珠菌病和阴道念珠菌病患者临床标本经实验室常规鉴定,其中122例口腔念珠菌病患者中84例为白念珠菌(68.85%),38例为非白念念珠菌。78例阴道念珠菌病患者中,51例为白念珠菌(65.38%),27例为非白念念珠菌。135例白念珠菌孢子表面荧光均为阴性,菌丝表面荧光均为阳性。而65例临床分离的非白念念珠菌及新型隐球菌的芽管和孢子上均有荧光(图2) 。
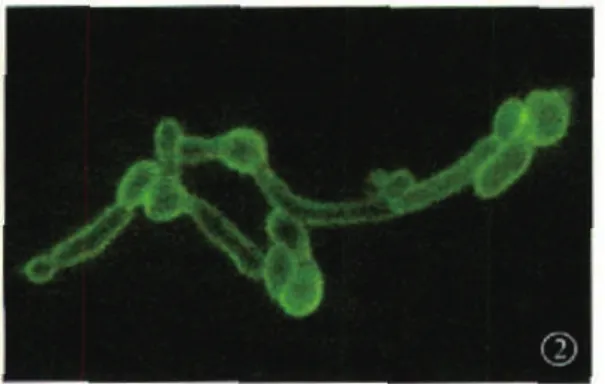
图2 非白念念珠菌孢子和芽管均显示荧光
2.6.4 系统性真菌感染患者血清学ELISA检测结果
临床通过标本培养共确诊深部真菌感染7例,其中3例为白念珠菌菌血症,2例肺曲霉病,2例新型隐球菌脑炎。用单抗进行血清学ELISA法检测,3例白念珠菌菌血症中全部阳性,2例肺曲霉病和2例新型隐球菌脑炎均为阴性。
3 讨论
近20年来,由于抗生素、免疫抑制剂及皮质类固醇激素在临床上的广泛应用,以及器官移植、导管插管和放疗、化疗等治疗技术的开展,尤其是免疫抑制或免疫缺陷的患者在不断地增加[4,5],导致系统性真菌的感染率逐年上升,增加约40倍,且死亡率高[6]。国内统计中占住院患者病死率的29%(无真菌感染者仅为17%),国外占院内感染的25%[6]。在发达国家,器官移植受者和恶性肿瘤病人中系统性真菌感染的发病率高达20%~40%,而且往往是致命的感染[7]。
白念珠菌感染率已由1986年的5.0%骤升到1996年的19.6%,从而跃居系统性真菌感染的第一位。白念珠菌及同属的其他菌种对系统性抗真菌药物如唑类药的敏感性不同,因此快速诊断并将念珠菌鉴定到种对于确定有效的治疗十分重要[4,8]。针对白念珠菌在致病时所具备或释放的某些特异性抗原的检测已经成功地运用到临床检测工作中,如白念珠菌烯醇化酶,白念珠菌胞壁重要成分磷脂酶和天冬氨酸蛋白酶等[9-12]。
白念珠菌是生物有机体内的双相真菌。理论上,当白念珠菌系统性感染时,同源可溶性抗原释放入血,白念珠菌形态可发生改变,由孢子相转向芽管相,因此在血中检测到白念珠菌芽管或菌丝的特异性抗原,可以最后确诊为系统性白念珠菌感染[13]。而单克隆抗体因为其高度的特异性可以作为血清检测的主要成分。
在此之前,很多学者进行了抗白念珠菌芽管外膜杂交瘤细胞融合实验,用白念珠菌芽管孢子进行免疫,获得MAb C7,结果IFA显示该单抗特异性不强,与白念珠菌、葡萄牙念珠菌、新型隐球菌等菌种均可反应[14,15],2000年Marot-Leblond 等[16]又成功制备了世界上第一例抗白念珠菌芽管胞壁外膜抗原杂交瘤细胞株,在对其分泌的单抗做了初步分析的同时,对单抗的特异性也进行了验证,实验结果显示其单抗只与白念珠菌及类星形念珠菌的芽管外膜反应。目前,这方面的研究尚无明显进展,但我们就白念珠菌的生物学特征和临床致病特点来看,研究白念珠菌芽管胞壁外膜抗原的特性和其抗体的应用,也许是今后解决快速、早期检测深部白念珠菌感染的一条捷径。所以我们在成功制备了单抗MAb03.2C1-C2之后,针对该单抗的特异性验证,进行了多中心多地域的病原体采集和实验。
本实验再次应用本科制备的杂交瘤细胞株所对应的抗白念珠菌芽管外膜抗原特异性单抗MAb03.2C1-C2于多地域的临床分离株和深部白念珠菌感染的检测,结果显示单抗的特异性很高,达到100%。在白念珠菌孢子部位及与白念珠菌形态学上特别接近都柏林念珠菌的芽管和孢子上均无荧光可见,并成功地用此单抗与芽管和菌丝之间的交叉反应来鉴定并区分临床中白念珠菌和其他念珠菌、酵母菌、细菌感染。在检测深部白念珠菌感染时所花费的时间远远少于真菌培养的时间,为今后研究该单抗快速、早期地诊断及鉴别深部白念珠菌感染打下了坚实的实验基础。因此,在结合并总结前人[2]工作的基础上,我们初步判断该株单抗MAb03.2C1-C2是目前惟一一株抗白念珠菌芽管胞壁外膜抗原特异性的单克隆抗体,为该单抗今后在实验研究和临床应用中起到进一步先证作用。
[1]宋秋荷, 王鲁, 李元忠, 等. 抗白念珠菌芽管单克隆抗体杂交瘤细胞株的建立及其对血清芽管诱导率的影响 [J]. 中国皮肤性病学杂志, 2005, 19(11):650-653.
[2]孙仁美, 王鲁, 唐书谦, 等. 抗白念珠菌芽管单抗MAb03.2C1-C2特异性及临床初步应用研究 [J]. 中国皮肤性病学杂志, 2006,11(20):658-661.
[3]徐志凯. 实用单克隆抗体技术 [M]. 西安:陕西科学技术出版社,1992, 93-142.
[4]Calderone RA, Fonzi WA. Virulence factors of Candida albicans [J].Trends Microbiol, 2001, 9(7):327-335.
[5]Niewerth M, Korting HC. Phospholiases of Candida albicans [J].Mycoses, 2001, 44(9-10):361-367.
[6]Nitz M, Ling CC, Otter A, et al. The unique solution structure and immunochemistry of the Candida albicans beta -1,2-mannopyranan cell wall antigens [J]. J Biol Chem, 2002 , 277(5):3440-3446.
[7]李若瑜, 李东明, 余进, 等.真菌与真菌病研究近况 [J]. 北京大学学报(医学版), 2002, 34(5):559.
[8]Moter A, Gobel UB. Fluorescence in situ hybridization (FISH)for direct visualization of microorganisms [J]. J microbiol Methods, 2000, 41(2):85-112.
[9]Sundstrom P, Jensen J, Balish E. Humoral and cellular immune responses to enolase after alimentary tract colonization or intravenous immunization with Candida albicans [J]. J Infect Dis, 1994, 170:390-395.
[10]Sugiyama Y, Nakashima S, Mirbod F, et al. Molecular cloning of a second phospholipase B gene, caPLB2 from Candida albicans[J]. Med Mycol, 1999, 37(1):61-67.
[11]Leidich SD, Ibrahim AS, Fu Yue, et al. Cloningand disruption of caPLB1, a phospholipase B gene involved in the pathogenicity of Candida albicans [J]. J Biol Chem, 1998, 273(40):26078-26086.
[12]Kantarcioglu AS, Yucel A. Phospholipase and protease activities inclinical Candida isolate with reference to the sources of strains[J]. Mycoses, 2002, 45:160-165.
[13]Paula MS, George K. Characterization of antigens specific to the surface of germ tubes of Candida albicans by immunofluorescence [J]. Infect Immun, 1984, 43(3):850-855.
[14]Marot-Leblond A, Robert R, Aubry J, et al. Identification and immunochemical characterization of a germ tube specific antigen of Candida albicans [J]. FEMS Immunol Med Microbiol, 1993,7(2):175-186.
[15]Moragues MD, Omaetxebarria MJ, Elguezabal N, et al. A monoclonal antibody directed against a Candida albicans cell wall mannoprotein exerts three Anti-C. albicans Activities [J].Infect Immun, 2003, 71(9):5273-5279.
[16]Marot-Leblond A, Grimaud L, Nail S, et al. New monoclonal antibody specific for Candida albiccans germ tube [J]. J Clin Microbio, 2000, 38(1):61-67.
