转谷氨酰胺酶催化对大豆分离蛋白凝胶性的影响
2010-07-09于国萍初云斌韩宗元姜巍巍
于国萍,安 静,初云斌,韩宗元,李 岩,姜巍巍
(东北农业大学食品学院,哈尔滨 150030)
大豆是一种重要的经济作物,是我国当前农业生产与食品加工重点发展目标之一[1]。其中大豆蛋白是大豆中最重要的成分,它已作为一种组分应用于各种食品中。大豆蛋白产品的溶解性、保水性、吸水性,是大豆蛋白产品能够在食品中很好应用的重要基础之一[2]。从国际食品业的发展趋势看,大豆食品产业即将成为21世纪促进人类健康的基本保健食品和主流食品。
大豆分离蛋白(Soybean protein isolated,SPI)网络结构和凝胶的形成过程受盐浓度、pH及温度等因素的影响。Braga等研究发现,蛋白质网络结构的形成是由于蛋白质-蛋白质和蛋白质-水之间的相互作用平衡以及相邻多肽链之间吸引力和排斥力共同作用的结果[3]。在热诱导大豆蛋白凝胶形成的过程中,涉及的分子作用力可能是氢键、疏水性相互作用,而维持凝胶结构时可能的作用力是二硫键和氢键[4]。
转谷氨酰胺酶(Transglutaminase,TGase)是一种能催化多肽或蛋白质的谷氨酰胺残基的γ-羟胺基团(酰基供体)与许多伯胺化合物(酰基受体)之间的酰基转移反应的酶。转谷氨酰胺酶的添加,提高了大豆分离蛋白的凝胶能力及性能。国外的转谷氨酰胺酶交联的高蛋白产品在市场已广泛存在[5]。
本文以大豆分离蛋白为原料,系统地研究了转谷氨酰胺酶处理的大豆蛋白凝胶形成机理以及对大豆分离蛋白凝胶强度、保水性和表面疏水性的影响,了解其变化规律,寻找其可能的变化机理,为改进我国大豆蛋白的功能性和应用价值提供参考,从而获得不同质构的大豆蛋白凝胶产品。对食品加工业也具有积极的指导意义,解决了食品加工中存在的难题,明显改善食品品质。
1 材料与方法
1.1 材料与仪器
1.1.1 试剂
1-苯胺基萘-8-硝基苯甲酸盐(ANS),Tris,甘氨酸,过硫酸氨,TEMED(购自Sigma公司);大豆分离蛋白(购自哈高科大豆食品有限责任公司)。其余所用试剂均为国产分析纯。
1.1.2 酶制剂
转谷胺酰胺酶(TG-B)(952 U·g-1),购自一鸣生物制品有限公司。
1.1.3 仪器
TA-XT plus物性测定仪(购自英国Stable Micro System公司);荧光分光光度计(HITACHI 650-60)(购自日本岛津公司);扫描电镜(购自日本日立公司);实验室pH计(购自梅特勒-托利多仪器(上海)有限公司);HJ-3恒温磁力搅拌器(购自江苏金坛市中大仪器厂);离心机(购自北京医药离心机厂)。
1.2 方法
1.2.1 转谷氨酰胺酶催化条件下制备大豆分离蛋白凝胶
1.2.1.1 不同加酶量对大豆分离蛋白凝胶的影响
配制13%(W/V)大豆分离蛋白分散液,调pH 7.5,添加 TGase 量分别为 0、10、20、30、40、50、60 U·g-1蛋白,反应物于40℃下反应0.5 h。
制胶条件:将样品在90℃加热40 min。然后,用冰水浴将凝胶迅速冷却至室温。最后,将样品置于4℃冰箱过夜,用于凝胶性质的测定。
1.2.1.2 不同反应温度对大豆分离蛋白凝胶的影响
配制13%(W/V)大豆分离蛋白分散液,调pH到7.5,添加TGase量40 U·g-1,反应物于30、40、50、60、70℃下反应0.5 h。按1.2.1.1的制胶条件,制备凝胶。
1.2.1.3 不同pH对蛋白的影响
配制13%(W/V)大豆分离蛋白分散液,调pH 5.5、6、6.5、7、7.5、8、8.5,添加 TGase 量 40 U·g-1,反应物于40℃下反应0.5 h。按1.2.1.1的制胶条件,制备凝胶。
1.2.1.4 不同反应时间对蛋白的影响
配制13%(W/V)大豆分离蛋白分散液,调pH到7.5,添加TGase量40 U·g-1,反应物于40℃下分 别 反 应 0.5、 1、 1.5、 2、 2.5、 3、 3.5 h。 按1.2.1.1的制胶条件,制备凝胶。
1.2.2 转谷氨酰胺酶的二次回归正交旋转组合试验设计
在单因素试验结果的基础上,确定了试验各因素的水平设置范围,进行多因素试验。采用二次回归正交旋转组合设计方法(响应面法),选择酶添加量、温度、pH、作用时间4个变量组成操作参数集合。以凝胶强度为考察指标,采用Design Expert7.0软件建立数学模型,寻找转谷氨酰胺酶催化改性大豆分离蛋白凝胶强度取得最大值的条件,因素水平见表1。

表1 转谷氨酰胺酶的二次旋转正交设计因素水平编码Table 1 Level and factor design of square rotation cross-regression experiments(TGase)
1.2.3 蛋白凝胶的凝胶强度的测定
测定方法依据Gu等[6],略有改动。样品测定前在室温下陈化1 h即可测定。凝胶大小约为50 mm(直径)×25 mm(高)。采用P/0.5柱形探头,设定前进速度10 mm·s-1,冲压速度10 mm·s-1;后撤速度10 mm·s-1,冲压深度10 mm;一次测定过程中探头下压两次。每个样品重复3次测定过程,取平均值,得凝胶质构参数。
1.2.4 蛋白凝胶的表面疏水性的测定[7-8]
取一块大豆蛋白凝胶,加入到0.01 mol·L-1pH 7.0的磷酸缓冲液中,在室温下,用磁力搅拌器缓慢的搅拌2 h。然后,将处理过的样品在9 000 r·min-1下离心15 min。取上清液备用。采用ANS(1-苯胺基-8-萘磺酸)荧光探针法,对大豆分离蛋白凝胶的表面疏水性指数进行测定,具体方法见文献[8]。
1.2.5 蛋白凝胶的保水性的测定
测定方法依据Gu等[6],略有改动。大豆蛋白凝胶在 9 000 r·min-1下离心 20 min。保水性(WHC)公式如下:

式中,Wt-凝胶样品中所含水分的总重(g),Wr-离心后凝胶溢出水分的重量(g)。
1.2.6 SPI及其凝胶的SDS-PAGE电泳分析
把SPI和从SPI凝胶中提取出的蛋白作为样品,加入到样品缓冲液(0.5 mol·L-1Tris-HCl(pH 6.8)2 mL,甘油 2 mL,20%(W/V)SDS 2 mL,0.1%(W/V)溴酚蓝0.5 mL、β-巯基乙醇1 mL、重蒸水2.5 mL)中,最终蛋白浓度是 1 mg·L-1。标准蛋白质Marker分子质量14 400~97 400 u。在80和120 V下,浓缩胶(4%)和分离胶(14%)进行电泳试验。考马斯亮蓝(R-250)染色液染色。然后用脱色液(冰醋酸75 mL和甲醇50 mL,定容到1 000 mL)脱色。
1.2.7 扫描电镜分析(Scanning electron microscopy,SEM)[10]
测定方法参照文献[9]。
1.2.8 统计分析
每次试验重复3次。所用数据均为3次的平均数,误差项为标准差;数据肩标有相同字母者为差异不显著(P>0.05),有不同字母者为差异显著(P<0.05)。文中数据均使用SPSS13.0软件进行统计分析。
2 结果与分析
2.1 转谷氨酰胺酶催化对大豆分离蛋白凝胶性的影响
2.1.1 酶添加量对大豆分离蛋白凝胶强度的影响
结果表明,随着加酶量的增加,凝胶强度显著增加;加酶量在40 U·g-1时,凝胶强度达到最大;随着加酶量继续增加,凝胶强度有所下降(见图1)。

图1 酶添加量对TGase催化大豆分离蛋白凝胶强度的影响Fig.1 Effect of enzyme additives on gel hardness of TGase-SPI gel
在本试验中,转谷氨酰胺酶(TGase)浓度升高到40 U·g-1时,蛋白质的凝胶强度达到最大值,说明添加TGase对SPI凝胶强度有很明显的改善作用,此时维系蛋白质凝胶网络稳定所需的共价键的数目具有一定的饱和性。蛋白质分子表面的作用位点一定,过量的酶的添加,已没有足够的蛋白底物与之反应,使凝胶强度在达到最高点后趋于稳定。
2.1.2 温度对大豆分离蛋白凝胶强度的影响
结果表明,随着酶反应温度的增加,凝胶强度显著增加;在40~60℃,没有显著变化;在70℃时,凝胶强度显著下降(见图2)。

图2 温度对TGase催化大豆分离蛋白凝胶强度的影响Fig.2 Effect of temperature on gel hardness of TGase-SPI gel
温度一方面影响酶反应的速度,另一方面影响酶活性。唐传核等报道,TGase的最适反应温度为50~55℃[10]。Ando等曾报道,以氧肟酸为底物时,微生物TGase在pH 7.0时,酶的最适反应温度为40℃[11]。本试验与上述结论基本相符合。较高的温度下交联反应速度很快,使得蛋白质分子表面的作用位点很快被交联而降低了此蛋白质分子与其周围蛋白质分子进行分子间交联的机率,因而分子间的交联所占比例下降[12,12-13]。
2.1.3 pH对大豆分离蛋白凝胶强度的影响
结果表明,随着pH的增加,凝胶强度显著增加;当pH 7.5时,凝胶强度最高;之后,随着pH的继续增加,凝胶强度显著下降(见图3)。

图3 pH对TGase催化大豆分离蛋白凝胶强度的影响Fig.3 Effect of pH on gel hardness of TGase-SPI gel
体系pH改变一方面影响酶活性和稳定性,TGase的最适pH范围是6.0~7.5;另一方面影响SPI的溶解性,影响蛋白质相互作用过程中的疏水作用和静电作用之间的平衡,进而影响凝胶的网状结构。在极高pH下,酶蛋白不稳定发生空间构象改变而丧失活性;而pH处于SPI的等电点附近时,蛋白质分子所带净电荷较少,易凝结成块,无法形成有序的网状结构[14-15]。
2.1.4 作用时间对大豆分离蛋白凝胶强度的影响
结果表明,随着反应时间的增加,凝胶强度显著增加;在2.5 h时,凝胶强度达到最大;之后,呈现下降趋势(见图4)。
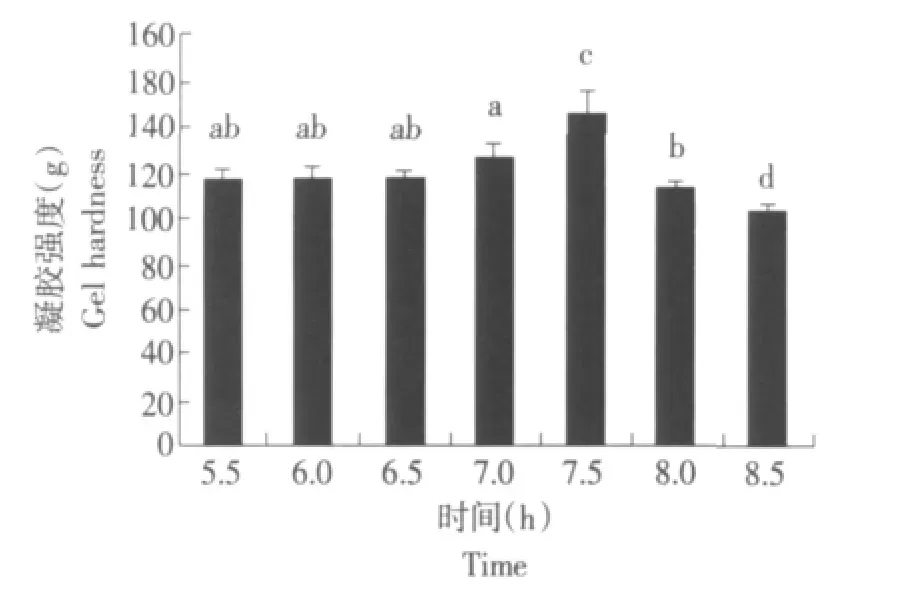
图4 作用时间对TGase催化大豆分离蛋白凝胶强度的影响Fig.4 Effect of time on gel hardness of TGase-SPI gel
反应时间也是影响酶促反应的重要因素,因此对SPI的凝胶性也必然产生较大的影响。
2.2 转谷氨酰胺酶(TGase)的二次回归正交旋转组合试验设计
2.2.1 TGase催化SPI凝胶强度的二次回归正交旋转组合试验设计结果
在单因素试验结果的基础上,依据表1的因素水平,得出试验设计方案及结果(见表2)。

表2 TGase催化SPI凝胶强度的试验设计方案和试验结果Table 2 Design and result of square rotation cross-regression experiments of TGase-gel hardness

续 表
2.2.2 TGase催化SPI凝胶强度的逐步回归模型
以酶添加量(A)、温度(B)、pH(C)、作用时间(D)4个因素为自变量,以凝胶强度(g)为响应值,根据表2中的试验结果,运用Design-Expert7.0软件对其进行回归拟合,并去除不显著项,得到操作参数对凝胶强度的回归方程为:
凝胶强度(g)=150.39+4.81×A+4.97 B+5.38×C+3.16×A×C+4.31×A×D-8.40×B×D+4.27×C×D-11.64×A2-12.53×B2-17.17×C2-7.38×D2
同时得到方差分析表3。

表3 TGase催化SPI凝胶强度的方差分析

续 表
通过对凝胶强度回归模型进行显著性检验,其F 值=40.07,概率(Pr>F)值=<0.0001,说明凝胶强度的回归模型显著,回归方程确定系数R2为0.9740,表明模型拟合度较好。由回归分析可知,转谷氨酰胺酶的交互作用AC(酶添加量-pH)、AD(酶添加量-作用时间)、BD(温度-作用时间)、CD(pH-作用时间)对大豆分离蛋白凝胶强度的影响是显著的。分析出最佳条件为:酶添加量40 U·g-1、温度40℃、pH 7.5、作用时间2.5 h。此时,大豆分离蛋白最大凝胶强度为156.699 g。进行验证试验,实测值为(150.547±6.374)g。
2.2.3 具有显著交互作用的因素对大豆分离蛋白凝胶强度的影响
2.2.3.1 酶添加量-pH的交互作用对转谷氨酰胺酶催化大豆分离蛋白凝胶强度的影响
结果如图5所示。
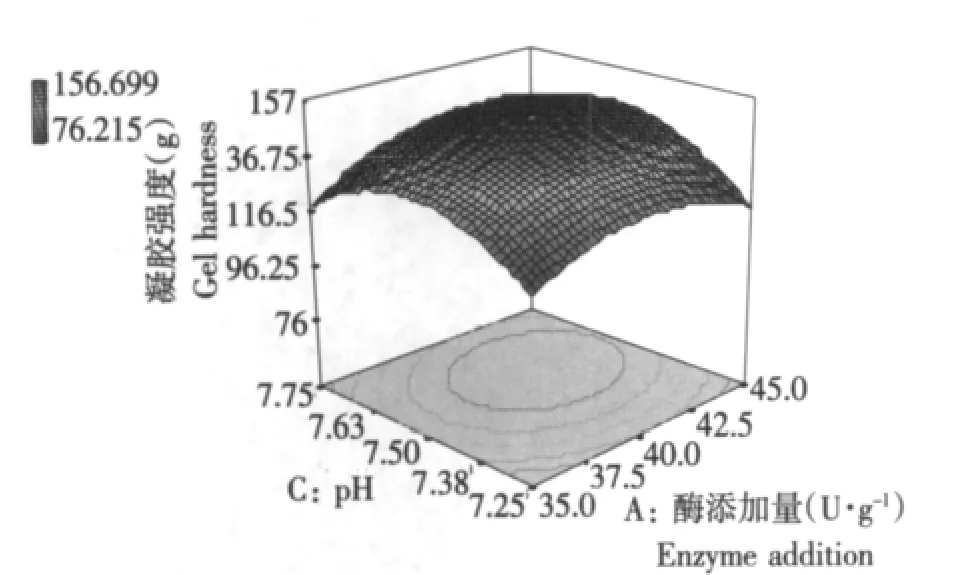
图5 酶添加量-pH的交互作用对TGase催化SPI凝胶强度的影响Fig.5 Effect of interaction effect of enzyme additives and pH on TGase-gel hardness
在温度40℃和作用时间2.5 h时,研究pH和作用时间的交互作用对凝胶强度的影响。当酶添加量一定时,凝胶强度随着pH的增加逐渐增大;当pH 7.5时,达到最大;之后,呈现下降趋势。当pH一定时,凝胶强度随着酶添加量的增加逐渐增大;当酶添加量40 U·g-1时,达到最大;之后,呈现下降趋势。说明酶添加量和pH对凝胶强度的变化起到了较大作用。在pH 7.5、酶添加量40 U·g-1时,凝胶强度最大。
2.2.3.2 温度-作用时间的交互作用对转谷氨酰胺酶催化大豆分离蛋白凝胶强度的影响
结果见图6。
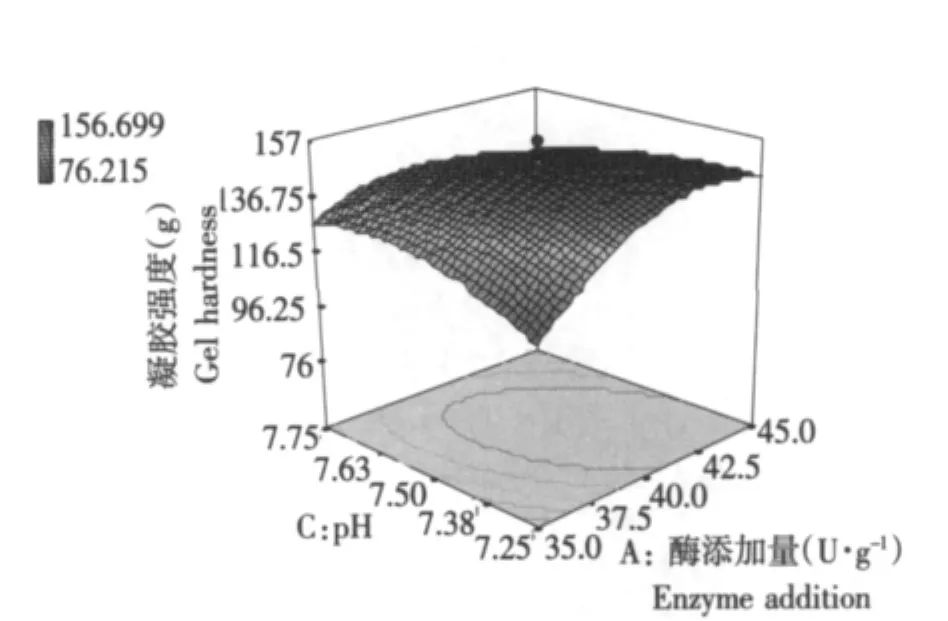
图6 温度-作用时间的交互作用对TGase催化SPI凝胶强度的影响Fig.6 Effect of interaction effect of temperature and time on TGase-gel hardness
响应面分析结果表明,在pH 7.5和酶添加量40 U·g-1时,研究温度和作用时间的交互作用对凝胶强度的影响。当作用时间一定时,凝胶强度随着温度的增加逐渐增大;当温度40℃时,达到最大;之后,呈现下降趋势。当温度一定时,凝胶强度随着作用时间的增加逐渐增大;当作用时间2.5 h时,达到最大;之后,呈现下降趋势。说明作用时间和温度对凝胶强度的变化起到了较大作用。在作用时间2.5 h、温度40℃时,凝胶强度最大(见图 6)。
2.3 转谷氨酰胺酶催化前后蛋白凝胶的电泳图谱
结果见图7。
由图7可知,加入转谷氨酰胺酶后,由于TGase对大豆蛋白交联聚合作用,使聚合物分子量增大,以至于不能全部进入分离胶,而部分蛋白只能停留在浓缩胶与分离胶的界面上,即图中顶端电泳区带。经电泳后,7S的3个亚基和11S的酸性亚基(A)条带色泽变淡或消失,说明二者聚合生成了大分子蛋白聚合物。而大豆11S蛋白的碱性亚基(B)在各加酶量条件下几乎都没有明显的变化,说明TGase对11S碱性亚基几乎没有影响,可能是因为11S的碱性亚基被深深地包在大豆球蛋白的内部,很难与TGase结合形成活化复合物。

图7 转谷氨酰胺酶催化后蛋白凝胶的电泳图谱Fig.7 SDS-APGE of soybean protein modification
2.4 转谷氨酰胺酶催化前后对大豆分离蛋白凝胶特性的影响
结果见图8、9。
由图8、9可以看出,转谷氨酰胺酶催化后大豆分离蛋白凝胶强度显著增加,而表面疏水性和保水性却有所下降。

图8 转谷氨酰胺酶催化前后对大豆分离蛋白凝胶强度的影响Fig.8 Effect of TGase on gel hardness of SPI gel
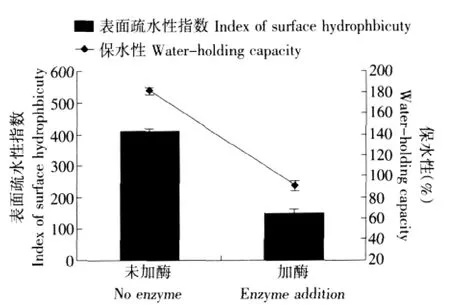
图9 转谷氨酰胺酶催化前后对大豆分离蛋白凝胶表面疏水性和保水性的影响Fig.9 Effect of TGase on surface hydrophobicity and water-holding capacity of SPI gel
2.5 扫描电镜观察TGase催化的大豆分离蛋白凝胶的微观结构
如图10所示,TGase催化的大豆分离蛋白凝胶,较对照组凝胶网络结构非常致密,凝胶网络结构分布非常均匀。


图10 TGase催化的大豆分离蛋白凝胶的微观结构Fig.10 Micro-structure of TGase-SPI gel observed by scanning electron microscopy
3 讨论与结论
转谷氨酰胺酶的添加,提高了大豆分离蛋白的凝胶能力及性能,适度酶解导致的蛋白中疏水基团的暴露有利于在较低的蛋白浓度下形成网络组织结构。TGase催化SPI形成凝胶的主要作用是分子交联形成的空间网络结构[13-15]。
MTGase催化大豆蛋白溶解性下降。SDSPAGE分析可知,MTGase的作用形成了较大的共价聚合物,亲水性基团因相互聚合而减少,这对溶解性的下降起一定的作用。经MTGase催化,SPI溶解度下降,所以凝胶表面疏水性和保水性下降。
转谷氨酰胺酶能够显著的提高了大豆分离蛋白凝胶的凝胶强度。最佳工艺条件为:酶添加量40 U·g-1、温度40℃、pH 7.5、作用时间2.5 h。加入酶 后 , 凝 胶 强 度 由(67.185±1.028)g 增 加 到(150.547±6.374)g。但此时凝胶表面疏水性指数显著下降,由(406.73±11.86)降低到(181.69±3.06);凝胶保水性有所下降,由97.33%±0.66%降低到90.93%~3.45%。
[1]赵新淮,郑秋鹛,李友华.国外大豆蛋白的生产、特性和应用概况[J].东北农业大学学报,2003,34(3):344-351.
[2]刘宏芳,侯瑶,赵新淮.大豆蛋白限制性酶解修饰与产品的溶解性和保水性变化[J].东北农业大学学报,2009,40(1):97-103.
[3]Braga A L M,Azevedo A,Marques M J,et al.Interactions between soy protein isolate and xanthan in heat-induced gels:The effect of salt addition[J].Food Hydrocolloids,2006,20:1178-1189.
[4]UtsumiS,KinsellaJE.Forcesinvolvedinsoyproteingelation:Effects of various reagents on the formation,hardness and solubility of heat-induced gels made from 7S,11S and soy isolate[J].Journal of Food Science,1985,50:1278-1282.
[5]Gan C Y,Cheng L H,Easa A M.Physicochemical properties and microstructures of soy protein isolate gels produced using combined cross-linking treatments of microbial transglutaminase and Maillard cross-linking[J].Food Research International,2008,41:600-605.
[6]Gu X,Campbell L J,Euston S R.Influence of sugars on the characteristics of glucono-δ-lactone-induced soy protein isolate gels[J].Food Hydrocolloids,2009,23:314-326.
[7]Campbell L J,Gu X,Dewer S J,Euston S R.Effects of heat treatment and glucono-δ-lactone-induced acidification on characteristics of soy protein isolate[J].Food Hydrocolloids,2009,23:344-351.
[8]Hettiarachchy N S,Kalapathy U,Myers D J.Alkal-modified Soy proteins with improved adhesive and hydrophobic properties[J].Journal of Agricultural and Food Chemistry,1995,72(12):1461-1464.
[9]Chin K B,Go M Y,Xiong Y L.Effect of soy protein substitution for sodium caseinate on the transglutaminate-induced cold and thermal gelation of myobrillar protein[J].Food Research International,2009(1):1-8.
[10]唐传核,杨晓泉,彭志英,等.微生物转谷氨酰胺酶催化大豆11S球蛋白聚合研究[J].食品科学,2002,23(3):42-46.
[11]Ando H,Adachi M,Umeda K,et al.Purification and characteristics of a novel trans-lutaminase derived from microorganisms[J].Agric Biol Chem,1989,53:2613-2617.
[12]姜燕,温其标,唐传核.微生物谷氨酰胺转移酶对大豆分离蛋白凝胶性能的影响[J].食品工业科技,2006,27(5):59-62.
[13]田少君,梁华民.转谷氨酰胺酶对大豆分离蛋白的改性研究[J].粮油加工与食品机械,2005(6):54-59.
[14]袁道强,杨丽.改性对大豆分离蛋白凝胶性的影响[J].食品科技,2007,14(2):21-23.
[15]郑雅丹,张建友,丁玉庭,等.大豆蛋白凝胶特性研究进展[J].中国酿造,2008,191(14):1-15.
