马铃薯SSR标记多重PCR反应体系优化研究
2010-07-09王绍鹏刘尚武刘伟婷吕典秋
王绍鹏,刘尚武,李 勇,刘伟婷,吕典秋
(黑龙江省农业科学院植物脱毒苗木研究所,黑龙江省马铃薯工程技术研究中心,哈尔滨 150086)
微卫星序列又称简单序列重复(Simple sequence repeat,SSR)标记具有数量丰富、周期短、不受环境条件影响,高度多态性、共显性及复等位性,试验重复性好、结果可靠性高等优点[1-2],该技术克服了形态学标记、蛋白质及同工酶等鉴定技术的缺点和不足,成为一种极具实用价值的标记方法。应用SSR标记在甜瓜、黄瓜、砂梨等方面已经开展了研究[3-5]。
多重PCR(Multiplex PCR)技术是指在一个单一反应体系中加入一对以上的特异引物对,同时扩增多个序列,从而产生高度特异性的反应过程[6],该技术能够适应高通量DNA指纹分析的需要,节省DNA模板和试验耗材,简化操作步骤,加速试验进程[7]。目前,对多重PCR体系优化的策略和步骤已有大量相关的研究和报道[8-11],但在马铃薯作物中,尚无人开展这方面的研究。
本研究对影响多重PCR反应结果的关键因素(模板DNA的纯度和浓度、引物的质量和特异性、Taq酶的用量及dNTPs的浓度等)进行了优化分析,建立多重PCR反应体系最佳模型,以期在马铃薯品种纯度鉴定应用中发挥重要作用,并为马铃薯品种遗传多样性分析,建立马铃薯品种DNA指纹图谱奠定理论基础。
1 材料与方法
1.1 材料
试验选用的马铃薯品种保存于黑龙江省农业科学院植物脱毒苗木研究所品种资源库,品种信息见表1,多重PCR扩增所用引物由加拿大蒙特利尔麦吉大学科研组提供,并由上海生工生物技术公司合成(引物序列信息见表2),其他试剂均购自大连宝生物试剂公司。

表1 黑龙江省马铃薯主栽品种Table 1 Main potato varieties in Heilongjiang Province

表2 试验用引物序列Table 2 Primer sequence in experiment
1.2 方法
1.2.1 马铃薯基因组DNA的提取
采用DNA提取缓冲液(Isolation buffer)提取马铃薯DNA。
Isolation buffer提取液配方如下:100 mmol·L-1Tris(pH 8.0)、 50 mmol·L-1EDTA(pH 8.0)、 1.3 mol·L-1NaCl、0.2%SDS、0.5%Triton X-100、1%PVP、10 mmol·L-1DTT、60 mmol·L-1β-mercaptoethanol,其他操作步骤同一般SDS提取方法。将提取的DNA样品用ddH2O稀释到60 ng·μL-1后,置于-20℃保存。
DNA质量测定:将提取到的DNA,用1%琼脂糖凝胶电泳, 0.5 μg·mL-1溴化乙锭(Ethidium bromid,EB)染色,Alpha Innotech公司的December2006型紫外凝胶成像仪检测结果,并用Thermo公司的NANODROP1000型紫外分光光度计测量DNA纯度和浓度。
1.2.2 PCR反应体系
基础 PCR 反应体系(20 μL):10×PCR 缓冲液2 μL, 10 mmol·L-1dNTP 0.6 μL, 25 mmol·L-1MgCl21.5 μL,Taq DNA 聚合酶(5 U·μL-1)0.1 μL,4 mmol·L-1上游引物 1 μL,4 mmol·L-1下游引物1 μL(共4对),灭菌双蒸水 6.8 μL,DNA 模板 60 ng。
PCR扩增程序:95℃预变性5 min;94℃变性30 s,48.5℃复性45 s,72℃延伸90 s,共35个循环;72℃延伸7 min,产物4℃保存。
PCR产物检测:取PCR产物5 μL,与1 μL 6-Loading Buffer混匀,用12%的聚丙烯酰胺凝胶,在160 V电压下进行电泳,当指示剂二甲苯腈迁移至距电泳槽底部1 cm时停止电泳,用EB染色,利用凝胶成像仪判读检测结果。
1.2.3 多重PCR反应体系优化
1.2.3.1 体系成分单因素浓度梯度分析
试验设计如表3所示。
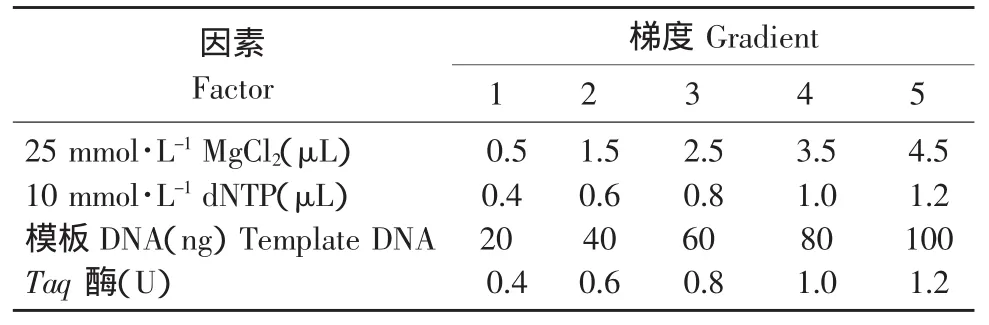
表3 单因素浓度梯度设置Table 3 Settings of monofactorial concentration gradient
选用马铃薯品种克新18作为试验品种,在不改变其他成分浓度条件下,分别对PCR反应体系的各组分进行浓度或用量梯度试验,比较不同处理对SSR标记扩增结果的影响。
1.2.3.2 引物组合正交设计
为筛选多重PCR反应中引物配比的最佳水平,采用正交设计L9(34)在4因素3水平上进行试验,设计方案见表4。

表4 多重PCR引物因素水平L9(34)正交试验设计Table 4 Monofactorial L9(34)orthogonal design of multiplex PCR primers (mmol·L-1)
1.2.3.3 PCR退火温度选择
在试验确定的最佳反应体系基础上,利用Biometra公司TGRADIENT型扩增仪对本次试验所用引物的退火温度进行优化筛选,设置退火温度为43.0~65.0℃,扩增仪自动生成12个梯度扩增。
1.2.4 体系优化前后扩增结果比较
以克新18为试验材料,比较基础反应体系与优化后反应体系扩增结果的差异,每个体系3次重复。
1.2.5 优化体系稳定性测试
使用优化体系对三个马铃薯品种(克新18、荷兰15、大西洋)进行多重PCR扩增,每个品种两次重复,考察优化体系的稳定性和一致性。
2 结果与分析
2.1 DNA提取
将提取的马铃薯DNA,各取5 μL,与1 μL 6-Loading Buffer混匀,用1%琼脂糖凝胶,在100 V电压下,电泳30 min,结果用紫外凝胶成像仪检测。从电泳结果可以看出:用Isolation Buffer提取液提取的马铃薯DNA质量好,主带唯一,无拖尾和弥散现象(见图1),3个样品的OD260/OD280值均接近于1.8,能够满足SSR标记的要求(见表5)。
2.2 多重PCR反应体系优化
2.2.1 Mg2+浓度对多重PCR体系扩增的影响
结果见图2。其中,Mg2+浓度较低时(1、2泳道),PCR扩增不完全,小分子质量的多态性条带没有出现;随着Mg2+用量的增加(3、4泳道),多态性条带数量也随之增多,扩增更加完全,条带基本覆盖整个泳道;当Mg2+用量过大时(第5泳道),300~400 bp之间的条带扩增变强,但是240 bp处条带减弱甚至消失,因此多重PCR反应体系中,Mg2+的最佳用量为2.5 μL。

表5 马铃薯DNA质量分析Table 5 Potato DNA quality analysis

图1 马铃薯DNA琼脂糖凝胶电泳Fig.1 Electrophoretogram of potato DNA

图2 Mg2+浓度对PCR体系扩增的影响Fig.2 Effect of Mg2+concerntration on PCR amplification system
2.2.2 dNTPs浓度对多重PCR体系扩增的影响
结果见图3。随着dNTPs浓度的增大,SSR标记扩增更加完全,条带数量增多,如图3中的2、3、4泳道,条带数量均多于第1泳道;当dNTPs用量为1.2 μL时(第5泳道),扩增出的特异性条带数量急剧减少,不到5条。所以,从扩增效果和节约试剂角度考虑,在多重PCR反应体系中,dNTPs的最佳用量为0.6 μL。

图3 dNTPs浓度对PCR体系扩增的影响
2.2.3 模板浓度对多重PCR体系扩增的影响
在本试验中,模板浓度设置过低或者过高时均不能得到好的扩增效果,结果见图4。其中,1、2泳道小分子质量的多态性条带基本没有扩增出来;第5泳道,条带数量相对3、4泳道少且不清晰;第4泳道扩增情况最好,多态性条带明亮并且数量丰富,当为模板首选浓度。

图4 模板浓度对PCR体系扩增的影响Fig.4 Effect of template concerntration on PCR amplification system
2.2.4 Taq酶对多重PCR体系扩增的影响
试验设定Taq酶用量为5个梯度,在试验梯度范围内,总的说来,对多态性条带的数量影响不是很大,差异不明显,但条带清晰度差异明显,在0.8和1.0 U时,条带清晰度最好,在1.2 U时,条带清晰度有减弱的趋势,基于以上分析及从节约成本的角度看,Taq酶的最佳用量为0.8 U(见图 5)。
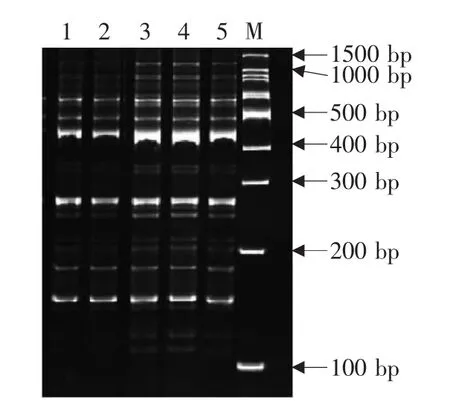
图5 Taq酶对PCR体系扩增的影响Fig.5 Effect of Taq enzyme on PCR amplification system
2.2.5 引物正交设计对多重PCR体系扩增的影响
多重PCR体系在正交设计9种组合的情况下扩增,结果见图6。只有第7、8种组合,体系扩增情况不好,泳道多态性条带数量非常少;其余几种引物组合扩增情况基本相同,条带数量多,基本覆盖了整条泳道,并且明亮、清晰,其中第4泳道的扩增状况最好,可以做为优化引物组合的首选。
2.2.6 退火温度对多重PCR体系扩增的影响
退火温度设置范围为43.0~65.0℃,扩增仪自动生成12个温度(见表6)。

图6 引物正交设计对PCR体系扩增的影响Fig.6 Impact of primer orthogonal design on PCR amplification system
PCR扩增结果见图7。在1~3的温度下,PCR扩增非常不好,只有200~500 bp的少数的几条主亮带扩增出来;在4~6的区间,条带数量稍有增加,但300~400 bp分子质量的条带没有扩增出来或者不清晰,100~200 bp之间只有亮带扩增;7~12区间,多态性条带扩增数量多,但9~12泳道在164 bp处扩增条带较弱或没有扩增;7、8泳道扩增最为完全,从节约成本的角度选择,54.7℃为最适退火温度。

表6 退火温度梯度Table 6 Gradient of annealing temperature
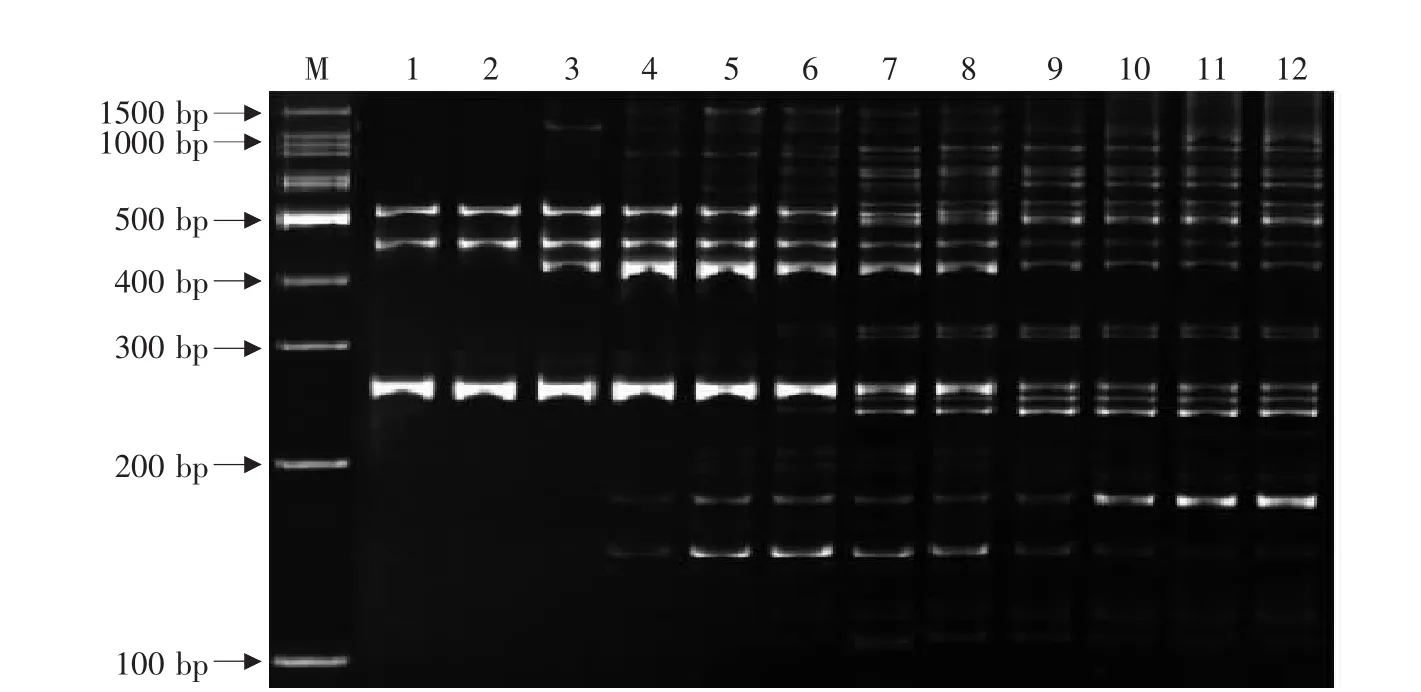
图7 退火温度梯度对PCR体系扩增的影响Fig.7 Effect of annealing temperature gradients on PCR amplification system
2.3 体系优化前后扩增结果比较
结果见图8。
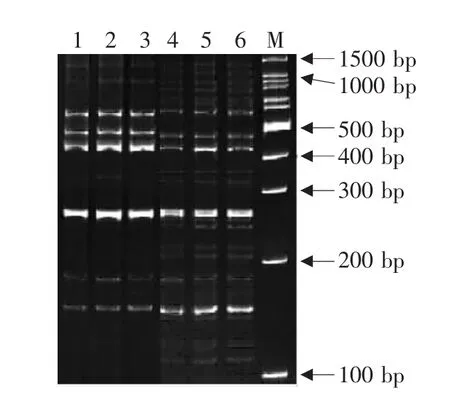
图8 体系优化前后扩增结果比较Fig.8 Comparison of amplification results before and after system optimization
以克新18为试验材料,进行体系优化前后扩增结果比较。可见,体系优化前扩增多态性条带数量少,大概为优化后体系扩增条带数量的一半,在 200、300~400、1 000~1 500 bp 之间的条带基本没有扩增(1~3泳道),优化后的体系扩增完全,条带覆盖整个泳道,增幅效果明显(4~6泳道)。
2.4 试验稳定性测试
结果见图9。
以黑龙江省马铃薯主栽品种大西洋、荷兰15、克新18为试验材料,进行多重PCR优化体系稳定性测试。从图9的电泳结果可以看出,同一马铃薯品种的2次重复扩增结果一致,组内的2个平行对照结果一致。表明所建立的SSR标记多重PCR体系扩增结果稳定,从图9中还可以看到,不同马铃薯品种之间的多态性条带数量、带型有较大差异,品种能够明显区分。

图9 试验稳定性测试Fig.9 Stability test
3 讨论
近年来,随着分子生物技术的不断发展,诞生了一系列DNA分子标记技术,SSR标记在动植物研究方面[12-13],已成为遗传连锁分析、基因定位以及指纹图谱构建等领域一个极为重要的研究手段,同时也应用到品种鉴定的研究中,给作物遗传育种带来巨大变化。
多重PCR与单一PCR相比,一次反应可以同时检测多个标记,时间短,所需试剂少,因而高效、快捷又经济;同时在灵敏度上高度特异敏感,保证了扩增结果的准确性;极大地减少了工作量,在一定程度上加速了试验进程[14]。因此,针对特定目标,开发简单、快速和有效的多重PCR体系对促进马铃薯品种纯度鉴定及建立马铃薯主栽品种指纹图谱具有重要意义。
多重PCR要求不同引物能在同一反应体系中进行特异性扩增,对于试验的条件要求相对比较严格,针对不同作物建立相适应的多重PCR反应体系,是取得试验成功的关键[10],为了保证多个目的片段在1个PCR反应中同时特异性扩增,体系优化成了构建多重组合一个必需的环节,因此体系中模板DNA的纯度和浓度、引物的质量和特异性、Taq聚合酶的用量及dNTP的浓度是对扩增结果有明显影响的几个重要因素[9]。在影响多重PCR反应的众多因素中,引物的兼容性和引物浓度的比例是其中两个核心因素[10],引物的兼容性主要原则就是避免引物内部形成发卡结构,引物及引物之间在扩增过程中产生二聚体,平衡每对引物的浓度使每个座位都能获得足够的扩增量,是优化多重PCR反应条件的关键。该过程需要反复地试验,根据电泳检测结果,选择最合适的各引物的相对比例。同时多重PCR反应尽量在同一台PCR仪或同型号的不同PCR仪上扩增,以保证试验的稳定性。
4 结论
本试验所用4对引物扩增多态性条带分布在不同的范围,避免了相互之间的拮抗作用,保证了试验的顺利进行。对多重PCR体系之中的相关影响因素逐一进行了分析,确立了马铃薯SSR标记多重PCR体系的优化模型,即总体积为 20 μL:25 mmol·L-1MgCl22.5 μL,10 mmol·L-1dNTPs 0.6 μL,Taq 酶 0.8 U,模板 DNA 80 ng,4 mmol·L-1的 4 对引物之间的用量比为2∶1∶2∶3,引物退火温度为54.7℃。优化后的反应体系重复性好,扩增结果稳定可靠,能够明显区分不同的马铃薯品种。本研究为进一步探讨马铃薯品种资源遗传多样性、构建DNA指纹图谱打下了坚实的基础。
[1]Gupta P K,Rustgi S,Sharma S,et al.Transferable EST-SSRs markers for the study of polymorphism and genetic diversity in bread wheat[J].Mol Gen Genomics,2003,270:315-323.
[2]Powell W,Machray G C,Provan J.Polymorphism revealed by simple sequence repeats[J].Trends Plant Science,1996(1):215-222.
[3]盛云燕,栾非时,陈克农,等.甜瓜SSR标记遗传多样性研究[J].东北农业大学学报,2006,37(2):165-170.
[4]杨迪菲,秦智伟,王桂玲,等.黄瓜SSR-PCR反应体系的优化[J].东北农业大学学报,2006,37(5):619-623.
[5]张东,舒群,滕元文,等.中国红皮砂梨品种的SSR标记分析[J].园艺学报,2007,34(1):47-52.
[6]Chamberlain J S,Gibbs R A,Rainer J E,et al.Deletion screening of the Duchenne muscular dystrophy locus via multiplex DNA amplification[J].Nucleic Acids Research,1988,16(23):11141-11156.
[7]Ma W,Zhang W,Gale K R.Multiplex-PCR typing of high molecular weight glutenin alleles in wheat[J].Euphytica,2003,134:51-60.
[8]Henegariu O,Heerema N A,Dlouhy S R,et al.Multiplex PCR:critical parameters and step-by-step protocol[J].Biotechniques,1997,3(3):504-511.
[9]Markoulatos P,Siafakas N,Moncany M.Multiplex polymerase chain reaction:A practical approach[J].Journal of Clinical Laboratory Analysis,2002,16(1):47-51.
[10]Schoske R,Vallone P M,Ruitberg C M,et al.Multiplex PCR design strategy used for the simultaneous amplification of 10 Y chromosome short tandem repeat(STR)loci[J].Analytical and Bioanalytical Chemistry,2003,375(3):333-343.
[11]Shuber A P,Grondin V J,Klinger K W.A simplified procedure for developing multiplex PCRs[J].Genome Research,1995,5(5):488-493.
[12]Weissenbach J,Gyapay G,Dib C.A second-generation linkage map of the human genome[J].Nature,1992,359:794-801.
[13]Gupta P K,Varshney R K.The development and use of microsatellite markers for genetic analysis and plant breeding with emphasis on bread wheat[J].Euphytica,2000,113(3):163-185.
[14]Nakamura T,Vrinten P,Saito M,et al.Rapid classification of partial waxy wheat using PCR-based markers[J].Genome,2002,45:1150-1156.
