大豆皂甙含量的QTL分析
2010-07-09宋雯雯高慕娟杨继学王继安
田 俊,宋雯雯,韩 雪,高慕娟,杨继学,王继安
(大豆生物学教育部重点实验室,东北农业大学农学院,哈尔滨 150030)
大豆皂甙(Soyasaponin)是大豆中存在的一类具有较强生物活性的物质,具有较多对人体有益的生理功能,被广泛的应用于食品加工、医药等方面。但由于大豆皂甙的溶血作用以及对人体粘膜有强烈的刺激作用,也被认为是造成大豆制品带苦涩味的来源,所以在大豆制品中人们都尽量将其除去,但是随着对大豆皂甙的多种有利的生理功能的发现和重新评价,对它的研究逐渐走向热门。国内外已有很多大豆深加工企业建立生产线从大豆籽粒中连续提取皂甙和其他大豆生物活性物质,这使得市场上对优质特种大豆的原料需求增加。然而,目前对于大豆皂甙的结构、性质、功效、机理等方面的研究报道较多,而对于大豆皂甙专用品种的选育方面的研究较少[1-4]。
本研究分析了大豆杂交后代皂甙含量的遗传变异规律,利用SSR分子标记技术,研究与皂甙含量相关的QTLs,为利用分子辅助手段培育高皂甙含量大豆品种奠定了基础。
1 材料与方法
1.1 材料
选用大豆皂甙含量高的亲本哈91016(♀)和大豆皂甙含量低的亲本N98-9445A(♂)及二者杂交所得的F2群体中随机抽取的198个样本材料。亲本于2008年种植于东北农业大学香坊实验实习基地。
1.2 方法
1.2.1 大豆皂甙含量测定
本试验采用大豆皂甙的甙元类似物齐墩果酸作为标准品的比色法测定大豆皂甙的含量[5]。最佳测定条件:粉碎样品过60目筛,有机溶剂脱脂后加入70%乙醇水溶液,70℃水浴加热浸提3.5 h、过滤重复1次,取滤液于40℃旋转挥发回收乙醇得皂甙粗提液,再用饱和正丁醇萃取过夜,分离正丁醇相,减压浓缩呈褐色粘稠状,加甲醇溶解定容至10 mL,吸取样品50 μL进行上述香草醛-高氯酸显色反应,紫外分光光度计测定最大吸收值[5]。
1.2.2 叶片总DNA的提取
采用改进的CTAB法提取叶片总DNA[6]。
1.2.3 SSR反应
SSR引物来源:根据SoyBase提供的SSR引物序列,由上海博亚生物技术有限公司合成。
PCR反应体系:反应总体积为20 μL。反应液包括2 μL模板DNA(25 ng·μL-1),12.5 μL PCR水,2 μL Buffer,1.5 μL SSR引物(10 mg·μL-1),1.5 μL dNTP(10 mmol·L-1),0.5 μL Taq酶(5 U·μL-1),液体石蜡覆盖。
PCR扩增条件:反应在PTC-100TMPeltiter thermal cycle热循环仪中进行,95℃预变性5 min,然后进入循环:94℃变性30 s,47℃复性30 s,72℃延伸30 s,35个循环后72℃延伸5 min。产物置于4℃下保存。将PCR反应后的SSR材料每管加上8 μL Loading Buffer,置于PCR仪中95℃变性10 min后取出,放入冰水混合物中冷却。冷却后放入4℃冰箱内保存,待用。PCR产物以6%聚丙烯酰胺凝胶测序胶为介质,以1×TBE为缓冲液,在100 W恒定功率下电泳约50 min,银染检测。电泳仪采用Biorad垂直电泳仪,上样量为8~10 μL。
1.2.4 数据处理与分析
将各单株的带型和亲本相应位点的带型进行比较,与母本类型条带相同的个体记为“A”,与父本类型条带相同的个体记为“B”,杂合型记为“H”,缺失的记为“-”。
利用Mapmaker/EXP3.0b软件进行连锁分析,用Mapchart2.1作图软件构建分子标记连锁图谱,QTL分析采用WinQTLCartographer v2.0[7]。
2 结果与分析
2.1 F2群体中皂甙含量的遗传分布
本试验对高皂甙含量亲本哈91016(♀)、低皂甙含量亲本N98-9445A(♂)以及在衍生的F2群体中随机抽取的198个样本进行皂甙含量的测定,后代群体的皂甙含量多数介于双亲之间,少数存在超亲现象。其中最大值达到17.8 mg·g-1,大于母本哈91016(13.6 mg·g-1),表现正向超亲的占13.9%,而最小值为 6.7 mg·g-1,小于父本 N98-9445A(8.7 mg·g-1),表现负向超亲的占5.2%,说明F2群体皂甙含量具有丰富的遗传变异。现将上述F2代群体的皂甙含量数据进行统计分析,频率分布见图1,并用SPSS 13.0程序进行正态检验。结果表明,F2代单株皂甙含量为连续变异,且基本符合正态分布,其偏度为-0.544,峰度为0.52。
2.2 SSR遗传图谱的构建
根据对大豆公共遗传连锁图谱的分析,选择基本覆盖大豆全基因组的500对SSR引物,用于在亲本哈91016(♀)和N98-9445A(♂)间进行引物多态性筛选。对这500对SSR引物进行PCR扩增,聚丙烯酰胺凝胶电泳检测,有112对引物具有多态性,多态性引物频率为22.4%。将112对SSR引物逐一在F2群体中进行PCR扩增并进行聚丙烯酰胺凝胶电泳检测,有106对多态性引物在198个F2群体中扩增出多态性良好、清晰的、稳定的产物,多态性比率为21.2%。
用106个SSR标记鉴定群体染色体组成情况,其中来自哈91016(♀)的染色体片段占整个群体组成的24.36%,来自N98-9445A(♂)的染色体片段占群体染色体组成的23.28%,来自哈91016(♀)和N98-9445A(♂)的杂合片段占群体染色体组成的 44.36%,经卡方检验(χ20.05,2=5.52;χ20.01,2=8.67),三者符合期望比率。表明该群体遗传结构合理,适合遗传图谱构建和研究。
进一步对这些位点的基因组成进行χ2检测,其中有61%的SSR标记在群体中符合理论分离比例,39%的标记呈现偏分离的趋势,但这些标记对于构建遗传连锁图谱和进行QTL扫描都是比较可靠的。分离群体中标记的偏分离现象普遍存在,与已有的报道相比,本研究中群体的偏分离标记比例较高。
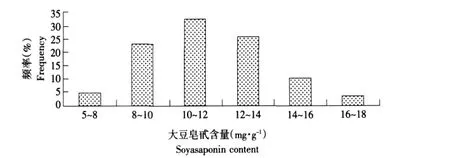
图1 F2代群体表型分布频率Fig.1 Frequency of phenotype distribution of F2population
将筛选得到的106对多态性SSR标记用于连锁分析,通过Mapmaker/EXP 3.0b构建连锁图谱,其中有87个SSR Marker被分配到1999年Cregan定义的20条染色体中的17条上。这87个SSR分子标记总长约为1 684.3 cM,分子标记间的平均距离为19.36 cM,标记在连锁群上的分布是不均匀的,最多的是MLG K和MLG D1b连锁群,各有10个标记,最少的是MLG A1和MLG E连锁群,各有2个标记。MLG C2连锁群最长,为139.6 cM,MLG J连锁群最短,为14.9 cM。标记间大于10 cM的区段较普遍,可能与连锁群不同部位发生交换的几率不等,或双亲在这些连锁群区段遗传差异巨大有关,有待于进一步在间隙区寻找新的标记,以减小图距,使遗传图谱更加饱和[8-10]。
2.3 与大豆皂甙含量相关的QTL分析
本研究利用复合区间法检测与大豆皂甙含量有关的QTL,当LOD值大于2.0时,经过WinQTL Cartographer v2.0计算共鉴定出2个与大豆皂甙含量相关的QTL(见图2),Qts1位于K连锁群上,标记区间为Sat_044~Satt102,与SSR标记Sat_044的遗传距离是4.6 cM,LOD值2.09,遗传贡献率为12.6%,加性效应为正值(1.60),Qts2位于D1a连锁群上,标记区间为Sat_036~Satt580,与SSR标记Satt580的遗传距离是8.9 cM,LOD值2.87,遗传贡献率为15.8%;加性效应为正值(1.14),表明它的作用方向是增强皂甙含量的作用(见表1)。

图2 与大豆皂甙含量相关的QTL定位图谱Fig.2 Mapping QTLs associated with soyasaponin content
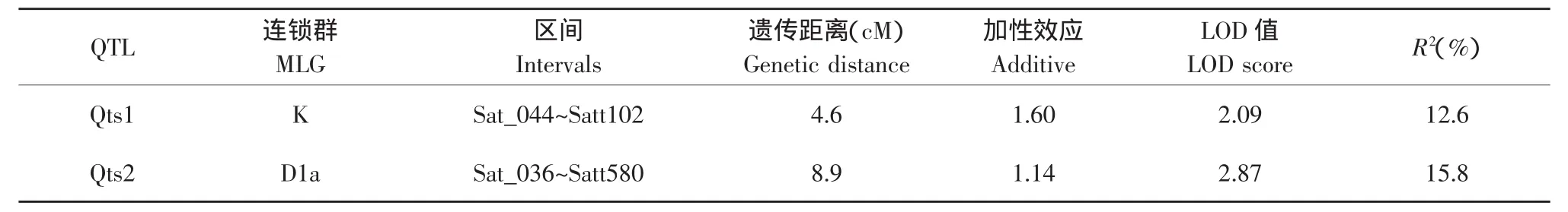
表1 与大豆皂甙含量相关的QTLsTable 1 QTLs associated with soyasaponin content
3 讨论
选择合适的双亲材料是创建理想作图群体的关键之一。本研究所用的组合是高皂甙含量品种哈91016(13.6 mg·g-1)和低皂甙含量品种 N98-9445A(8.7 mg·g-1)进行杂交所衍生的 F2代群体。F2代皂甙含量高中低分布合理,群体单株的皂甙含量变异范围较大。正态性验证结果表明,该群体皂甙分布偏度为-0.54,所以F2代群体皂甙含量趋于正态分布,来自哈91016(♀)的基因片段占整个群体基因组成的24.36%,来自N98-9445A(♂)的基因片段占群体基因组成的23.28%,来自哈91016(♀)和N98-9445A(♂)的杂合基因片段占群体基因组成的44.36%,经卡方检验(χ20.05,2=5.52;χ20.01,2=8.67),三者符合期望比率。表明该群体遗传结构合理,是适合品质性状作图群体。目前,对于大豆皂甙的结构、性质、功效、机理等方面的研究报道较多,而对于大豆皂甙含量的分子标记方面的研究较少。尤其在国内对于这方面的研究还处在初级阶段。由于亲本材料、定位群体的不同,难以对两者作进一步的比较[11]。
4 结论
本试验表明,大豆皂甙含量为多基因控制的数量性状遗传。本研究中得到2个与大豆皂甙含量相关的QTL,即:Qts1位于K连锁群上,标记区间为Sat_044~Satt102,与SSR标记Sat_044的遗传距离是4.6 cM,LOD值2.09,遗传贡献率为12.6%;Qts2位于D1a连锁群上,标记区间为Sat_036~Satt580,与SSR标记Satt580的遗传距离是 8.9 cM,LOD值2.87,遗传贡献率为15.8%。
[1]陈学珍,杨建宇,李欣,等.大豆营养与人体健康[J].食品科技,2004(4):5-7.
[2]崔洪斌.大豆生物活性物质的开发与应用[M].北京:科学出版社,2001:114-115.
[3]黄贤校,谷克仁.大豆皂甙研究进展[J].粮食与油脂,2006(3):9-12.
[4]王章存,刘卫东.大豆皂甙-具有研究开发价值的天然活性物质[J].食品科学,1995,16(2):3-4.
[5]闫子鹏,薛锦锋.紫外分光光度计测定大豆中总皂甙的方法[J].大豆通报,2005(2):28-29.
[6]王珍,方宣钧.植物DNA分离[M].分子植物育种,2003,1(2):281-288.
[7]Wan G L,Paterson A H.Assessment of DNA pooling strategies for mapping of QTLs[J].Theor Appl Genet,1994,88:355-361.
[9]张立容.SSR和ISSR分子标记及其在植物遗传育种研究中的应用[J].河北农业大学学报,2002,25(1):90-94.
[10]李一丹,齐东来,高继国.大豆QTLs研究进展[J].东北农业大学学报,2005,36(1):95-98.
[11]Chung J E,Babka H L,Greaf G L,et al.The seed protein oil and yield QTL on soybean linkage group[J].Crop Sci,2003,43(3):1053-1067.
