肾性高血压大鼠模型制作的改良方法
2010-07-08曹珊珊李瑞芳方伟进王建刚杜景霞黄国辉
曹珊珊,李瑞芳,方伟进,李 艳,王建刚,杜景霞,黄国辉
目前,国内外常利用犬、大鼠、兔等动物制作高血压模型,其中肾动脉狭窄性高血压模型由于简便可靠被广泛应用于人类高血压及并发症的研究。肾血管性高血压(reno vascular hypertension, RVH)是指单侧或双侧肾动脉的主干或其分支狭窄,使肾血流量减少,导致肾缺血引起的高血压,为继发性高血压最为常见的病因。 RVH模型是高血压发病机制研究和药物评价的常用动物模型,我们通过摸索,对现有的双肾双夹(two kidneys two clips, 2K 2C)高血压模型制作方法进行了改良,获得了理想的成模率,同时减少了实验并发症的发生。
1 材料和方法
1.1 药品及仪器戊巴比妥纳(中国医药上海化学试剂公司);钛合金制“U”型夹(郑州),规格:内径0.3 mm;手术丝线, 规格(5/0);青霉素G(华北制药),规格80万U/瓶;红霉素软膏;75%酒精;生理盐水;BP-6无创动物血压测试仪(四川);BL-420生物机能实验测试仪(上海)。
1.2 实验动物及分组成年健康雄性SD大鼠94只(体质量100±10 g,由河南科技大学医学院实验动物中心提供),随机分为假手术组(20 只)和模型组(74只)。大鼠分笼饲养于室温18 ~25℃,日照12 h,相对湿度45%~55%,通风良好的环境中,饲喂普通饲料,自由饮水。
1.3RVH的模型制作腹腔注射1 %戊巴比妥纳溶液(35 mg/kg),麻醉SD大鼠, 15 ~20 min后大鼠即被麻醉。俯卧位固定备皮消毒后,于第3腰椎棘突水平沿背部后正中线切开皮肤3 ~4 cm,用棉签钝性分离双侧皮下浅筋膜,狭窄左肾动脉时,于约第十二胸椎水平距棘突旁约1.5 cm处用直剪剪开肌腱、腹膜进入腹腔,用棉签沾生理盐水后入腹腔探测肾脏位置,根据肾门的具体位置沿棘突方向扩大手术开口直至肾脏及肾门清晰地暴露于视野下。左肾动静脉包裹在一个血管鞘中,通常情况下左肾动脉位于深静脉的上后方(偶尔会出现在肾静脉下方或横跨在肾静脉的上方),可用湿润生理盐水的棉签拨开肾静脉,再用无齿小弯镊在动静脉之间小心分离,分离出左肾动脉约0.5 cm,将一内径为0.3 mm的钛合金夹呈水平方向套在左肾动脉上,务必使左肾动脉全部落入钛合金夹顶部的圆形小孔内,再用小直镊夹闭两脚,以狭窄后左肾颜色变为“浅红色”为宜。向腹腔内注入青霉素G 4万U,关闭腹腔开口。狭窄右肾动脉时,手术开口较左肾开口处高约1 cm,暴露右肾及右肾蒂,右肾动脉位置变异少,且与右肾静脉相距稍远,较左肾动脉易于分离。在下腔静脉和腹主动脉之间与右肾水平线相交处分开腹膜后壁,即见右肾动脉,分离狭窄右肾动脉,具体方法同左肾动脉。多数情况下肉眼可见右肾动脉直径较左肾动脉大,故钛合金夹直径的选择上亦可以视具体情况进行调整,本研究常用0.3 ~0.35 mm内径钛合金夹狭窄右肾动脉,亦以狭窄后右肾颜色变为“浅红色”为宜。后注入青霉素G 4万U,关闭右侧腹腔。双肾动脉狭窄都完毕后,行腹腔、肌层全层连续缝合,再注入青霉素G 4万U后,间断缝合皮肤,用碘伏再次消毒皮肤缝合口,去除血迹,对皮,涂上红霉素软膏,手术完成。假手术组仅游离左、右肾动脉,不予狭窄,其余过程同手术组。待动物苏醒后,放入单笼饲养,注意保持呼吸道通畅,用100 W白炽灯距离60 cm照8 h以保温,术后禁食24 h,但不禁水,术后3 d密切观察皮肤切口,精神状态及进食进水情况。于术后3 d开始每天注射青霉素G 8万U,共5 d。
1.4 血压测量无创血压测量:采用BP-6无创动物血压测试仪测定大鼠清醒状态下尾动脉血压。将大鼠置于仪器配套的固定笼中,置30℃恒温箱预热15 min,待大鼠完全安静后将鼠尾套袖放置于鼠尾的根部,套袖以约20 ~30 mmHg/s的速度自动充气加压直至脉搏波消失,维持6 s后套袖自动放气,出现的第1个血压波即为收缩压。连续测量至少3 次,每次测量间隔一定时间, 记录心率(HR≤10 次/min)、血压(BP≤6 mmHg)的3次读数,取其均数为当天收缩压值,以此法测量大鼠术前血压,每周测压1次,进行血压的动态观察。有创血压测量:各组动物在观察期满后用1%的戊巴比妥钠(35 mg/kg)腹腔麻醉,导管内充满肝素,右颈总动脉逆行插管至左心室,另一端接BL-420生物机能实验系统(成都泰盟科技有限公司),导管口在右颈动脉内时,连续记录血压5 min。取平稳的一段血压曲线记录主动脉收缩压和舒张压(AOSP, AODP)进入左心室后测左室收缩末压和左室舒张末压(LVESP, LVEDP),室内压最大上升和下降速率(±dP/dtmax)和心率(HR)。
1.5 高血压模型成功的标准血压在 85 ~120 mmHg范围为正常血压大鼠,以2K2C手术4周后动物血压明显升高超过自身术前血压30 mmHg以上,且解剖后双肾无坏死,萎缩或纤维化为模型复制成功;术后血压无明显升高或死亡者为失败。
1.6 左心室质量指数的测定试验结束时,大鼠插管测压后,开胸取出心脏,置于预冷的生理盐水中,滤纸吸干后称心脏重量(HW)。沿房室环剪去左、右心房及右心室游离壁,用电子天平称取左心室(包括室间隔)重量(LVW),并与体重(BW)相除,计算左心室质量指数(LVMI)。
1.7 统计学处理所有数据均应用SPSS13.0统计软件处理,结果以±s表示,组间比较采用t检验, P<0.05为差异有统计学意义。
2 结果
2.1 模型成活率本实验共使用94只大鼠进行造模,假手术组(n=20), 2K2C组(n=74);研究观测直至6周末,经检测, 82只大鼠成活,模型成活率为87%。 2只麻醉过浅术中挣扎出血死亡, 4只麻醉过深术后未苏醒,麻醉死亡占6.4%;2只术后1 h内死亡,多考虑是急性肾功能衰竭,占2.1%;4只于术后1周内感染死亡,占4.3%。术后6 周有4只血压上升小于30 mmHg,模型成功率为83%。见表1。

表1 实验大鼠成活、成模情况
2.2 血压升高情况术前我们用无创血压仪对大鼠进行测压,选取血压小于120 mmHg的大鼠为实验对象,术后6周,经颈总动脉插管有创测压,假手术组的血压和术前相比无显著差异,实验组血压明显上升, 6周末维持在165 mmHg左右,并趋于稳定,血压和心功能见表2。
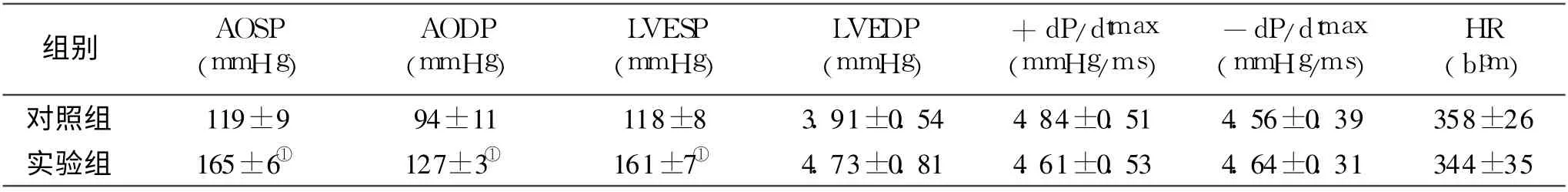
表2 术后6周大鼠血压及心功能变化情况
2.3 右心室质量指数从表3可以看出,实验组-6周与对照组-6周组相比,体重无显著差异(P>0.05),左心室重(LVW)、左心室重/体重(LVW/BW)显著增加(P<0.01)。

表3 体重和左心室质量指数
3 讨论
肾动脉狭窄性高血压模型是应用广泛的高血压动物模型,复制方法主要有几种, 1K1C(一侧肾动脉狭窄,另一侧肾切除), 2K1C(一侧肾动脉狭窄,另一侧肾保留),和2K2C(双肾动脉均狭窄)。狭窄肾动脉的方法众多,或用套管、或用U型银夹、或用有机玻璃夹、或用丝线结扎、或用自制铝夹等方法[1]。套管法在体型较大的动物如狗等效果明显,但小型动物不易开展;U型银夹套入血管后需用眼科镊夹闭两脚,致使肾动脉狭窄程度不易控制,易造成急性肾功能衰竭;有机玻璃夹亦需特殊的工具研制;而丝线结扎的效果不太稳定。采用背部开口,因为肾脏是腹膜后器官,与腹部开口相比,在手术过程中不需将肠管、腹腔脏器翻出腹腔,避免损伤肝脏、乳糜池、腹腔内血管,同时可以避免由于肠管复位错乱造成术后肠扭转或肠梗阻。术后伤口愈合较腹部开口快,采用的钛合金夹在体内不会被氧化,实验结束后可回收反复利用,节约了实验成本。
关于2K2C法成功复制RVH模型,应注意以下几点:①麻醉:麻醉深度对于模型的制作亦很重要。麻醉过深,术后苏醒较慢,甚至死亡。本研究中4 例大鼠死于麻醉过度;麻醉过浅动物挣扎则易出现出血、腹脏器损伤、拖延手术时间,试验中2例大鼠因麻醉较浅,出现上述情况致肾静脉大出血。虽然麻醉剂有一定的合适剂量范围,由于不同批次大鼠体质不同,产生麻醉的效果也不同。因此在每次大规模实验前均必须摸索适宜的麻醉剂的剂量。 ②钝性分离,减少出血,筋膜剥离需干净。虽然模型制作简单,术后的出血和感染仍是手术最为常见的并发症。初学模型制作时,术后出血是大鼠死亡最常见的原因。由于肾动、静脉紧贴伴行,因此,钝性分离动静脉之间的筋膜时,需拨开静脉,避免损伤静脉,减少和避免术后出血是模型成功制作的关键[2]。本研究中有2例大鼠死于肾功能衰竭,分离肾动脉时,必须注意筋膜是否分离干净,上夹后夹子能否沿动脉滑动,已证实肾素—血管张素系统是肾血管性高血压大鼠肾功能衰竭的重要原因[3]。 ③避免牵拉,缩短手术时间。双肾上夹应在5 min内完成。另外,熟练的操作可避免由于肾血管的反复牵拉致肾脏长期缺血或淤血,操作时间过长易引起的感染,在我们的研究中发现这些因素均与术后死亡有关。④避免手术感染。研究发现,相当部分的大鼠死亡发生于术后1个月,术后感染是常见原因,所以严格、细致的管理也是模型成功的重要方面。保持饲养房空气流通和适宜的温度最为重要,一般饲养区内温度必须保持在19 ~29 ℃[4,5]。我们在术前用硫化钠对大鼠背部进行褪毛备皮,避免术中鼠毛掉至腹腔中,术中每侧夹子安放完毕都腹腔给予少量青霉素G,术后再连续5 d腹腔注射青霉素G,都是为了避免因感染造成的死亡。我们动态观察了实验组术后血压的变化,结果术后2周血压即明显升高,超过自身基础血压30 mmHg以上, 6周时已经能够形成稳定高血压,血压值维持在165 mmHg范围,模型复制成功率为83%,与文献报道相近,说明我们的模型制作方法可行。
[1] 王东,蒋湘莲, 聂亚雄.高血压大鼠模型的研究进展[J].中国动脉硬化杂志, 2006, 14(3):271-276.
[2] 施新猷.现代医学实验动物学[M].北京:人民军医出版社,2000:348-487.
[3] Abd i A, Johns E J.Importance of the renin-angiotensin systemin the generation of kidney failure in reno vascular hypertension[J].JHypertens, 1996, 14:1131-1137.
[4] Capon A, Demeurisse G, Zhang L.Seasonal variation of cerebral hemorrhage in 236 consecutive cases in Brussels[J].Stroke,1992, 23:24-27.
[5] 黄如训,肖小华,李玲.气象因素促发卒中的实验研究[J].中华老年医学杂志, 2001, 20:66-68.
