阻塞性睡眠呼吸暂停低通气综合征与血清 Cu、Fe、Zn元素的观察
2010-07-06西安交通大学医学院第二附属医院耳鼻喉科西安710004葛丽荞康全清郑国玺
西安交通大学医学院第二附属医院耳鼻喉科(西安 710004)葛丽荞 侯 瑾 康全清 郑国玺
阻塞性睡眠呼吸暂停低通气综合征(Obstructivesleep apnea-hypopnea syndrome,OSAHS)是指睡眠时上气道塌陷阻塞引起的呼吸暂停和通气不足,伴有打鼾、睡眠结构紊乱,频发血氧饱和度下降、白天嗜睡等症状,是一种发病率高、严重影响生活和危及生命的疾病[1],是高血压、冠状动脉粥样硬化性心脏病 (冠心病)、肺源性心脏病 (肺心病)和脑卒中等心脑血管疾病的独立危险因素[2]。目前认为,OSAHS的病因复杂,为探讨机体内微量元素与OSAHS的关系,我们检测血清中锌、铜和铁的含量,现将结果、分析报告如下。
资料与方法
1 临床资料 OSAHS组:选择 2008年 11月~2009年 4月于西安交通大学医学院第二附属医院耳鼻咽喉-头颈外科收治的 OSAHS患者 28例,其中男 23例,女5例,年龄 40.39±11.84岁。均符合《阻塞性睡眠呼吸暂停低通气综合征诊治指南》[3]诊断标准;对照组:系年龄相匹配的 9例非肥胖者,均同期来源于我科因慢性扁桃体炎就诊择期行扁桃体摘除术患者,通过询问近亲属,排除睡眠时打鼾患者;其中男 6例,女 3例,年龄 42.56±16.93岁。所有受试者通过询问病史和全面查体除外肝、肾、神经肌肉疾患,各种急性感染,自身免疫性疾病,肿瘤,糖尿病等疾病。两组对象检查前 3个月均无微量元素药物补充史,年龄及性别比较无统计学差异。两组患者均在我科睡眠监测中心接受多导睡眠监测(PSG)。根据睡眠呼吸暂停低通气指数(Apnea hypopnea lndex,AHl)(AHI< 5为正常、5~20为轻度、21~ 40为中度、≥ 41为重度 OSAHS)和体重指数(Body mass lndex,BMI)分为三组:肥胖的轻度OSAHS 4例、肥胖的中度 OSAHS 7例、肥胖的重度OSAHS 17例。(肥胖症的定义根据2000年亚太地区成年人肥胖的分类标准,BMI≥25 μ g/m2者为肥胖)。
2 方 法
2.1 PSG检查:两组均在我科睡眠监测中心接受多导睡眠监测 (PSG)(PM21∶ 00~ AM7∶00)。以澳大利亚Copumedicsp公司生产的 Plus型多导睡眠监测系统,检测患者以下参数指标:脑电图(EEG)、眼动图(Electrooculugram, EOG )、 肌 电 图(Electromyogram,EM G)、口鼻呼吸、胸、腹式运动、腿动、心电图 /心率、脉搏、血氧饱和(SaO2)。各项参数经计算机处理进行测量分析,并打印结果。主要的监测指标有:呼吸紊乱指数(AHI),最低血氧饱和度(Lowest oxyhemoglobin saturation,LSO),平均血氧饱和度(Mean oxyhemoglobin saturation,MSO),SaO2<85%的时间。检测当天禁饮酒、咖啡及服镇静剂、催眠药。
2.2 物理检查:受试者免冠、脱鞋,测量身高(m)、体重 (kg),计算体重指数 (BMl)= 体重 (kg)/身高(m2)。
2.3 标本收集:所有研究对象,均于清晨抽取空腹肘静脉血检测血糖、血脂、肝功、肾功;同时取血 0.5ml,置于肝素抗凝试管中,摇匀,存放于 4℃冰箱中保存待用。检测时分别取全血40 μ l以BH5100s/T型原子吸收光谱仪专用稀释液稀释,混匀后用博晖五元素分析仪检测。检测方法:用火焰原子吸收分光光度法,标准曲线及数据均由仪器微机处理,并自动打印。均由我医院检验科承担。
3 统计学处理 结果经 SPSS11.0统计软件处理,所有数据的描述以均值±标准差(x-±s)表示,组间差异的显著性检验采用t检验和方差分析,多组间的两两比较采用方差分析中的LSD法。同一组别不同参数之间的相关分析采用直线相关分析。检验水准取0.05。
结 果
本次实验所测得对照组及OSAHS组共 37例,数据显示 OSAHS各组之 BMI均值均大于 25μ g/m2,即各组均属肥胖者;轻度、中度、重度OSAHS组与对照组比较,呼吸紊乱指数(AHI)均值均高于对照组,最低SaO2水平均值均低于对照组,差异均有显著性(P<0.05)。轻度、中度、重度OSAHS组间比较:呼吸紊乱指数(AHI)均值轻度组、中度组、重度组依次升高,与对照组比较均有统计学意义(P<0.05);最低 SaO2均值轻度组、中度组、重度组依次降低,其中轻度组和中度组、轻度组和重度组之间有统计学意义(P<0.05),重度组和中度组无统计学意义,;OSAHS组血清 Cu含量均值轻度组、中度组、重度组依次降低,其中重度组铜含量的均值明显低于对照组(P<0.05),轻度组和中度组、重度组和中度组、轻度组和重度组无统计学意义;OSAHS组血清 Zn、Fe含量均值与对照组比较无统计学意义(P>0.05),其组间比较无差异 (P> 0.05)。
各组临床资料及 PSG监测结果分析,见表 1。OSAHS组与对照组血清微量元素检测结果分析,见表2。
表1 OSAHS组与对照组 PSG监测分析(±s)
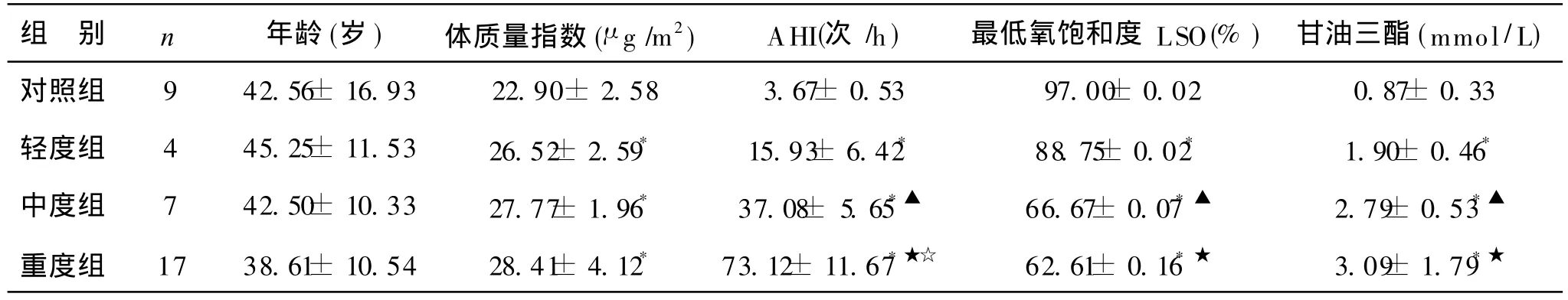
表1 OSAHS组与对照组 PSG监测分析(±s)
注:*OSAHS各组与对照组比较,P<0.05;▲ OSAHS轻度组与中度组比较,P<0.05;★ OSAHS轻度组与重度组比较,P<0.05;☆ O SAHS中度组与重度组比较,P<0.05
组 别 n 年龄(岁)体质量指数(μ g/m2)AHI(次 /h)最低氧饱和度 LSO(%)甘油三酯(mmol/L)对照组 9 42.56± 16.93 22.90± 2.58 3.67± 0.53 97.00± 0.02 0.87± 0.33轻度组 4 45.25± 11.53 26.52± 2.59* 15.93± 6.42* 88.75± 0.02* 1.90± 0.46*中度组 7 42.50±10.33 27.77±1.96* 37.08± 5.65*▲ 66.67±0.07*▲ 2.79±0.53*▲重度组 17 38.61±10.54 28.41±4.12* 73.12±11.67*★☆ 62.61±0.16*★ 3.09±1.79*★
表2 OSAHS组与对照组血清微量元素检测结果分析(±s)
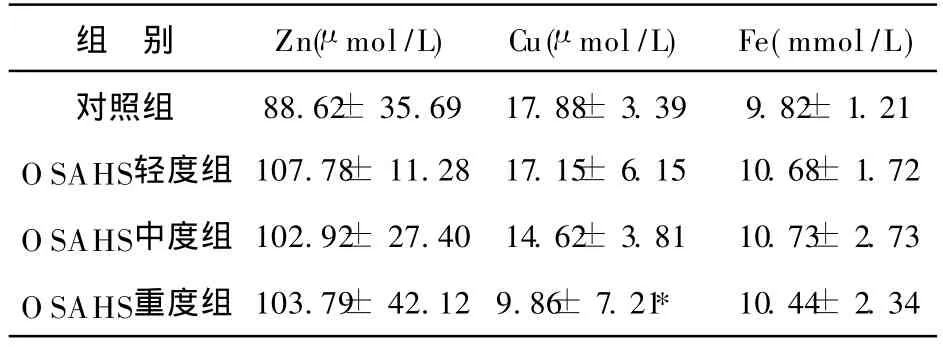
表2 OSAHS组与对照组血清微量元素检测结果分析(±s)
注:*与对照组比较,P<0.05
组 别 Zn(μ mol/L)Cu(μ mol/L)Fe(mmol/L)对照组 88.62± 35.69 17.88± 3.39 9.82± 1.21 O SAHS轻度组 107.78± 11.28 17.15± 6.15 10.68± 1.72 O SAHS中度组 102.92± 27.40 14.62± 3.81 10.73± 2.73 O SAHS重度组 103.79± 42.12 9.86± 7.21* 10.44± 2.34
OSAHS组血清 Cu、 Zn、Fe含量与 AHI进行相关分析:结果显示,血清Cu与 AHI呈负相关,相关系数 r=-0.489(P<0.01),说明呼吸暂停的次数与微量元素Cu的改变密切相关。 OSAHS组 Zn、Fe与 AHI、最低SaO2无相关性(P> 0.05)。
OSAHS组血清 Cu、Zn、Fe含量与甘油三酯进行相关分析:结果显示,血清 Cu、Zn、Fe与甘油三酯无相关性(P> 0.05)。
OSAHS组甘油三酯与 AHI进行相关分析:结果显示,甘油三酯与 AHI呈正相关,r=0.423(P<0.05),说明呼吸暂停的次数与甘油三酯的改变密切相关。
讨 论
1 血清铜含量紊乱原因分析:微量元素以酶和辅基激活剂的形式参与蛋白质、酶、激素和维生素的合成、分解与转化,与人体的心血管、免疫、内分泌等诸系统关系密切[4]。 Fe是构成体内携氧物质血红蛋白的重要成份,也是体内能量和物质代谢呼吸过程中呼吸链酶的重要成份。Cu是呼吸色素酶的重要组成成份,在能量代谢中起重要作用。 Zn与200多种酶、核酸、蛋白质的合成密切相关,能影响细胞分裂、生长和再生[5]。研究发现,OSAHS引起的夜间反复低氧血症是引起机体多种并发症主要原因。间断低氧应激状态下可以使机体内环境发生明显的变化,其中能量和酶活性的变化可能会对微量元素产生影响。
本实验测得结果表明,OSAHS组血清 Cu含量均值轻度组、中度组、重度组依次降低,其中轻度组和中度组、重度组和中度组、轻度组和重度组之间无统计学意义,OSAHA重度组血清 Cu含量的均值明显低于对照组 (P<0.05)。血清 Cu与 AHI成负相关(P<0.01),AHI与甘油三酯呈正相关(P<0.05),但血清 Cu与甘油三酯无相关性,血清 Cu与体质量指数无相关性;而可能与以下几种原因有关:
1.1 细胞色素酶的合成及消耗增多。本研究显示,血清 Cu与 AHI成负相关,AHI与甘油三酯呈正相关,但血清 Cu与甘油三酯无相关性,血清 Cu与体质量指数无相关性这说明缺铜并不直接导致高甘油三脂血症,而是随着 AHI加重,睡眠片段化、缺氧和再氧合交替出现,机体细胞在一时性的缺氧条件下为继续维持生理功能,细胞内呼吸酶的含量往往高出需要量数倍,对缺氧敏感的细胞色素酶类含量更多。这样,即使氧分压降低,呼吸链仍能进行[6]。睡眠中机体反复间断低氧,为了增强氧的传递和呼吸代偿,全身各组织细胞内细胞色素酶的合成及消耗相对较多,而使血清中铜含量降低,以供给其它主要脏器细胞能量代谢呼吸酶的合成。
1.2 低氧使机体造血功能增强。缺氧的病理状态也可导致铁代谢异常:低氧使机体造血功能增强,红细胞增多,Fe的需要量增加,而血浆铜蓝蛋白的重要作用之一是催化 Fe2+氧化成为 Fe3+,从而有利于体内储备Fe的动用和食物中 Fe的吸收[7],从而造成血清中铜含量进一步降低。
2 血清微量元素铜含量紊乱所致危害:有研究表明,血清 Cu具有很强的氧化特性[8],不仅对防止平滑肌细胞增殖及形成泡沫细胞损伤内皮细胞有重要作用[9],而且在心肌的收缩与舒张、细胞膜的结构与功能、血压调节、体内水钠平衡以及血液凝固中起着重要作用,因而铜的平衡或失调与心血管疾病的发生和发展密切相关[10]。由此,在 OSAHS合并心脑血管疾病的病理生理过程中发挥着重要作用。
本研究提示,OSAHS患者由于反复呼吸暂停,睡眠片段化、缺氧和再氧合交替出现可引起血清 Cu降低,同时 AHI加重,加重 OSAHS患者脂质代谢紊乱,促使心血管疾病的发生和发展。所以针对OSAHS重度患者补充适度的血清 Cu,也许可预防 OSAHS所引起的心、脑等并发症的发生,在临床治疗方面可以给予我们新的启示。
[1]Nowak M,Kornhuber J,Meyrer R.Daytime impairment and neurodegeneration in OSAS[J].Sleep,2006,29(12):1521-1530.
[2]McNicholas W T,Bonsigore MR.Sleep apnoea as an independent risk factor for cardiovascular disease:current evidence,basic mechanisms and research priorities[J].Eur Respir J,2007,29(1):156-178.
[3]中华医学会耳鼻咽喉科学分会,中华耳鼻咽喉科杂志编委会.阻塞性睡眠呼吸暂停低通气综合征诊断依据和疗效评定标准暨悬雍垂腭咽成形术适应证(杭州)[J].中华耳鼻咽喉科杂志,2002,37(6):403-404.
[4]周 新,涂植光.临床生物化学和生物化学检验 [M].第 3版.北京:人民卫生出版社,2003:171-1830.
[5]张忠诚,韦腾余,李汝杰,等.微量元素锌的临床应用 [J].广东微量元素科学,1997,4(6):13.
[6]Lukas J,Bartkova J,Rohde M,et al.Cyclin D1 is dispensable for G1control in retinoblastoma genedeficient cells independentlyof cdk4ac-tivity [J].Molecular Cellular Biol,1995,15(5):2600-2611.
[7]Ohlsson C,Benctsson B A,Isaksson O G,et al.Growth hormone and bon[J].Endocrinol Rev,1998,19(1):55.
[8]Thomas JP. Involvement of preexisting lipid hydroperoxides in Cu2+-stimulated oxidation of lowdensity lipoprotein[J].Arch Biochem Biophys,1994,315(2):244-54.
[9]Baird SK.Oxidized LDL tr μggers phosphatidylserine exposure in human monocyte cell lines by both caspasedependent and independent mechanisms[J].FEBS Lett,2004,578(1-2):169-174.
[10]秦俊法,潘伟清.微量元素与心血管疾病 [J].广东微量元素科学,2002,9(12):1-19.
