熵教学中的几点体会
2010-07-02吴振玉朱维菊裘灵光李村徐洪耀
吴振玉 朱维菊 裘灵光李村 徐洪耀
(安徽大学化学化工学院 安徽合肥230039)
熵教学中的几点体会
吴振玉 朱维菊 裘灵光*李村 徐洪耀
(安徽大学化学化工学院 安徽合肥230039)
结合教材、文献与教学的体会,对熵判据、温熵图和理想气体混合熵变计算等知识点作简单论述,以帮助初学热力学第二定律的学生更好地理解熵判据、温熵图的含义及其应用计算。
1 关于熵判据理解和熵判据的应用计算
教材中有关热力学第二定律的数学表达式,是以系统为研究对象得到的如下判别式[1]:
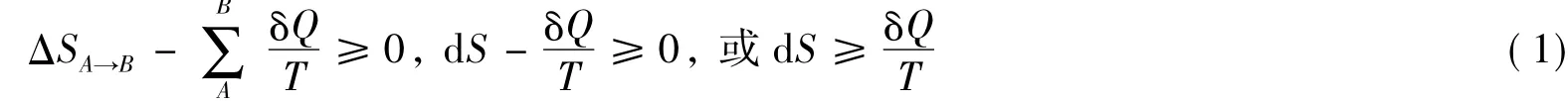


当以式(2)判断过程可逆与否时,必须将系统和环境作为一个“绝热”的整体考虑,即要同时计算体系的熵变ΔSsys和环境的熵变ΔSsur。这样,式(2)就成为:

教材中在讲到判断过程可逆性的计算时需要同时计算体系的熵变ΔSsys和环境的熵变ΔSsur。这一步的演绎是通过绝热系统推广到隔离系统,一方面,初学物理化学的学生对同时计算ΔSsys和ΔSsur不太理解,很容易忘记或不能准确地计算ΔSsur;另一方面,这里的这个“绝热”的整体即为隔离系统,这往往会使学生对绝热系统和隔离系统产生混淆,造成概念上的模糊。绝热系统和隔离系统毕竟不是等同的,这些都增加了学生对“熵”的理解难度及其应用计算。
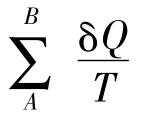
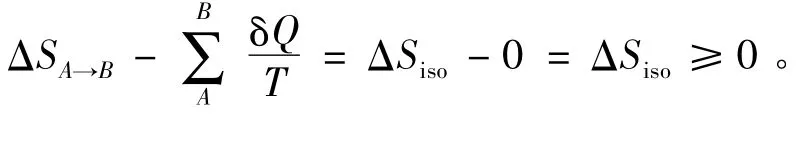
2 关于温熵图中热机效率大小的比较
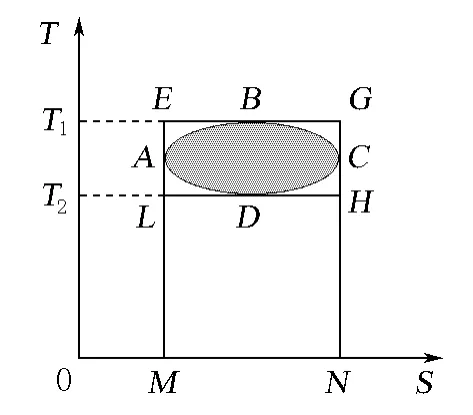
图1 热机效率图解T-S图
文献和教材[1-3]用温熵图来解释和证明热机效率的大小,以说明“任意循环的热机效率不可能大于在相同温度下所进行的Carnot循环的效率”
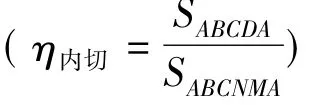
笔者尝试从以下几方面来讲解教材[1]中关于图1给出的结论。
①结合p-V图,明确T-S图的意义。与p-V图一样,T-S图中任意一点对应于系统的一个状态。在T-S图中,实线连接的过程表示可逆过程,连线下的积分面积表示过程的热效应量;右向过程系统的熵增加,系统吸热,Q为正;反之,左向过程系统的熵减少,系统放热,Q为负。但不可逆过程热效应量在T-S图中很难如在P-V图中做功量那样明确表示。在p-V图中,一闭合曲线表示一个循环,曲线所围面积为系统在整个循环的净做功量,T-S图用系统吸放热差来表示整个循环的净做功量,顺时针循环表示系统对环境做功,逆时针循环表示环境对系统做功。
②在明确T-S图意义的基础上,解释虽然η内切≠ηCarnot,但并不违背Carnot定理推论。虽然从图1不能明显看出η内切和ηCarnot的大小,但可以证明[2]:内切为任意可逆循环时,两者效率的确不同。这并不违背Carnot定理推论。因为Carnot定理推论是对同温热源与同温冷源之间工作的热机进行效率比较,不应拿内切循环时的多个高温热源的最高点T1和多个低温热源的最低点T2(如图中B和D点)作为参考点热源与仅在这两个参考点热源间工作的Carnot热机来比较。应强调Carnot定理是对工作于同温热源与同温冷源之间的热机效率的比较,这样就可以消除对图1的误解和疑问,使学生能较好地理解和应用T-S图。
3 关于理想气体混合过程的熵变计算
教材和文献[1,7-10]推导和总结归纳了理想气体混合过程熵变的各种典型计算方法。下面小于长方形代表的Carnot循环的热机效率通过实例对此做一点补充,以帮助学生更好地理解和掌握理想气体混合熵变的计算。
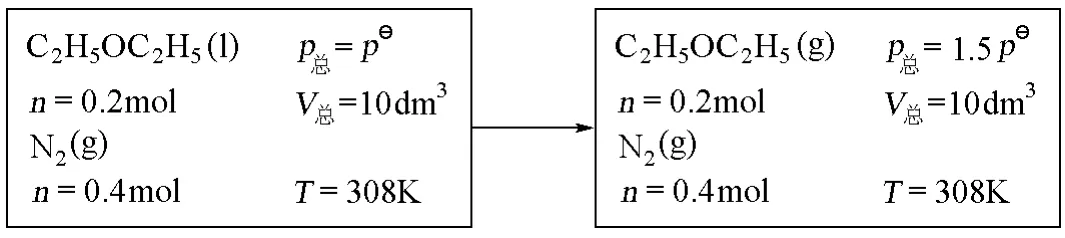
例题:今有0.2mol液体乙醚和0.4mol N2(g),在pθ、308K(乙醚的正常沸点)下存贮于一体积为0.01m3的恒容容器中,经过一等温过程后,液体乙醚全部气化,气体混合物视为理想气体。求此过程的 ΔS,并判断其自发性。已知,pθ、308K下液体乙醚的气化热为25.104kJ·mol-1(山东大学2001年研究生入学考试题)[10]。
一种能正确判断其自发性的解法如下:
此过程可以看成液体乙醚在正常沸点下等温恒压可逆相变加理想气体等温加压相变。
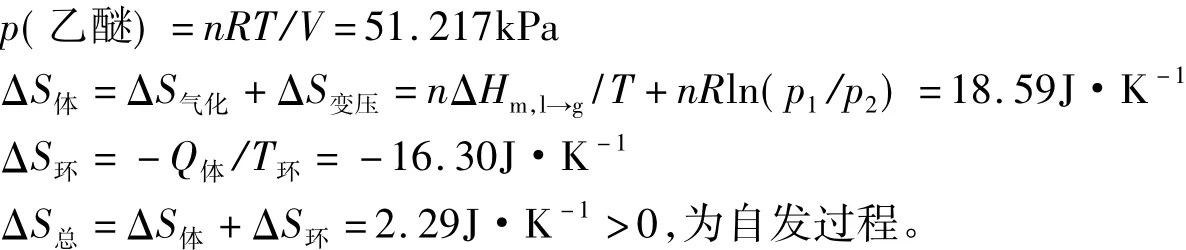
这种解法只考虑了乙醚等温等压可逆相变和压力变化引起的熵变,却没有考虑到N2(g)压力变化引起的熵变。结合教材和文献[1,6-10]关于理想气体混合熵变计算方法,本文提出如下思路作为补充。
解:该过程始终态如下:
根据始终态设计如下可逆过程求算熵变,并判断过程自发性:

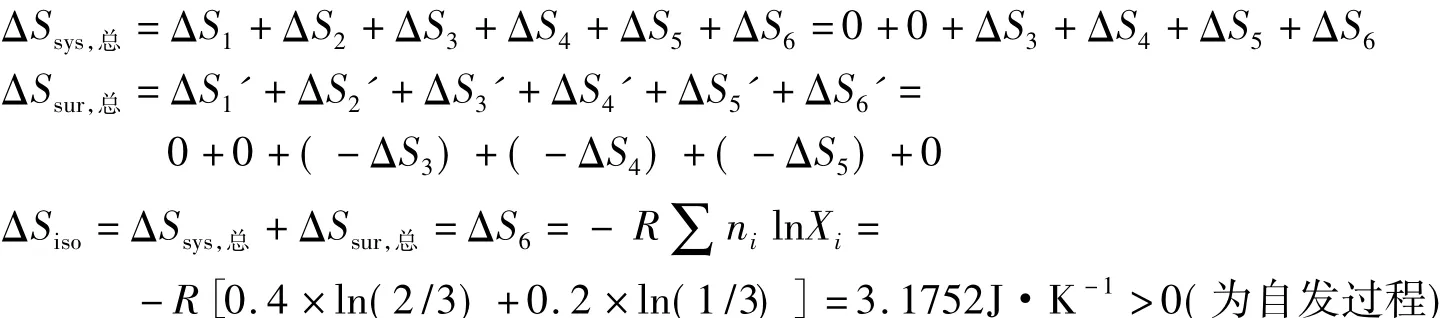
通过对以上3方面关于热力学第二定律知识点的讲解,可以帮助学生在正确理解和掌握教材中知识点的基础上,准确把握基本概念。
[1] 傅献彩,沈文霞,姚天扬,等.物理化学(上).第5版.北京:高等教育出版社,2005
[2] 苏万春.电子科技大学学报,2006,35(1):51
[3] 王翠.延边大学学报(自然科学版),2000,26(4):265
[4] 徐光宪.化学通报,1956(11):29
[5] 吴征铠.化学通报,1956(11):33
[6] 陈良坦,张来英,吴金添.大学化学,2006,21(1):13
[7] 印永嘉,奚正楷,李大珍.物理化学简明教程.第3版.北京:高等教育出版社,1992
[8] 范崇正,杭瑚,蒋潍渭.物理化学:概念辨析.解题方法.第2版.合肥:中国科学技术大学出版社,2004
[9] 恒煜.咸宁师专学报(自然科学版),1986,2:31
[10] 吕德义,张庆轩,张忠诚,等.物理化学考研方略.北京:化学工业出版社,2007
* 通讯联系人
