waaF空肠弯曲菌变异株神经节苷脂表位的改变①
2010-06-21束晓梅王晓红遵义医学院附属医院儿科遵义563003
束晓梅 王晓红 彭 昌 (遵义医学院附属医院儿科,遵义 563003)
空肠弯曲菌(Campylobacter jejuni,CJ)感染与自身免疫性周围神经病——Guillain-Barre综合征(GBS)关系密切,但机制不清[1]。CJ的脂寡糖(lipooligosaccharide,LOS)结构上存在多种神经节苷脂样结构,可能通过分子模拟发生周围神经免疫性损伤。waaF基因编码庚糖转移酶,催化转移庚糖连接到LOS外核上。理论上说,waaF基因敲除后,变异株丢失LOS上所有的神经节苷脂表位[2],即 waaF变异株不含有模拟神经节苷脂样结构,不能诱导动物产生神经节苷脂抗体及免疫性周围神经损伤。我们用Benjamin博士馈赠的 waaF基因敲除变异株,对照亲代株研究两者诱导动物抗体产生及周围神经损伤的改变,对进一步证实 CJ诱发GBS的分子模拟理论及探索waaF变异株作为减毒活菌苗的可能性具有十分重要意义。
1 材料与方法
1.1 材料 CJ亲代株(菌号HB9313,血清型HS:19)及其waaF变异株由澳大利亚皇家墨尔本研究所Benjamin N Fry博士馈赠。神经节苷脂GM1、GD1a、GD1b、GD3、GT1b 及辣根过氧化物酶标记的IgG抗体购自Sigma公司,亲代株(HB9313)的LOS由本实验室纯化,经SDS-PAGE鉴定纯度达到95%。3月龄日本大耳兔由重庆医科大学动物中心提供,体重2~2.5千克,雌雄不限。
1.2 方法
1.2.1 灭活CJ菌液制备 两菌株均微需氧环境,42℃生长于Skirrow培养基中,变异株需加入终浓度为0.03 μ g/L的卡那霉素。用含甲醛0.1 mol/L的磷酸盐缓冲液(PBS)灭活,3 500 r/min离心30分钟,9 g/L盐水洗涤沉淀物2次,3 500 r/min室温离心10分钟,弃上清液,调至终浓度为3×1012CFU/L的灭活菌液备用。
1.2.2 实验动物分组 日本大耳兔26只,随机分为3个实验组:亲代株组(10只)、waaF变异株组(10只)及对照组(6只)。
1.2.3 免疫方法 初次免疫:取完全弗氏佐剂分别与等体积的亲代株菌液、变异株菌液、9 g/L盐水溶液混匀充分乳化后,以每只兔总量2 ml,背部皮下多点注射;加强免疫:分别在初次免疫后2周、3周时,取不完全弗氏佐剂与等体积的上述菌液混合,按每只兔总量1 ml,背部皮下多点注射。
1.2.4 血清LOS-IgG及多种神经节苷脂IgG抗体检测 各组动物分别于初次免疫后2周、4周经耳缘静脉取血2 ml,分离血清,-70℃低温冰箱保存备用,采用 ELISA方法检测血清中特异性抗 LOS-、GM1-、GD1a-、GD1b-、GD3-、GT1b-IgG 抗体。纯化的LOS用新鲜配制的包被液稀释成50 μ g/ml,包被酶标板,100 μ l/孔 ;神经节苷脂GM1、GD1a、GD1b、GD3及GT1b 稀释成 2 μ g/ml,每孔 100 μ l包被,4℃过夜 ,10 g/L血清白蛋白(BSA)封闭,37℃湿盒孵育2小时;1∶50稀释血清样本每孔100 μ l,设复孔,37℃孵育2小时,磷酸盐吐温缓冲液(PBST)洗3次;加入辣根过氧化物酶(HRP)标记的IgG抗体,37℃孵育1小时;PBST洗3次;四甲基联苯胺(TMB)避光显色15分钟,硫酸终止反应;设包被液作空白对照,封闭液作阴性对照,490 nm波长下读取光密度值(OD 490)。
1.3 统计学处理 SPSS 10.0统计软件包进行统计处理,数据以±s表示,均数间比较用t检验,P<0.05表示差异有统计学意义。
2 结果
免疫前及免疫后不同时间血清LOS-IgG及多种神经节苷脂IgG抗体水平见表1。①无论使用亲代株还是waaF变异株全菌抗原,经全身免疫后两组动物血清均显示抗LOS-IgG抗体滴度增高。免疫后14天,亲代株及waaF变异株动物LOS-IgG抗体水平为(0.758±0.136及0.744±0.125),较免疫前(0.250±0.101及0.226±0.083)相比明显增高(P<0.05),4周进一步增高为(0.971±0.214及0.975±0.172),为免疫前的4倍以上,亲代株及waaF变异株两组间抗体水平无明显差异(P>0.05),而对照组免疫前后LOS-IgG抗体水平无明显改变。②接受亲代株免疫的兔子,2周时血清抗GM1-IgG、GD1a-IgG及GT1b-IgG抗体水平分别为(0.661±0.290、0.487±0.041及0.457±0.071)与免疫前(0.173±0.081、0.151±0.038及0.182±0.101)相比明显增高(P<0.05),4周时进一步增高为(0.984±0.025、0.541±0.178及0.574±0.156)。而接受waaF变异株免疫的动物及对照组免疫后始终未见任何神经节苷脂抗体的增高。
表1 免疫后不同时点血清IgG抗体水平的变化(OD490,±s)Tab.1 Serum IgG titers at different time points after immunization(OD490,±s)
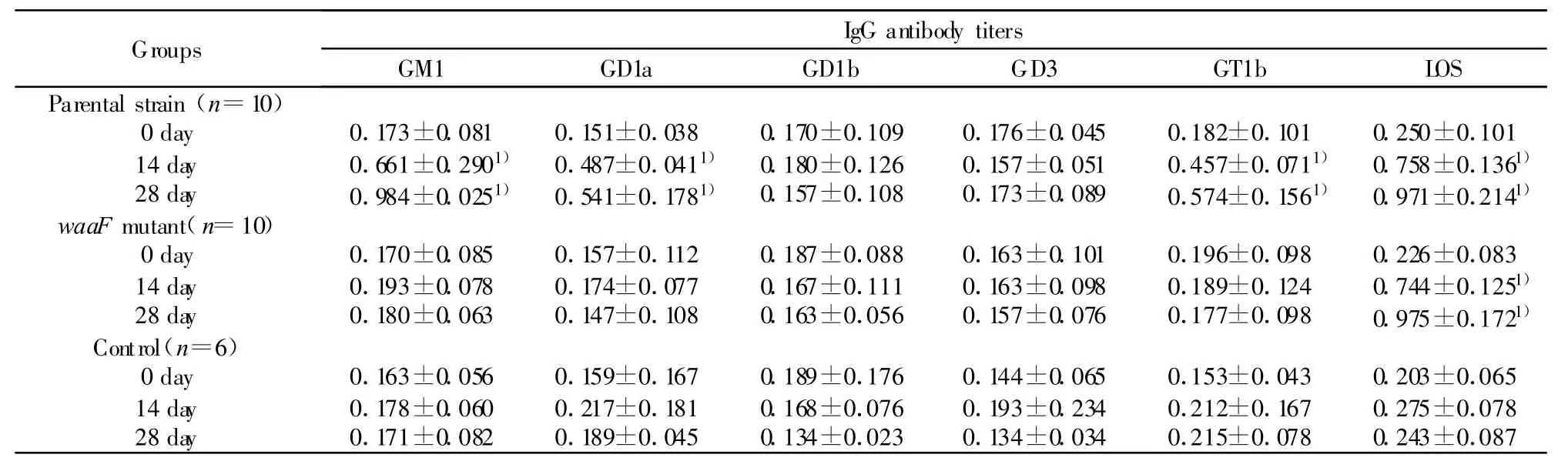
表1 免疫后不同时点血清IgG抗体水平的变化(OD490,±s)Tab.1 Serum IgG titers at different time points after immunization(OD490,±s)
Note:1)P<0.05,compared with that before immunization.
Groups IgG antibody titers GM1 GD1a GD1b GD3 GT1b LOS Parental strain(n=10)0 day 0.173±0.081 0.151±0.038 0.170±0.109 0.176±0.045 0.182±0.101 0.250±0.101 14 day 0.661±0.2901) 0.487±0.0411) 0.180±0.126 0.157±0.051 0.457±0.0711) 0.758±0.1361)28 day 0.984±0.0251) 0.541±0.1781) 0.157±0.108 0.173±0.089 0.574±0.1561) 0.971±0.2141)waaF mutant(n=10)0 day 0.170±0.085 0.157±0.112 0.187±0.088 0.163±0.101 0.196±0.098 0.226±0.083 14 day 0.193±0.078 0.174±0.077 0.167±0.111 0.163±0.098 0.189±0.124 0.744±0.1251)28 day 0.180±0.063 0.147±0.108 0.163±0.056 0.157±0.076 0.177±0.098 0.975±0.1721)Control(n=6)0 day 0.163±0.056 0.159±0.167 0.189±0.176 0.144±0.065 0.153±0.043 0.203±0.065 14 day 0.178±0.060 0.217±0.181 0.168±0.076 0.193±0.234 0.212±0.167 0.275±0.078 28 day 0.171±0.082 0.189±0.045 0.134±0.023 0.134±0.034 0.215±0.078 0.243±0.087
3 讨论
CJ是引起急性胃肠炎最常见的细菌之一,更重要的是该菌与常见的免疫性周围神经病GBS密切相关。大量流行病学及临床血清学资料显示,GBS常有CJ前驱感染史,GBS患者血清中含CJ的LOS抗体和多种抗神经节苷脂抗体 ,抗GM1、GD1a、GD1b、GD3 及GT1b抗体与GBS的关系引起广泛重视[3-5]。
CJ诱导GBS的确切机制尚不明确。目前,多数学者接受的分子模拟理论认为,可能由于 CJ外膜上的LOS存在神经节苷脂样结构,通过交叉免疫导致周围神经损伤[1]。LOS类似脂多糖结构,LOS又分内核及外核,外核上存在多种神经节苷脂样表位(ganglioside-like epitopes)。理论上说,若敲除LOS外核糖基合成的基因,则LOS不再含有任何神经节苷脂模拟结构,不再能诱导动物周围神经免疫损伤,如此,便可在基因水平验证分子模拟理论,同时也可解决因神经节苷脂模拟结构的存在,制约CJ菌苗安全性的问题。
本实验对照亲代株及waaF变异株免疫的结果显示,CJ亲代株确实含有多种神经节苷脂样结构,可刺激动物产生相应多种神经节苷脂抗体,而waaF变异株免疫的动物未见任何神经节苷脂抗体的增高,此结果从基因水平支持CJ诱导GBS发病的分子模拟理论学说。另一方面,waaF变异株虽丢失神经节苷脂表位,但其LOS结构仍具有免疫原性,仍可诱导LOS抗体产生,可能成为无神经免疫毒性的CJ菌苗候选株。
1 Willison H J,Yuki N.Peripheral neuropathies and anti-glycolipid antibodies[J].Brain,2002;125(12):2591-2625.
2 Phongsisay V,Perera V N,Fry B N.Exchange of lipooligosaccharide synthesis genes creates potential Guillain-Barre syndrome-inducible strains of Campylobacter jejuni[J].Infect Immun,2006;74(2):1368-1372.
3 Kusunoki S,Kaida K,Ueda M.Antibodies against gangliosides and ganglioside complexes in Guillain-Barré syndrome:New aspects of research[J].Biochim Biophys Acta,2008;1780(3):441-444.
4 Hamaguchi T,Sakajiri K,Sakai K et al.Guillain-Barré syndrome with antibodies to GD1a/GD1b complex[J].J Neurol Neurosurg Psychiatry,2007;78(5):548-549.
5 Kaida K,Morita D,Kanzaki M et al.Anti-ganglioside complex antibodies associated with severe disability in GBS[J].J Neuroimmunol,2007;182(1-2):212-218.