MAGE-D4a融合蛋白的原核表达、纯化及鉴定①
2010-09-07贺菽嘉肖绍文罗蓝秀万林文珍林永达谢小薰
贺菽嘉 肖绍文罗 彬 蓝秀万林文珍林永达 谢小薰
(广西医科大学组织学与胚胎学教研室,南宁530021)
MAGE-D4a融合蛋白的原核表达、纯化及鉴定①
贺菽嘉 肖绍文②罗 彬 蓝秀万③林文珍③林永达 谢小薰
(广西医科大学组织学与胚胎学教研室,南宁530021)
目的:构建肿瘤相关抗原MAGE-D4a的原核重组体系,表达、纯化融合蛋白。方法:PCR法从胶质瘤组织cDNA中扩增MAGE-D4a基因全长编码区,连接入原核表达载体pMAL-c2,筛选、鉴定阳性克隆并测序。将重组质粒转化至大肠杆菌Rosetta(DE3)诱导表达,表达产物经Amylose Resin亲和层析分离纯化,并且对纯化的融合蛋白进行质谱鉴定。结果:成功扩增了MAGE-D4a基因;重组质粒在Rosetta大肠杆菌中诱导表达出MBP/MAGE-D4a融合蛋白;优化了MAGE-D4a原核表达体系的最适条件;蛋白质谱分析结果显示表达的基因重组蛋白与目的蛋白相符。结论:获得了高效表达、可溶性的MAGE-D4a重组蛋白,为抗体的制备及血清学分析奠定了基础。
黑色素瘤相关抗原-D4a;原核表达;纯化;融合蛋白
肿瘤细胞表达的自身特异性抗原可以通过与MHC分子结合而激活CT L,还能诱导机体产生体液免疫反应,是肿瘤免疫治疗及早期诊断的重要分子标记物。筛选和鉴定有价值的肿瘤抗原是发展肿瘤新型治疗手段的重要前提。2001年Sasaki等[1]采用基因表达系列分析(Serial analysis of gene expression, SAGE)技术鉴定出黑色素瘤相关抗原(Melanoma-associate antigen,MAGE)家族的新成员MAGE-D4基因,并且对该基因的染色体定位、结构和mRNA表达特性进行了分析,结果提示MAGE-D4有可能成为具备潜在应用前景的肿瘤相关抗原。为了进一步了解MAGE-D4在不同组织中的表达谱以及引起机体免疫反应的情况,本研究以pMAL-c2质粒为载体,构建MAGE-D4a原核重组表达体系,在大肠杆菌Rosetta(DE3)中表达出可溶形式的目的蛋白,并对亲和层析纯化后的蛋白进行了质谱鉴定。
1 材料与方法
1.1 材料 DH5α菌株、pMAL-c2质粒及Amylose Resin亲和层析填料为New England Biolabs公司产品;Rosetta(DE3)菌株为Novagen公司产品;限制性核酸内切酶XbaⅠ、XmnⅠ、PstⅠ和T4 DNA连接酶为MBI公司产品;PrimeSTARTMHS DNA polymerase为TaKaRa公司产品;胶回收试剂盒和质粒DNA小量提取试剂盒为BIOER公司产品。
1.2 方法
1.2.1 MAGE-D4a编码区稀有密码子分析 利用网络资源Codon Usage Database(http://www.kazusa. or.jp/codon/)和 Codon Usage Analyzer(http://www. bioinformatics.org/codon/cgi-bin/codon.cgi)对MAGED4a基因cDNA ORF进行分析。
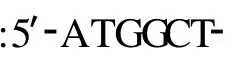
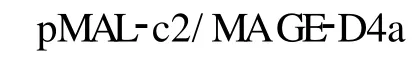
1.2.4 MAGE-D4a在大肠杆菌中的诱导表达 将测序正确的MAGE-D4a重组质粒转化CaCl2法制备的Rosetta(DE3)感受态细胞(42℃热休克法),接种单菌落于含0.2%葡萄糖、100μg/ml氨苄青霉素及34μg/ml氯霉素的LB培养液,37℃剧烈振荡至OD600为0.5~0.7,取1 ml菌液作为诱导前对照,加入IPTG终浓度为0.1、0.3、0.5、0.7、0.9、1.1、1.5、2.0 mmol/L,30℃诱导表达1、2、3、4、5、6、7、8小时及过夜。收集菌体进行8%SDS-PAGE电泳,观察不同IPTG浓度和诱导时间对目的蛋白表达量的影响。
1.2.5 MAGE-D4a融合蛋白的纯化与质谱分析取200 ml表达的菌液,4℃10 000 r/min离心10分钟,每克菌体沉淀加入3 ml过柱平衡液(20 mmol/L Tris-HCl,200 mmol/L NaCl,1 mmol/L EDTA,10 mmol/ Lβ-巯基乙醇)和 50 mmol/L的苯甲基磺酰氟(PMSF)8μl,反复冻融三次,冰浴超声裂解细菌,4℃10 000 r/min离心20分钟,分别取上清液和沉淀进行SDS-PAGE,检查目的蛋白的可溶性。将上清液结合Amylose Resin亲和层析柱,用12倍柱床体积的过柱平衡液洗去非特异结合的杂蛋白,含10 mmol/L麦芽糖的洗脱缓冲液洗脱MBP/MAGE-D4a融合蛋白,收集洗脱液,测定OD280,SDS-PAGE电泳鉴定纯度,用ABI 4700质谱仪进行MALDI-TOF-TOF MS/MS蛋白质谱分析。
2 结果
2.1 稀有密码子分析结果 MAGE-D4a基因编码区稀有密码子的分布情况见图1,稀有密码子的出现频率高达10.52%,数据统计见表1。

图1 MAGE-D4a基因稀有密码子分布情况Fig.1 Rare codon distribution of MAGE-D4a gene
2.2 MAGE-D4a重组质粒的构建及鉴定 通过高保真DNA聚合酶进行PCR扩增,获得与预期2 235 bp大小一致的MAGE-D4a基因全长编码区,见图2。挑取白色转化菌落,提取质粒,分别用质粒通用引物及基因特异性引物扩增,结果与预测相符,证实MAGE-D4a已经插入pMAL-c2质粒的malE基因下游的多克隆位点。PstⅠ酶切重组质粒获得1 002 bp和7 850 bp两个片段,表明目的基因为正向克隆,见图3。将DNA测序结果进行Blast比对,MAGE-D4a基因序列与GeneBank公布的完全一致(AB040527)。
2.3 融合蛋白在大肠杆菌中的诱导表达 以大肠杆菌Rosetta为宿主菌,加入IPTG诱导后,在分子量约140 kD处出现一条明显增粗的条带,比预测的MBP/MAGE-D4a融合蛋白理论分子量(124 kD)稍大,见图4。目的蛋白表达量的高低不仅与菌液的生长状态、诱导时间有关,还受到IPTG加入时机及IPTG浓度的影响。结果显示,在细菌进入对数生长期后,加入终浓度为0.1~0.7 mmol/L的IPTG,目的蛋白的表达量没有明显差异,而当IPTG浓度>0.7 mmol/L时蛋白表达量反而下降;在0.3 mmol/L的IPTG诱导下,30℃振荡培养6小时时融合蛋白的表达量最高,约占菌体总蛋白的47.7%;超声破菌后的上清液和沉淀同时进行SDS-PAGE分析表明,融合蛋白部分以可溶性的形式存在,部分以不溶性的包涵体形式存在。
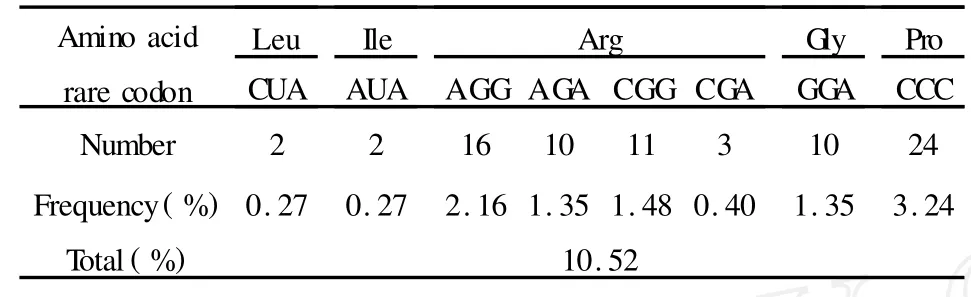
表1 MAGE-D4a稀有密码子分析Tab.1 Rare codon analysis of MAGE-D4a gene
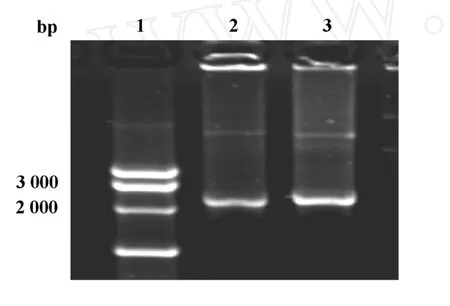
图2 PCR扩增MAGE-D4a基因电泳图谱Fig.2 PCR electrophoretogram of MAGE-D4a gene
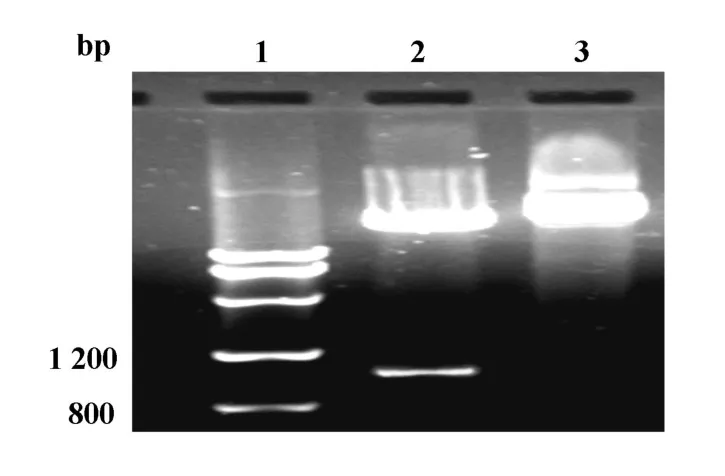
图3 pMAL-c2/MAGE-D4a重组质粒的限制性酶切分析Fig.3 Restriction enzyme analysis of pMAL-c2/MAGE-D4a recombinant plasmid
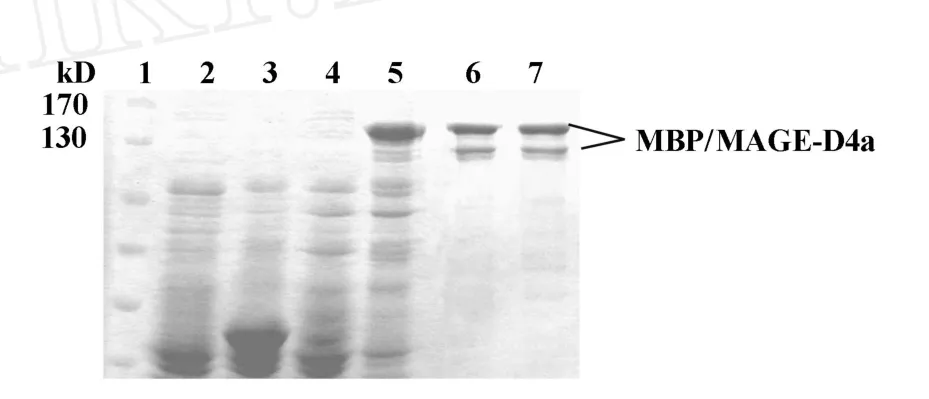
图4 pMAL-c2/MAGE-D4a重组质粒的诱导表达及纯化Fig.4 The induction expression and purification of pMAL-c2/ MAGE-D4a

图5 MAGE-D4a融合蛋白的质谱分析结果Fig.5 MALDI-TOF-TOF mass spectrometry analysis of MAGE-D4a protein

图6 MAGE-D4a蛋白质序列Fig.6 Amino acid sequence of MAGE-D4a protein
2.4 融合蛋白的亲和层析和质谱鉴定 将超声裂解后的表达菌上清进行Amylose Resin亲和层析,得到纯化的融合蛋白,见图4。为了确认纯化得到的蛋白是MBP/MAGE-D4a目的蛋白,切下SDS-PAGE凝胶上的相应条带,进行MALDI-TOF-TOF MS/MS分析,通过肽段同源性分析证实表达的基因工程蛋白为MAGE-D4a,见图5。图6为MAGE-D4a蛋白全长氨基酸序列,其中加粗下划线的肽段为MS/MS分析中与MAGE-D4a完全匹配的部分。
3 讨论
MAGE-D4基因定位于人染色体 Xp11,全长7 643 bp,由13个外显子组成,转录过程中外显子选择性剪接形成MAGE-D4 a、b、c 3个变异体。启动子区域的分析表明在转录起始位点附近有CpG岛的存在。MAGE-D4a和D4b蛋白在421~600氨基酸区域具有MAGE家族同源结构域(MAGE homology domain,MHD)[2]。Sasaki等[3]通过定量 RT-PCR的方法检测发现,胶质母细胞瘤组织中MAGE-D4的表达为正常星形胶质细胞的2.6~15倍。Northern blot法检测了14种(各1例)正常组织,除脑和卵巢外均未发现MAGE-D4 mRNA的表达。最近,该研究小组报道MAGE-D4在非小细胞肺癌中的表达水平高于正常肺组织,并且分化程度差的肺癌常呈MAGE-D4高表达,这说明MAGE-D4可能在肿瘤细胞的增殖中发挥作用[4]。Kramer等[5]从肾癌实体瘤组织中鉴定了来源于MAGE-D4的第一个MHCⅠ配体:NIG DEALIGRW。这些研究结果初步显示MAGE-D4很可能是一个肿瘤相关的抗原基因。
pMAL-c2质粒的多克隆位点上游携带有大肠杆菌malE基因,可编码产生42 kD的麦芽糖结合蛋白(MBP),采用可诱导的tac强启动子和malE翻译起始信号获得克隆基因的高效表达,N端带有MBP-tag的重组蛋白可通过多糖树脂亲和层析进一步纯化,多数情况下不会影响表达产物的免疫原性及活性。本研究在构建MAGE-D4a原核重组质粒及表达纯化融合蛋白时,获得了以下的宝贵经验:首先,在基因克隆方面,由于MAGE-D4a mRNA编码区GC含量(59.8%)较高的特点,即使在4%DMSO的条件下, Taq DNA聚合酶扩增目的条带的效率仍然非常低,因而正式扩增时采用了PrimeSTARTMHS DNA聚合酶(TaKaRa),该酶具有极强的3′→5′核酸外切酶活性而显示出超群的校正功能,即使对GC rich的模板也能进行高效率、高保真的扩增;选择XmnⅠ和XbaⅠ酶切进行平粘端连接,这不仅有利于目的基因的定向克隆,而且还可通过Factor Xa等蛋白酶的切割得到非融合的完整的目的蛋白。其次,将测序正确的重组质粒在DH5α、TB1等常规菌株中表达时,发现融合蛋白的表达量非常之低,经分析,原因可能是MAGE-D4a含有较多的大肠杆菌稀有密码子(10.52%),稀有密码子成簇出现或聚集在一起使蛋白翻译过程中tRNA不能正常乙酰化,导致核糖体的运动受阻,造成蛋白表达困难、氨基酸错配或翻译提前终止。Rosetta(DE3)是一种携带pRARE2质粒的BL21衍生菌,可以补充大肠杆菌七种稀有密码子(AUA,CCC,GG A,CGG,CUA,AG A和AGG)对应的tRNA,显著提高真核基因在原核系统中的表达水平。实验结果显示,在 IPTG的诱导下,MAGE-D4a在Rosetta重组菌中实现了高效的表达,并且部分以可溶性形式存在。第三,SDS-PAGE鉴定重组蛋白时,BandScan软件推算融合蛋白分子量约140 kD,比预测的理论分子量124 kD(MBP 42 kD+MAGE-D4a 82 kD)稍大,考虑到在原核表达体系中并不存在糖基化等翻译后修饰,推测这可能是由于Mage-D4a富含脯氨酸(7.02%)引起蛋白空间结构异常,在电泳时实际迁移率变慢所致。为了进一步确认,对纯化的融合蛋白进行MALDI-TOF-TOF MS/MS分析,证实表达的基因工程蛋白为MAGE-D4a。
目前有关MAGE-D4基因的研究非常有限,表达特性的检测多限于mRNA水平[6-8]。MAGE-D4蛋白能否有效地引起机体免疫应答,其生物学功能及与肿瘤发生、发展、预后的关系如何,能否成为肿瘤基因和免疫治疗的分子靶向,这些问题值得进一步的深入分析。本研究首次成功构建了pMAL-c2/MAGE-D4a原核表达体系,在Rosetta宿主菌中高效表达出可溶性的MAGE-D4a全长蛋白,并通过亲和层析得到了纯度较高的融合蛋白,可用于今后血清学的检测以及抗体的制备,为评估MAGE-D4在肿瘤辅助诊断及治疗监测中的应用前景奠定基础。
1 Sasaki M,Nakahira K,Kawano Yet al.MAGE-E1,a new member of the melanoma-associated antigen gene family and its expression in human glioma[J].Cancer Res,2001;61(12):4809-4814.
2 Kawano Y,Sasaki M,Nakahira Ket al.Structural characterization and chromosomal localization of the MAGE-E1 gene[J].Gene,2001;277(1-2):129-137.
3 Ikenaka K,Sasaki M,Tamura Ket al.Treatment of glioblastoma by direct inoculation of concentrated high titer-recombinant retrovirus carrying the herpes simplex virus thymidine kinase gene[J].Hum Cell,2001;14(1): 49-58.
4 Ito S,Kawano Y,Katakura Het al.Expression of MAGE-D4,a novel MAGEfamily antigen,is correlated with tumor-cell proliferation of nonsmall cell lung cancer[J].Lung Cancer,2006;51(1):79-88.
5 Kramer B F,Schoor O,Kruger Tet al.MAGED4-expression in renal cell carcinoma and identificationof an HLA-A*25-restricted MHC class I ligand from solid tumor tissue[J].Cancer Biol Ther,2005;4(9):943-948.
6 Tsai J R,Chong I W,Chen Y Het al.Differential expression profile of MAGE family in non-small-cell lung cancer[J].Lung Cancer,2007;56 (2):185-192.
7 Cheong S C,Chandramouli GV,Saleh Aet al.Gene expression in human oral squamous cell carcinoma is influenced by risk factor exposure[J].O-ral Oncol,2009;45(8):712-719.
8 Lee M H,Son E I,K im Eet al.Expression of cancer-testis genes in brain tumors[J].J K orean Neurosurg Soc,2008;43(4):190-193.
[收稿2009-11-24 修回2010-02-04]
(编辑 张晓舟)
Prokaryotic expression,purification and identification of MAGE-D4a
HE Shu-Jia,XIAO Shao-Wen,LUO Bin,LAN Xiu-Wan,LIN Wen-Zhen,LIN Yong-Da,XIE Xiao-Xun.Department of Histology and Embryology,Guangxi Medical University,Nanning530021,China
Objective:T o construct tumor associated antigen MAGE-D4a prokaryotic recombination systemfor expression and purification of the fusion protein.Methods:PCR technique was used to amplify MAGE-D4a of the full-length encoding sequence from human glioma sample,which was cloned into prokaryotic expression plasmid pMAL-c2.Positive clones were selected,identified,sequenced,and then transformed into E.coli Roseetta.After induced by IPTG,expressing products were purified with Amylose Resin affinitive chromatography and identified by mass spectrum.Results:The MAGE-D4a gene was obtained successfully.E.coli Roseetta strains which harbored the recombinant plasmid could express MBP/MAGE-D4a fusion protein.The inducing conditions of prokaryotic expression were optimized.The expressing protein was really identical to MAGE-D4a protein by mass spectrometry analysis.Conclusion:The highly efficient expression and soluble protein was manufactured,which could provide essential materials for further research of MAGE-D4a.
MAGE-D4a;Prokaryotic expression;Purification;Fusion protein
R739.4 文献标识码 A 文章编号 1000-484X(2010)05-0432-05
①本文受国家自然科学基金(30760055)、广西省自然科学基金(桂科自0728148及0832144)、广西高发疾病研究创新性团队基金(No.桂教人[2007-59]号)和广西大型仪器协作共用网(499-2007-078及666-2008-079)资助
②广西医科大学第一附属医院神经外科,南宁530021
③广西医科大学生物化学与分子生物学教研室,南宁530021
贺菽嘉(1976年-),女,在读博士,主要从事肿瘤分子生物学及肿瘤免疫学研究,E-mail:hshj-306@yahoo.com.cn;
及指导教师:谢小薰(1958年-),女,博士,教授,博士生导师,主要从事肿瘤分子生物学及肿瘤免疫学研究,E-mail:xiexiaoxun@yahoo.com。