TLR4在anti-β2GPⅠ/β2GPⅠ复合物诱导THP-1细胞表达TF中的作用探讨①
2010-06-21严一红周保成文海平许国莹江苏大学基础医学与医学技术学院镇江212013
严一红 周 红 周保成 文海平 许国莹 周 芳 (江苏大学基础医学与医学技术学院,镇江 212013)
抗磷脂综合征(Antiphospholipid syndrome,APS)是一种非器官特异性自身免疫性疾病,主要临床表现为复发性动、静脉血栓及习惯性流产[1]。APS患者血清中的高滴度抗磷脂抗体(Antiphospholipid antibody,APL)与其血栓形成密切相关。研究表明,β2糖蛋白 Ⅰ(beta-2-glycoproteinⅠ,β2GP Ⅰ)是APL的主要靶抗原,其与相应抗体(anti-β2GPⅠ)形成复合物,在APS病理过程中发挥重要作用[2,3]。anti-β2GPⅠ/β2GPⅠ复合物能够诱导血液单核细胞表达组织因子(Tissue factor,TF),由TF引发的外源性凝血是APS血栓形成的主要原因之一[4,5]。进一步研究发现,anti-β2GPⅠ与其抗原β2GPⅠ交联于细胞膜表面特异受体,经信号转导系统使细胞表达TF等活性分子,导致血液高凝[6]。近年来,有关细胞表面β2GPⅠ受体的研究及相关信号途径的探讨是APS研究的关键问题,其中Toll样受体4(TLR4)的作用正受到关注。
TLR4是Toll样受体(Toll-like receptors,TLRs)家族成员之一,属于Ⅰ型跨膜蛋白(TypeⅠtransmembrance protein),是病原微生物模式识别受体[7]。TLR4可以识别多种配体,其中最主要的是来自细菌脂多糖(LPS)。研究发现,TLR4与其相应配体结合后,迅速引起髓样分化蛋白-2(Myeloid differentiation-2,MD-2)分子的分泌[8]。后者与TLR4的胞外区相偶联,形成TLR4/MD-2受体复合物,随即活化其下游的接头蛋白——髓样分化因子88(Myeloid differentiation factor 88,MyD88)。MyD88接着招募下一个信号蛋白,最终激活核因子κ B(Nuclear factor-kappa B,NF-κ B)和有丝分裂原蛋白激酶(Mitogen-activated protein kinase,MAPK)通路,导致相关基因的转录[9]。
本研究前期实验发现,anti-β2GPⅠ/β2GPⅠ复合物作用于单核细胞株THP-1细胞后,细胞TLR4表达水平上升,提示TLR4受体途径在其中具有一定的作用。本文重点探讨TLR4及其分泌蛋白MD-2、接头蛋白 MyD88 在 anti-β2GPⅠ/β2GPⅠ复合物诱导THP-1细胞TF表达中的作用,并采用紫杉醇抑制实验进一步证明TLR4及相关信号蛋白的转导效应。
1 材料与方法
1.1 主要材料及试剂 人单核细胞株THP-1(上海中国科学院细胞研究所),DMEM(Gibco公司),超级新生牛血清(杭州吉诺公司),兔抗人TLR4、MD-2多克隆抗体(eBioscience公司),MyD88抗体(Cell signaling公司),非特异性同型对照抗体——R-IgG(武汉博士德生物工程有限公司),Trizol(Invitrogen公司),逆转录试剂盒(Toyobo公司),TF活性试剂盒(Assaypro公司),紫杉醇(同田生物技术有限公司),定量PCR试剂盒(杭州博日科技有限公司),ECL显色试剂(Santa Cruz公司),LPS(Sigma公司),anti-β2GPⅠ抗体和β2GPⅠ(本实验室制备),CNBr-activatedsepharose-4B(Amersham公司),β2GPⅠ胶联亲和层析柱(β2GPⅠ-Affi-Gel,本实验室制备),引物(设计采用primer primer 5.0,由上海生物工程有限公司合成)。
1.2 方法
1.2.1 THP-1细胞的培养 复苏冻存的THP-1细胞,用DMEM 培养液(含10%新生牛血清,100 U/ml青霉素和100 U/ml链霉素),置于37℃、5%CO2饱和湿度的孵育箱培养,当细胞长满培养瓶底部的70%~80%时,给细胞换液并传代。取传代5~10次、处于对数生长期的状态良好的细胞用于实验。
1.2.2 β2GPⅠ与THP-1细胞相应受体结合分析
利用CNBr-activated-Sepharose-4B自制β2GPⅠ胶联亲和层析柱(β2GPⅠ-Affi-Gel)。采用 anti-β2GPⅠ/β2 GPⅠ复合物(浓度为 100 μ g/ml)与THP-1细胞(1×107)孵育6小时,收集细胞,PBS洗涤3次后,加入1 ml细胞裂解液裂解,4℃10 629 r/min离心10分钟后取上清,经0.02 mol/L Tris-HCl透析过夜后上样至β2GPⅠ-Affi-Gel柱,分别应用0.03mol/L NaCl的Tris平衡液和0.35 mol/L NaCl的Tris洗脱液洗脱,各步骤均洗涤至流出液吸光度值接近0为止。将收集的样本流出液、0.03 mol/L NaCl的Tris平衡收集液及0.35 mol/L NaCl的Tris洗脱收集液三份样本经过SDS-PAGE电泳后转PVDF膜,将膜用5%牛奶封闭1小时后,以抗TLR4抗体为一抗,37℃孵膜2小时。PBS洗涤3次后,再与相应二抗37℃孵育1小时,PBS洗涤3次后采用ECL显色,并记录结果。
1.2.3 细胞总RNA的提取和逆转录 将THP-1细胞种入6孔板内(2×106/孔),37℃、5%CO2培养24小时后轻轻弃去培养液,换以1 ml无血清DMEM。根据实验设计加入不同刺激物处理细胞2小时。紫杉醇抑制试验则先将紫杉醇与细胞孵育1小时后,再以不同刺激物处理细胞2小时。收集细胞,加入1ml Trizol裂解,混匀后于室温放置10分钟充分裂解,按Trizol说明书提取细胞总RNA。逆转录按试剂盒要求操作,逆转录体系:总 RNA 1 μ g、OligodT 1 μ l、5 ×Buffer 4 μ l、dNTPs(10 mmol/L)2 μ l、RNase Inhibitor 1μ l、ReverTra Ace 1μ l,最后用ddH2O 补足至20 μ l。反应条件:42℃20分钟,99℃5分钟,4℃5分钟。将RNA及逆转录的cDNA分别于-70℃和-20℃保存备用。
1.2.4 细胞裂解物的制备 收集传代3~10次的THP-1细胞,种植于6孔板内,浓度为2×106/孔,37℃、5%CO2培养箱培养24小时后弃去上清,加入1 ml无血清DMEM,然后以相应刺激物刺激6小时。紫杉醇抑制试验先将紫杉醇与细胞孵育1小时后再与相应刺激物作用6小时,收集细胞,加入适量细胞裂解液,于冰上裂解0.5小时,期间每隔10分钟剧烈震荡一次,4℃10 629 r/min离心10分钟后取上清,测定蛋白浓度,-70℃保存备用。
1.2.5 荧光定量PCR检测 分别设计TLR4、MD-2、MyD88、TF、GAPDH 基因的 PCR引物序列(表 1),行荧光定量PCR检测。反应体系为:2×SYBR Mix 10 μ l,上下游引物各 0.5 μ l,TaqDNA Polymerase 0.12 μ l,最后用灭菌 ddH2O补足至 20 μ l。Real-time PCR循环参数为:94℃预变性5分钟,一个循环;94℃30秒,60℃(TLR4、MD-2、MyD88、TF)/56℃(GAPDH)30 秒,72℃30秒,35个循环扩增。目的基因的相对表达水平=目的基因拷贝数/GAPDH拷贝数。
1.2.6 Western 蛋白印迹分析 取收集的总蛋白30 μ g与样本缓冲液作用,94℃变性3分钟后以12%SDS-PAGE电泳分离蛋白,再以350 mA恒流转印至PVDF膜;膜置于含有5%脱脂牛奶的TBS/T室温封闭1小时;再分别用相应的兔抗人TLR4(1∶1 500)、兔抗人MD-2(1∶500)及兔抗人MyD88(1∶1 000)抗体4℃孵育过夜,次日用TBS/T洗涤3次,15 min/次,采用HRP标记的羊抗兔IgG抗体(1∶500),37℃孵育1小时,TBS/T洗涤3次,15min/次,ECL显色系统定影显色,观察杂交条带。
1.2.7 TF活性检测 利用TF/Ⅶa复合物使因子Ⅹ转变为活化因子Ⅹa,根据Ⅹa生成量来判定细胞TF的活性。测定标本为细胞裂解物,严格按照试剂盒说明操作。在96孔反应板中加入50 μ l的样品稀释液和10 μ l的因子Ⅶ后,分别加入倍比稀释的标准品和测定样本10 μ l,以样品稀释液为空白,37℃反应30分钟后,加入因子Ⅹ。37℃反应30分钟后再加入Ⅹa的发色底物,于405 nm、37℃条件下测定吸光度值。吸光度值高低和样品中TF活性呈正相关,TF活性结果以pmol/L表示。
1.3 统计学分析 采用软件SPSS10.0进行统计学分析,所有数据以±s表示。对各组数据进行成组资料的t检验分析,P<0.05为差异具有统计学意义。
2 结果
2.1 Anti-β2GPⅠ /β2GP Ⅰ诱导 THP-1细胞表达TF mRNA及活性 本研究组已证明anti-β2GPⅠ/β2GPⅠ复合物能够诱导血液单核细胞表达TF活性[3,5],此次观察了单核细胞株THP-1细胞的情况。由图1可见,anti-β2GP Ⅰ/β2GP Ⅰ复合物(100 μ g/ml)能够显著增加THP-1细胞的TF mRNA水平(图1A),并增强细胞的TF活性(图1B),与未加任何处理的THP-1细胞(Control)比较,差异显著(P<0.05);而非特异性同型对照抗体— —R-IgG/β2GPⅠ(100 μ g/ml)复合物则没有此作用(图1)。本实验以LPS(500 ng/ml)刺激细胞为阳性对照。
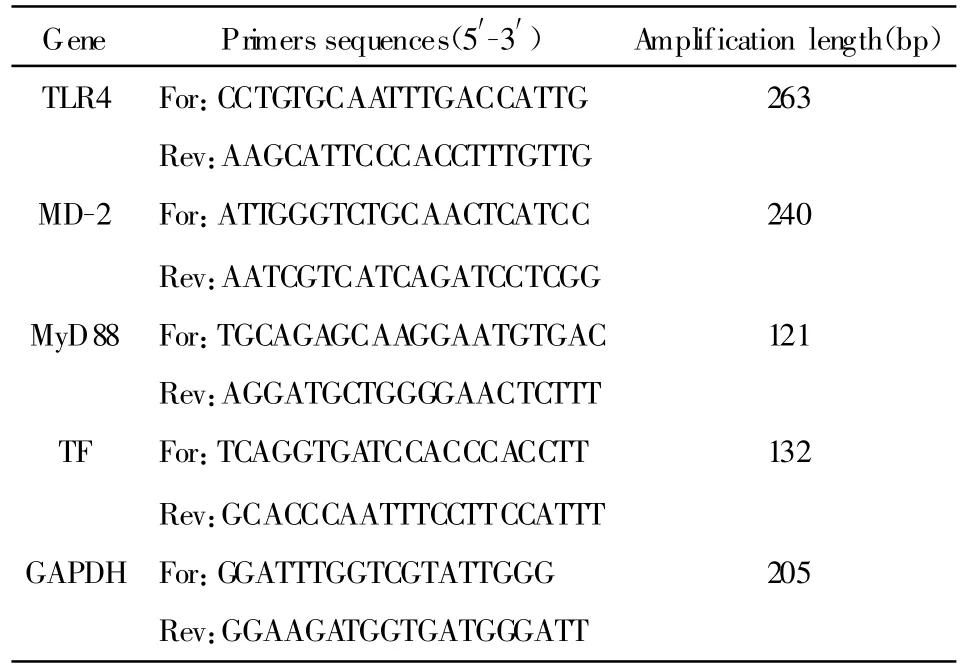
表 1 TLR4、MD-2、MyD88、TF和 GAPDH 基因引物序列Tab.1 Sequences of TLR4,MD-2,MyD88,TF and GAPDH gene primers
2.2 β2GPⅠ与THP-1细胞相应受体结合 本实验室自制的β2GPⅠ-Affi-Gel柱经估算,β2GPⅠ蛋白偶联率达85.8%。将与anti-β2GPⅠ/β2GPⅠ复合物孵育过的THP-1细胞,裂解后经β2GPⅠ-Affi-Gel柱亲和层析,再利用抗TLR4抗体对层析后的标本进行 Western 蛋白印迹分析。结果显示:样本流出液及0.03mol/L NaCl的Tris平衡收集液中没有检测到TLR4目的条带,而经0.35 mol/L NaCl的Tris洗脱液洗脱后,在100 kD处可检测到清晰的TLR4目的条带(图2),表明 anti-β2GPⅠ/β2GP Ⅰ复合物能够与细胞膜上TLR4结合。
2.3 Anti-β2GPⅠ/β2 GP Ⅰ增 强 THP-1 细 胞 TLR4、MyD88、MD-2的表达 实验同样设立未处理THP-1细胞的空白对照(Control)及LPS刺激的阳性对照。结果显示 :经anti-β2GPⅠ/β2GPⅠ(100 μ g/ml)刺激 2小时 后 ,THP-1细胞TLR4 、MyD88 、MD-2mRNA表达均显著增加(图3A),与空白比较差异显著(P<0.05)。另外, Western 蛋白印迹分析刺激6小时后相应的蛋白水平,与未刺激的空白比较,观察到TLR4、MyD88、MD-2蛋白表达也有明显的增强,条带增粗,密度增厚(图3B)。
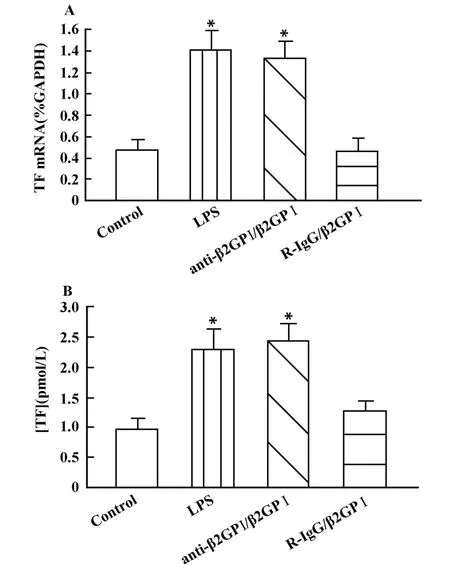
图1 Anti-β2GPⅠ/β2GPⅠ 诱导的 THP-1 细胞 TF mRNA(A)表达及TF活性(B)Fig.1 Anti-β2GPⅠ/β2GPⅠ-induced THP-1 cells TF mRNA(A)expression and TF activity(B)
2.4 紫杉醇抑制anti-β2GPⅠ/β2GPⅠ诱导THP-1细胞TLR4、MyD88、MD-2 的表达 将 1 μ mol/L 紫杉醇与THP-1细胞预孵育 1小时后,再以 anti-β2GPⅠ/β2GP Ⅰ 复合物(100 μ g/ml)刺激细胞,观察 TLR4、MyD88、MD-2 mRNA和蛋白水平的变化 。图4结果显示,经紫杉醇处理后,anti-β2GP Ⅰ/β2 GPⅠ复合物不能增加THP-1细胞的TLR4、MyD88及MD-2 mRNA的表达(图4A),与对照比较无显著差异(P>0.05);并且,相应的蛋白水平从条带上观察也无明显增强(图4B)。

图2 β2GPⅠ与THP-1细胞相应受体TLR4结合分析Fig.2 Analysis of β2GPⅠ binding with THP-1 cells-related receptor TLR4
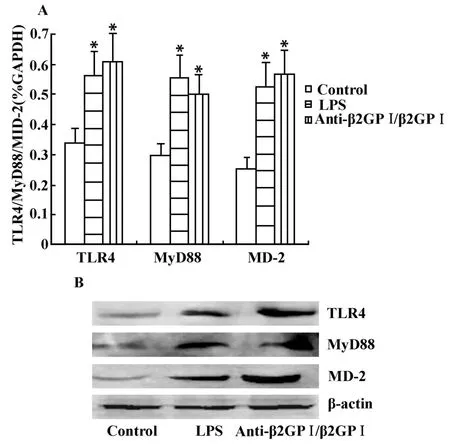
图 3 Anti-β2GP Ⅰ/β2GPⅠ 诱 导 的 THP-1 细 胞 TLR4、MyD88、MD-2 mRNA(A)及蛋白(B)的表达Fig.3 Anti-β2G PⅠ/β2G PⅠ-induced THP-1 cells TLR4,MyD88,MD-2 mRNA(A)and protein(B)expression
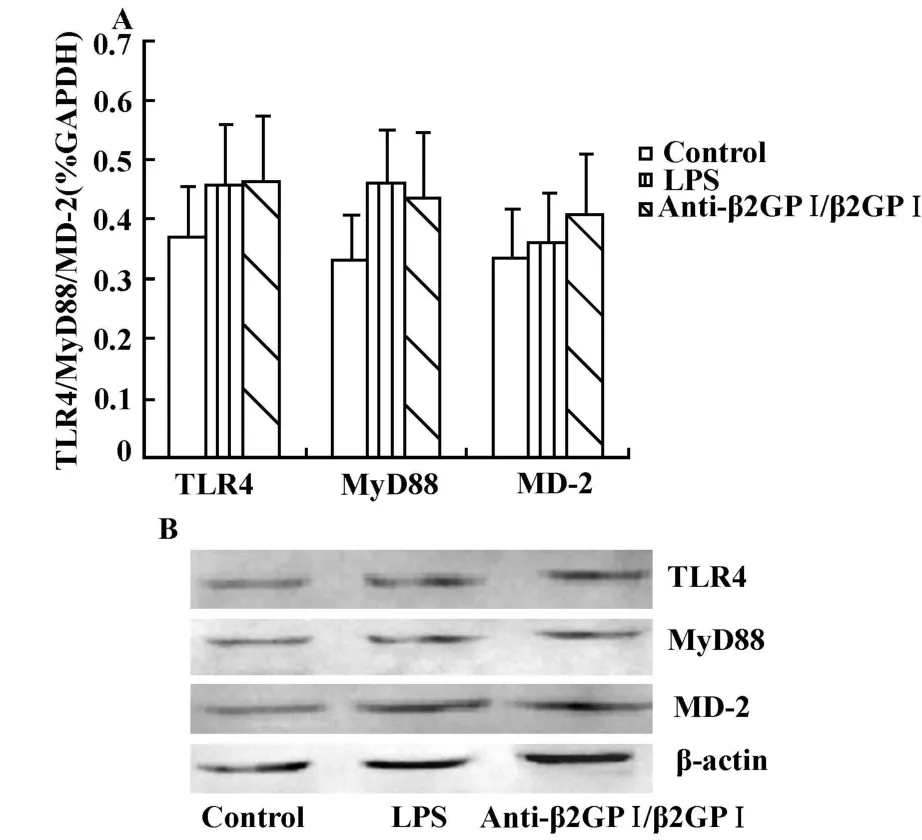
图4 紫杉醇抑制 anti-β2GPⅠ/β2GPⅠ复合物诱导的 THP-1细胞 TLR4、MyD88、MD-2 mRNA(A)及蛋白(B)的表达Fig.4 Paclitaxel inhibits anti-β2GPⅠ/β2GPⅠ-induced THP-1 cells TLR4,MyD88,MD-2 mRNA(A)and protein(B)expression
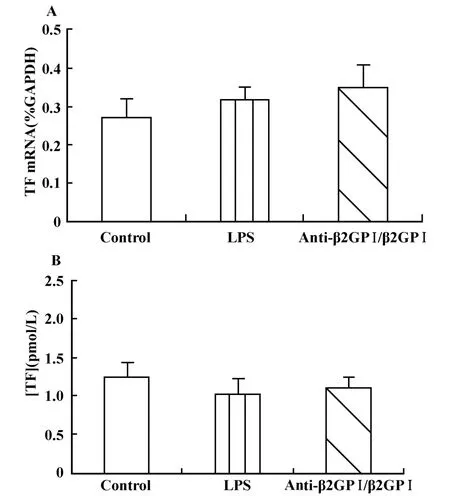
图5 紫杉醇抑制 anti-β2GPⅠ/β2GPⅠ复合物诱导的 THP-1细胞 TF mRNA表达(A)及 TF活性(B)Fig.5 Paclitaxel inhibits anti-β2GPⅠ/β2GPⅠ-induced THP-1cells TF mRNA(A)expression and TF activity(B)
2.5 紫杉醇抑制anti-β2GPⅠ/β2GPⅠ诱导THP-1细胞TF表达 上述结果表明紫杉醇能够抑制TLR4及相关分子的表达。本实验进一步观察紫杉醇抑制TLR4表达以后,是否影响 anti-β2GPⅠ/β2GPⅠ复合物诱导THP-1细胞TF的表达。结果显示:经紫杉醇预处理的THP-1细胞,anti-β2GPⅠ/β2GPⅠ复合物刺激后,与Control相比,细胞的TF mRNA表达(图5A)和TF活性(图5B)均无明显变化(P>0.05),表明TLR4及其相关分子在anti-β2GPⅠ/β2GPⅠ复合物诱导THP-1细胞表达TF的过程中至关重要。
3 讨论
Toll样蛋白最早发现于果蝇,它是果蝇对抗病原微生物感染中的重要受体。接着Medzhitov[10]等发现哺乳动物体内有与果蝇相似的Toll蛋白,并命名为Toll样受体(TLRs)。至今在人类已发现11种TLRs(TLR1~TLR11),TLR4是第一个被认识的人类Toll样受体蛋白,广泛分布于单核巨噬细胞、淋巴细胞及肝脏、脾脏等组织,是人类天然免疫的重要受体。TLR4属于Ⅰ型跨膜蛋白,由胞外区、胞浆区和跨膜区三个部分组成,主要参与由LPS诱发的信号转导。最早发现LPS的识别受体是CD14,但由于CD14无跨膜结构,不能将信号转导至胞内,TLR4及MD-2的发现是对LPS认识的突破性进展。MD-2是一个小分子分泌蛋白,正常情况下,单核细胞仅有少量表达,在LPS的刺激作用下,MD-2分泌增加,同时促进TLR4向细胞膜转移和表达。在对LPS的识别过程中,TLR4和MD-2以复合物的形式作为共同受体,缺一不可[11]。TLR4一旦活化,有两条途径参与TLRs的激活及后续信号转导,主要区别在于其胞内接头蛋白的不同,由此分为MyD88依赖性途径和MyD88非依赖性途径。其中MyD88通过其羧基(C)端与TLR4胞内区发生同源性相互作用,其氨基(N)端(又名死亡结构域)又招募下一个信号蛋白,最终活化NF-κ B和MAPK信号通路,参与炎症、肿瘤及其他多种疾病的病理过程[12]。
近年来的研究提示TLR4与APS病理机制密切相关[13],APL诱导单核细胞表达TF可能涉及到TLR4。本研究组采用流式细胞分析,发现anti-β2 GPⅠ/β2GPⅠ复合物刺激THP-1细胞后TLR4表达显著增加(结果未显示)。这一有趣的结果促使我们深入探讨TLR4及相关信号分子在anti-β2GPⅠ/β2GPⅠ复合物诱导THP-1细胞表达TF中的作用。我们首先明确了anti-β2GPⅠ/β2GPⅠ复合物对THP-1细胞TF表达的诱导作用(图1)。然后,将anti-β2GPⅠ/β2GP Ⅰ复合物刺激过的THP-1细胞裂解物通过β2GPⅠ-Affi-Gel亲和层析柱,利用抗TLR4抗体分析经盐洗脱液后样本中是否含有TLR4。结果验证,细胞膜上TLR4能够结合到 β2GPⅠ-Affi-Gel柱上, Western 蛋白印迹显示洗脱液中有TLR4的反应条带(图2所示)。在此基础上进一步观察 anti-β2GPⅠ/β2GPⅠ复合物刺激THP-1细胞后,TLR4及其相关信号启动分子MD-2和MyD88的表达情况。结果发现,antiβ2GPⅠ/β2GPⅠ复合物能够产生与LPS相同的刺激效应,显著增加细胞表达TLR4、MD-2及MyD88 mRNA及蛋白的水平(图3)。本小组前期研究表明,单核细胞表面的膜联蛋白A2(AnnexinA2)可作为antiβ2GPⅠ/β2GPⅠ复合物的受体,介导复合物与细胞结合[14,15]。然而Annexin A2缺乏膜内结构,不能将胞外的信号转导至细胞内,TLR4可能与Annexin A2组成复合受体,参与其信号转导过程,本小组正在进行这方面的深入研究。另外,研究表明在分子结构上,β2GPⅠ与 TLR4的特异性配体——某些病毒或细菌的结构存在相似性[16,17],因此,β2GPⅠ是否能直接刺激TLR4的表达并与其结合,从而引发后续的信号转导,值得探讨。总之,本研究表明TLR4及其信号转导分子在 anti-β2GPⅠ/β2GPⅠ复合物作用于细胞过程中担当重要角色。
为充分阐明TLR4及其信号分子在anti-β2GPⅠ/β2GPⅠ复合物刺激THP-1细胞表达TF中的作用,本实验采用TLR4途径抑制剂——紫杉醇,观察对细胞表达上述分子及TF的影响。紫杉醇(Paclitaxel)是一种常见的抗癌药,近年研究发现,紫杉醇可以通过与MD-2结合,掩盖TLR4配体的受体结合位点而起到抑制TLR4信号通路的作用[18,19]。本研究利用紫杉醇的这一特性,观察紫杉醇是否干预anti-β2GPⅠ/β2GPⅠ对THP-1细胞的作用。结果证明,紫杉醇不仅抑制了 anti-β2GPⅠ/β2GPⅠ 复合物诱导的TLR4、MD-2表达,也抑制了TLR4接头蛋白 MyD88的表达,同时也干预了细胞TF的表达。必须强调的是,在用紫杉醇进行实验的过程中,我们通过预实验选择合适浓度及作用时间,排除了紫杉醇本身对细胞的毒性影响。
综上所述,本研究进一步明确了anti-β2GPⅠ/β2GPⅠ复合物刺激单核细胞株THP-1表达TF的作用;证明细胞膜TLR4 能够与β2GPⅠ结合;anti-β2GPⅠ/β2GPⅠ复合物通过TLR4信号转导途径,最终促进细胞表达TF,从而参与APS血栓形成。紫杉醇可以干预这一过程,提示可作为APS血栓形成的预防及治疗药物应用。
1 Miyakis S,Lockshin M D,Atsumi T et al.International consensus statement on an update of the classification criteria for definite antiphospholipid syndrome(APS)[J].Thromb Haemost,2006;4(2):295-306.
2 Bas de Laat H,Derksen R H,de Groot P G.Beta2-glycoprotein I,the playmaker of the antiphospholipid syndrome[J].Clin Immunol,2004;112(2):161-168.
3 周 红,谷俊侠,许文荣.APS IgG通过非Fc受体途径诱导血液单核细胞表达TF活性[J].中国免疫学杂志,2003;19(8):561-569.
4 Bohgaki M,Atsumi T,Yamashita Y et al.The p38mitogen-activated protein kinase(MAPK)pathway mediates induction of the tissue factorgene in monocytes stimulated with human monoclonal anti-beta2glycoprotein I antibodies[J].Int Immunol,2004;16(11):1633-1641.
5 Zhou H,Wolberg A S,Roubey R A.Characterization of monocyte tissue factor activity induced by IgG antiphospholipid antibodies and inhibition by dilazep[J].Blood,2004;104(8):2353-2358.
6 Lopez-pedrera C,Buendra P,Cuadrado M J et al.Antiphospholipid antibodies from patients with the antiphospholipid syndrome induce monocyte tissue factor expression through the simultaneous activation of NF-κ B/Rel proteins via the p38 mitogen-activated protein kinase pathway,and of the MEK-1/ERK pathway[J].Arthritis Rheum,2006;54(1):301-311.
7 Lu Y C,Yeh W C,Ohashi P S.LPS/TLR4 signal transduction pathway[J].Cytokine,2008;42(2):145-151.
8 Gradisar H,KeberM M,PristovsekP et al.MD-2 as the target of curcumin in the inhibition of response to LPS[J].J Leukoc Biol,2007;82(4):968-974.
9 Resman N,Vasl J,Oblak A et al.Essential roles of hydrophobic residues in bothMD-2 and toll-like receptor 4 in activation by endotoxin[J].J Biol Chem,2009;284(22):15052-15060.
10 Medzhitov R,Preston-Hurlburt P,Janeway J C.A human homologue of the drosophila Toll protein signals activation of adaptive immunity[J].Nature,1997;388(6640):394-397.
11 Resman N,Vasl J,Oblak A et al.Essential roles of hydrophobic residues in both MD-2 and toll-like receptor 4 in activation by endotoxin[J].J Biol Chem,2009;284(22):15052-15060.
12 Raetzsch C F,Brooks N L,Alderman J M et al.Lipopolysaccharide inhibition of glucose production through the Toll-like receptor-4,myeloid differentiation factor 88,and nuclear factor kappa B pathway[J].Hepatology,2009;50(2):592-600.
13 Sorice M,Longo A,Capozzi A et al.Anti-β2-glycoprotein I antibodies induce monocyte release of tumornecrosis factora and tissue factor by signal transduction pathways involving lipid rafts[J].Arthritis Rheum,2007;56(8):2687-2697.
14 Zhou H,Ling S C,Yu Y et al.Involvement of annexin A2 in anti-β2GPⅠ/β2GP Ⅰ-induced tissue factor expression on monocytes[J].Cell Res,2007;17(8):737-739.
15 Zhou H,Wang H,Li N et al.AnnexinA2 mediates anti-beta2GPⅠ-induced tissue factor expresssion on monocytes[J].Int J Mol Med,2009;24(4):557-562.
16 Raschi E,Testoni C,Bosisio D et al.Role of the MyD88 transduction signaling pathway in endothelial activation by antiphospholipid antibodies[J].Blood,2003;101(9):3495-3500.
17 Meroni P L,Sepp N,Tincani A et al.Endothelium and the brain in CNS lupus[J].Lupus,2003;12(12):919-928.
18 ZimmerS M,Liu J,Clayton J L et al.Paclitaxel binding to human and murine MD-2[J].J Biol Chem,2008;283(41):27916-27926.
19 Nesman N,Gradisar H,Vasl J et al.Taxanes inhibit humanTLR4 signaling by binding to MD-2[J].FEBS Let,2008;582(28):3929-3934.