豆类丝核菌次级代谢产物对免疫抑制小鼠免疫功能的影响①
2010-06-21杨鸣琦赵守中西北农林科技大学动物医学院杨陵712100
朱 超 杨鸣琦 赵守中 (西北农林科技大学动物医学院,杨陵 712100)
环磷酰胺(Cyclophosphamide,CTX)属烷化剂类,是一种有效的治疗恶性肿瘤化疗剂,又是一种免疫抑制剂,长期使用可导致机体免疫功能下降,这使其临床应用受到限制[1]。因此,寻找能够减弱CTX免疫抑制作用、又不影响其化疗作用的理想方法或药物具有重要临床意义。
豆类丝核菌次级代谢产物中的主要成分为苦马豆素(Swainsonine,SW),是具有直接杀死肿瘤细胞和免疫调节双向作用的新型抗肿瘤药物[2],研究表明,豆类丝核菌次级代谢产物能够很好地刺激荷瘤动物的T淋巴细胞,使其活性升高,从而促进机体T淋巴细胞识别肿瘤特异性抗原,达到杀死肿瘤细胞的作用[3]。最新研究发现,豆类丝核菌次级代谢产物对小鼠骨髓抑制和心肌毒性具有保护作用[4,5],并且其主要成分SW对正常小鼠细胞免疫功能的影响进行了研究[6],但SW能否颉颃化疗药物的免疫抑制作用以及SW的有效治疗剂量还未见报道,本试验利用CTX构建小鼠免疫抑制模型,研究豆类丝核菌次级代谢产物对CTX致免疫抑制小鼠免疫功能的影响,并探讨其抗肿瘤作用机制。
1 材料与方法
1.1 材料
1.1.1 试验动物 近交系昆明种小鼠50只,6~7周龄,体重(20±2)克,雌雄各半,购自第四军医大学实验动物中心,合格证号SCXK(军)2002-05。
1.1.2 试验用药的制备与配置 将豆类丝核菌菌种3.2871A(西北农林科技大学动物病理学实验室提供)接种于灭菌查氏蛋白胨培养基中,26℃培养14~16天,挑出菌丝,抽滤去除发酵液中的不溶杂质,即为豆类丝核菌次级代谢产物原液,气相色谱测其SW含量为980.85 mg/L,流通蒸汽灭菌45分钟,用时分别浓缩或稀释成苦马豆素含量分别为8、16和32 mg/kg的3种溶液,流通蒸汽灭菌备用。
1.1.3 主要试剂及仪器 四甲基偶氮唑盐(MTT)、植物血凝素P(PHA-P),均为Sigma公司产品;小牛血清,兰州民海生物工程有限公司;RPMI1640培养液,Gibco公司产品;二甲基亚砜(DMSO),Amresco公司产品;注射用环磷酰胺,0.2 g/瓶,山西普德药业有限公司,批号20080702;绵羊红细胞(SRBC)悬液;补体(3只无特定病原豚鼠的新鲜血清1∶10稀释);全自动酶标仪,Thermo公司产品,紫外分光光度仪,CO2培养箱等。其他试剂均为国产分析纯级。
1.1.4 分组给药与免疫抑制模型的制备 将50只小鼠随机分为5组,每组10只,Ⅰ组正常对照组,Ⅱ组(CTX模型组),Ⅲ组(SW低剂量组),Ⅳ组(SW中剂量组),Ⅴ组(SW高剂量组),Ⅰ、Ⅱ组灌胃生理盐水0.4 ml/只,每日1次,共 11次,Ⅲ 、Ⅳ、Ⅴ组分别灌胃浓度为 8、16、32 mg/kg 的 SW,每日 1次,共11次;第6天在灌胃2小时后,Ⅱ、Ⅲ、Ⅳ、Ⅴ组腹腔注射CTX 80 mg/kg,每日 1次,连续3次,制备CTX致小鼠免疫抑制模型。
1.2 方法
1.2.1 白细胞计数及免疫器官指数测定 末次给药24小时后分别于眼眶静脉丛取血20 μ l,吹入盛有0.38 ml白细胞稀释液的试管中,摇匀,将盖玻片放在白细胞计数板正中,充液,静置2~3分钟,计数白细胞。然后用颈椎脱臼法处死小鼠,摘取小鼠脾脏和胸腺,称重后计算脏器指数(脏器重量/体重)。
1.2.2 腹腔巨噬细胞吞噬中性红试验 在无菌条件下,每只小鼠腹腔注射灭菌生理盐水5 ml,轻轻按揉腹部2~3分钟,抽回腹腔液。用不完全RPMI1640洗涤离心后。再用含10%小牛血清的RPMI1640培养液调细胞浓度至 1×106ml-1,取 100 μ l于96孔板,另加完全 RPMI1640 100 μ l为空白调零孔,37℃5%CO2培养箱培养4小时,甩去培养基,贴壁细胞即为腹腔巨噬细胞单层,每孔加入0.1%中性红生理盐水100 μ l,继续培养30分钟,弃上清液,用PBS液洗2次,每孔加入细胞溶解液(醋酸∶无水乙醇=1∶1)100 μ l,室温下放置过夜。待细胞溶解后,用酶标仪在492 nm处测定OD值[7,8]。
1.2.3 脾脏淋巴细胞转化试验 采用噻唑蓝(MTT)比色法[9],给药结束后处死动物,无菌取脾,制备脾细胞悬液,用含10%小牛血清的 RPMI1640培养液调细胞浓度至1×106ml,取100 μ l细胞悬液加入96 孔培养板 ,并加入 50 μ l PHA-P(终浓度5 μ g/ml),置37℃5%CO2培养箱培养 66小时,弃上清,加5 g/L MTT 10μ l/孔孵育4小时,每孔加DMSO 100 μ l,震荡10分钟,用酶标仪在492 nm处测定OD值。以各样本的OD值代表淋巴细胞的转化能力。
1.2.4 血清溶血素水平测定[10]用绵羊红细胞(SRBC)为抗原,按上述方法分组及给药,第7天各组小鼠腹腔注射5%SRBC悬液0.4 ml诱导初次免疫应答,第11天末次给药1小时后眼球取血,将血清稀释100倍,取 1 ml稀释血清,加入5%SRBC悬液0.5 ml及10%补体血清0.5 ml,37℃温育10分钟,0℃中止反应。1 500 r/min离心,取上清液用紫外分光光度仪波长413 nm处测定,以OD值作为判定血清溶血素水平的指标。
1.2.5 免疫抑制小鼠NK细胞杀伤活性测定 采用MTT法检测[11],靶细胞为L929细胞株,以下列公式计算:杀伤率(%)=(靶细胞OD值-实验组OD值)/靶细胞OD值×100%。
1.3 数据统计分析 实验数据用SPSS17.0软件分析,结果以±s表示,采用方差分析,各组间用LSD法比较分析。
2 结果
2.1 对免疫抑制小鼠白细胞数及免疫器官重量的影响 由表1可见,与Ⅰ组相比较,Ⅱ组白细胞数有明显的下降(P<0.01),与Ⅱ组相比较,Ⅲ、Ⅳ、Ⅴ组的白细胞数都有明显的提高(P<0.01或 P<0.05),而Ⅳ组恢复效果较好,脏器指数虽有所降低,但无统计学意义(P>0.05)。说明豆类丝核菌次级代谢产物具有改善免疫抑制小鼠造血功能的作用。2.2 对免疫抑制小鼠腹腔巨噬细胞吞噬中性红的影响 由表2可看出,与Ⅰ组相比较,Ⅱ组小鼠腹腔巨噬细胞吞噬中性红能力极显著低于Ⅰ组(P<0.01)。与Ⅱ组相比较,Ⅲ、Ⅳ组OD492值均高于Ⅱ组(P<0.05或P<0.01),Ⅴ组与Ⅱ组相比,差异无统计学意义(P>0.05)。说明豆类丝核菌次级代谢产物能够显著提高免疫抑制小鼠腹腔巨噬细胞的吞噬能力。
表1 豆类丝核菌次级代谢产物对免疫功能抑制小鼠白细胞数量和免疫器官指数的影响(n=10,±s)Tab.1 Effects of the Secondary Metabolites of Rhizotonia leguminicola on WBC,thymus index,and spleen index of immunosuppressed mice(n=10, ±s)
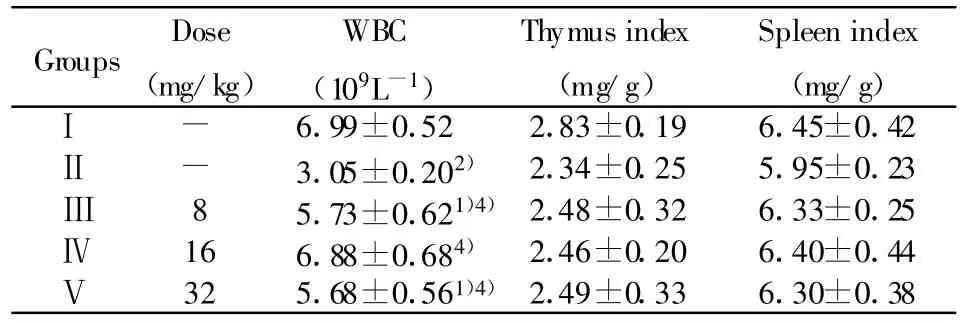
表1 豆类丝核菌次级代谢产物对免疫功能抑制小鼠白细胞数量和免疫器官指数的影响(n=10,±s)Tab.1 Effects of the Secondary Metabolites of Rhizotonia leguminicola on WBC,thymus index,and spleen index of immunosuppressed mice(n=10, ±s)
Note:Compared with groupⅠ,1)means significant difference(P<0.05),2)means very significant difference(P<0.01);Compared with groupⅡ,3)means significant difference(P<0.05),4)means very significant difference(P<0.01).Following the same.
Groups Dose(mg/kg)WBC(109L-1)Thymus index(mg/g)Spleen index(mg/g)Ⅰ - 6.99±0.52 2.83±0.19 6.45±0.42Ⅱ - 3.05±0.202) 2.34±0.25 5.95±0.23Ⅲ 8 5.73±0.621)4)2.48±0.32 6.33±0.25Ⅳ 16 6.88±0.684) 2.46±0.20 6.40±0.44Ⅴ 32 5.68±0.561)4)2.49±0.33 6.30±0.38
表2 豆类丝核菌次级代谢产物对免疫功能抑制小鼠腹腔巨噬细胞吞噬中性红的影响(n=10,±s)Tab.2 Effects of the SecondaryMetabolites of Rhizotonia leguminicola on the phagocytosis of peritoneal macrophages in immunosuppressed mice(n=10,±s)
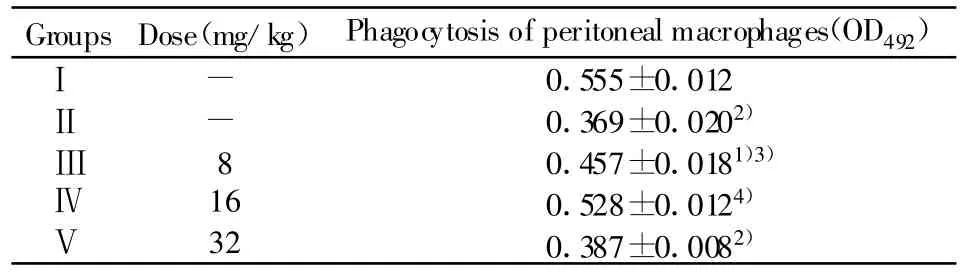
表2 豆类丝核菌次级代谢产物对免疫功能抑制小鼠腹腔巨噬细胞吞噬中性红的影响(n=10,±s)Tab.2 Effects of the SecondaryMetabolites of Rhizotonia leguminicola on the phagocytosis of peritoneal macrophages in immunosuppressed mice(n=10,±s)
Groups Dose(mg/kg)Phagocytosis of peritoneal macrophages(OD492)Ⅰ - 0.555±0.012Ⅱ - 0.369±0.0202)Ⅲ8 0.457±0.0181)3)Ⅳ 16 0.528±0.0124)Ⅴ 32 0.387±0.0082)
表3 豆类丝核菌次级代谢产物对免疫功能抑制小鼠脾淋巴细胞转化的影响(n=10,±s)Tab.3 Effects of the Secondary Metabolites of Rhizotonia leguminicola on lymphocyte transformation of immunosuppressed mice(n=10,±s)
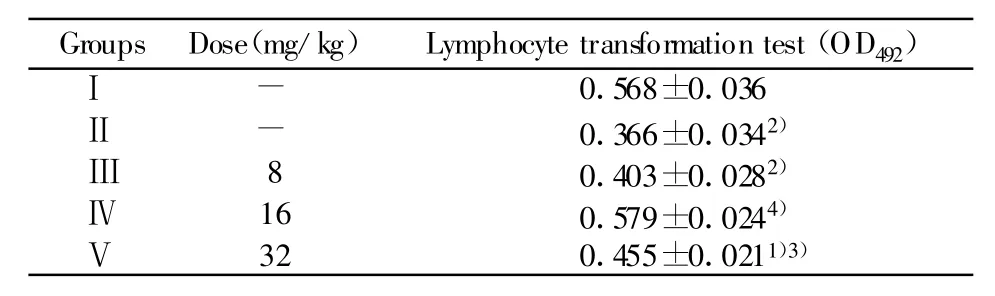
表3 豆类丝核菌次级代谢产物对免疫功能抑制小鼠脾淋巴细胞转化的影响(n=10,±s)Tab.3 Effects of the Secondary Metabolites of Rhizotonia leguminicola on lymphocyte transformation of immunosuppressed mice(n=10,±s)
Groups Dose(mg/kg) Lymphocyte transformation test(OD492)Ⅰ0.568±0.036Ⅱ-0.366±0.0342)-Ⅲ0.403±0.0282)Ⅳ8 16 0.579±0.0244)Ⅴ32 0.455±0.0211)3)
2.3 对免疫抑制小鼠脾淋巴细胞转化的影响 由表3可看出,与Ⅰ组相比,Ⅱ组小鼠脾淋巴细胞转化极显著低于Ⅰ组(P<0.01),说明环磷酰胺对小鼠脾淋巴细胞转化造成了抑制。Ⅳ组、Ⅴ组OD492值均高于Ⅱ组(P<0.05或P<0.01),且Ⅳ组效果最好。说明豆类丝核菌次级代谢产物能够显著提高免疫抑制小鼠脾淋巴细胞转化。
2.4 对免疫抑制小鼠血清溶血素水平影响 由表4可看出,与Ⅰ组相比,Ⅱ组小鼠血液中溶血素水平极显著低于Ⅰ组(P<0.01),说明环磷酰胺抑制了浆细胞分泌抗体的能力。Ⅲ、Ⅳ组均极显著高于Ⅱ组(P<0.01),且Ⅳ组效果最好,Ⅴ组显著高于Ⅱ组(P<0.05)。说明豆类丝核菌次级代谢产物能够显著改善免疫抑制小鼠体液免疫应答功能。
表4 豆类丝核菌次级代谢产物对免疫功能抑制小鼠血清溶血素水平影响(n=10,±s)Tab.4 Effects of the Secondary Metabolites of Rhizotonia leguminicola on serumlevels of hemolysin in immunosuppressed mice(n=10,±s)

表4 豆类丝核菌次级代谢产物对免疫功能抑制小鼠血清溶血素水平影响(n=10,±s)Tab.4 Effects of the Secondary Metabolites of Rhizotonia leguminicola on serumlevels of hemolysin in immunosuppressed mice(n=10,±s)
Groups Dose(mg/kg) Serum levels of hemolysin(OD413)Ⅰ0.377±0.015Ⅱ-0.195±0.0352)-Ⅲ0.324±0.0224)Ⅳ16 0.353±0.0374)Ⅴ32 0.292±0.0411)3)8
表5 豆类丝核菌次级代谢产物对免疫功能抑制小鼠NK细胞杀伤活性影响(n=10,±s)Tab.5 Effects of the Secondary Metabolites of Rhizotonia leguminicola on killing activity of NK cells in immunosuppressed mice(n=10,±s)
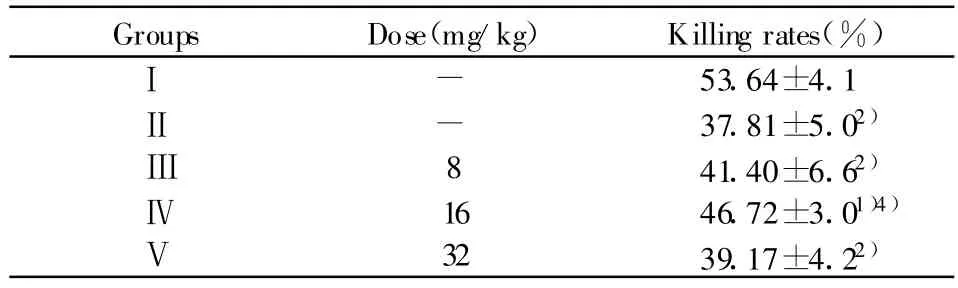
表5 豆类丝核菌次级代谢产物对免疫功能抑制小鼠NK细胞杀伤活性影响(n=10,±s)Tab.5 Effects of the Secondary Metabolites of Rhizotonia leguminicola on killing activity of NK cells in immunosuppressed mice(n=10,±s)
Groups Dose(mg/kg) Killing rates(%)Ⅰ53.64±4.1Ⅱ-37.81±5.02)-Ⅲ8 41.40±6.62)Ⅳ16 46.72±3.01)4)Ⅴ32 39.17±4.22)
2.5 对免疫抑制小鼠NK细胞杀伤活性影响 由表5可看出,与Ⅰ组相比,Ⅱ组小鼠NK细胞杀伤率极显著低于Ⅰ组(P<0.01),说明环磷酰胺造成了小鼠NK细胞杀伤活性抑制。与Ⅱ组相比,Ⅳ组小鼠NK细胞杀伤率显著高于Ⅱ组(P<0.01),Ⅲ组和Ⅴ组,差异无统计学意义(P>0.05)。说明豆类丝核菌次级代谢产物能增强免疫抑制小鼠NK细胞杀伤活性。
3 讨论
早前研究表明,豆类丝核菌次级代谢产物可作为免疫调节剂、肿瘤转移及扩散抑制剂、抗病毒和细胞保护剂等药物使用,还可以促进骨髓增殖,能有效逆转致死性辐照或高剂量化疗所造成的骨髓抑制及随后发生的嗜中性白细胞减少症,并初步证明对人的恶性肿瘤有治疗作用,因此,豆类丝核菌次级代谢产物具有很重要的抗肿瘤药物开发价值[12,13]。
在制备免疫抑制动物模型的过程中,CTX剂量过低,不仅不能对机体免疫功能起抑制作用,反而可能会有促进作用,而免疫细胞在免疫应答和免疫调节过程中都需要被充分激活,随着给药时间的延长可能其抑制作用的效果会较差,甚至会使机体的免疫力增强[14,15],因此CTX的合适给药量和给药时间是十分关键的。本研究采用临床常用的抗肿瘤烷化剂CTX作为免疫抑制剂,经腹腔注射CTX 80 mg/(kg·d),连续3天方法制造免疫抑制模型[11],结果显示注射CTX后小鼠的各项免疫指标均明显降低(P<0.01),说明建模成功。
本实验结果表明,经豆类丝核菌次级代谢产物灌胃后,各组小鼠的外周血白细胞数显著高于Ⅱ组(P<0.01),Ⅳ组恢复较好;胸腺和脾脏是机体主要的免疫器官,免疫抑制剂可使其萎缩,而免疫增强剂可使其增重,因此免疫器官相对重量的变化在免疫评价中占有重要地位,从脏器指数的检测来看,各组小鼠给予豆类丝核菌次级代谢产物后,脾脏指数和胸腺指数均差异不显著(P>0.05)这与文献[4]报道的一致。巨噬细胞的吞噬能力是衡量机体非特异性免疫功能的指标之一,它不仅能直接吞噬病原微生物及外来异物,还能释放溶菌素,因而在免疫应答中起重要作用。结果显示,Ⅲ组和Ⅳ组小鼠腹腔巨噬细胞吞噬中性红的能力明显增强,Ⅳ组基本恢复正常。脾淋巴细胞转化是衡量细胞免疫功能的指标之一,结果显示,注射CTX后Ⅱ组的OD492极显著低于Ⅰ组(P<0.01),给予豆类丝核菌次级代谢产物后,Ⅳ组和Ⅴ组的脾淋巴细胞转化显著增强(P<0.05或P<0.01),这与文献[6]报道的应用纯品SW效果基本一致。血清中的溶血素是B细胞受到红细胞刺激后产生的一种抗体,故可反映机体的体液免疫水平。本实验结果显示,注射CTX后Ⅱ组小鼠的溶血素水平显著降低(P<0.01),给予豆类丝核菌次级代谢产物后,Ⅲ组和Ⅳ组均显著高于Ⅱ组,并且当实验用药剂量为16 mg/(kg·d)时,即第Ⅳ组,免疫抑制小鼠体液免疫功能恢复至接近正常水平,说明豆类丝核菌次级代谢产物中剂量[16 mg/(kg·d)]能增强免疫抑制小鼠的体液免疫功能。NK细胞是主要的固有免疫细胞,同时也是一类异质多功能的杀伤淋巴细胞,无需抗原刺激即可对靶细胞产生直接的杀伤作用。因此,NK细胞杀伤活性高低直接影响机体的免疫功能[16]。NK细胞杀伤活性测定结果显示,Ⅳ组与Ⅱ组相比差异极显著(P<0.01),Ⅲ组和Ⅴ组,差异无统计学意义(P>0.05)。说明豆类丝核菌次级代谢产物中剂量[16 mg/(kg·d)]能增强免疫抑制小鼠NK细胞杀伤活性。
以上实验结果表明,豆类丝核菌次级代谢产物剂量为8、16 mg/(kg·d)均可提高免疫抑制小鼠的外周血白细胞数,颉颃CTX所致的小鼠腹腔巨噬细胞吞噬功能的降低,恢复免疫抑制小鼠血清溶血素水平、脾脏淋巴细胞转化以及NK细胞杀伤活性,在各免疫指标中虽然Ⅴ组也发生了一定变化,但不如Ⅳ组效果好,这可能是豆类丝核菌次级代谢产物中的SW的含量过大造成的[17]。
综上所述,豆类丝核菌次级代谢产物中剂量[16 mg/(kg·d)]对CTX致免疫抑制小鼠的免疫功能有一定的恢复和提高作用,这可能是其抗肿瘤的作用机制之一。
1 李 瑞.药理学[M].北京:人民卫生出版社,1999:372-372.
2 Jacob G S.Glycosylation inhibitors in biology and medicine[J].Opin Struct Biol,1995;5(5):605-611.
3 张 黎,杨鸣琦,黄增荣 et al.豆类丝核菌次级代谢产物对荷瘤小鼠T淋巴细胞活性的影响[J].军医进修学院学报,2004;25(2):103-104.
4 郭卫华,杨鸣琦,张 伟 et al.豆类丝核菌次级代谢产物对化疗骨髓抑制小鼠的保护作用[J].西北农林科技大学学报:自然科学版,2009;37(8):1-5.
5 杨 萍,杨鸣琦,熊和丽 et al.豆类丝核菌次级代谢产物对阿霉素所致小鼠骨髓和心肌毒性的保护作用研究[J].西北农业学报,2007;16(4):42-46.
6 张志敏,王建华,赵兴华 et al.苦马豆素对小鼠细胞免疫功能的影响[J].西北农林科技大学学报:自然科学版,2008;36(2):62-64.
7 张李峰,刘燕岭,尹少甫.醋酸舍莫瑞林的免疫活性研究[J].中国公共卫生杂志,2004;20(11):1336-1337.
8 刘 欣,李 萍,梁代英 et al.养阴益气合剂增强外源性糖皮质激素小鼠免疫功能的研究[J].中国中医基础学杂志,2006;12(5):352.
9 徐叔云.药理实验方法学[M].第 3版.北京:人民卫生出版社,2001:1426-1427.
10 陈 奇.中药药理研究方法学[M].北京:人民卫生出版社,1993:369-370.
11 赵弋清,罗 霞,陈东辉 et al.不同剂量环磷酰胺诱导正常小鼠免疫抑制的对比研究[J].免疫学杂志,2005;21(3):122-128.
12 邹恒琴,徐 峰,张忠义 et al.一种具有前景的抗癌药苦马豆素的研究进展[J].中草药,1997;28(7):437-439.
13 Rooprai H K,Kandanearatchi A,Maidment S L et al.Evaluation of the effects of swainsonine,captopril,tangeretin and nobiletin on the biological behaviour of brain tumour cell in vitro[J].Neuropothol Appl Neurobiol,2001;27(1):29-39.
14 Turk J L,Parker D.Effect of cyclophosphamide on immunological control mechanisms[J].Immunol Rev,1982;65:99-133.
15 WinkelsteinA,Mikulla J M,Nankin H R et al.Mechanisms of immunosuppression:Effects of cyclophosphamide on lymphocytes[J].Lab Clin Med,1972;80(4):506-513.
16 吴克枫,冯燕梅,俞 红 et al.不同剂量环磷酞胺对小鼠的免疫毒性研究[J].贵州医药,1999;23(2):1-92.
17 杨鸣琦,曹光荣.苦马豆素的毒性、代谢与用途[J].动物医学进展,1997;18(4):20-25.