香菇多糖对吲哚胺2-3双加氧酶表达的调控作用及其与原发性乳腺癌细胞增殖关系的探讨
2010-06-20梁松岳
伍 奕,曾 勇,梁松岳
(湖南省肿瘤医院,湖南 长沙 410013)
传统医学对于肿瘤的治疗模式主要包括手术、放疗、化疗三种方式。研究表明,传统的治疗模式能够治愈部分肿瘤患者,不是由于杀死了全部肿瘤细胞,而是由于当肿瘤细胞负荷明显降低时,机体的免疫功能恢复,清除了微小残留病灶或明显抑制了残留肿瘤细胞的增殖。这说明机体免疫对肿瘤生长、转化有重要意义[1-3]。吲哚胺2-3双加氧酶能够催化色氨酸分子中的吲哚环氧化裂解,是犬尿酸分解代谢途径的限速酶,体内的吲哚胺2-3双加氧酶在细菌和病毒、同种异体器官排斥反应以及肿瘤的发展过程中表达增加,并可以通过改变微环境色氨酸及其代谢产物的局部浓度,达到抑制肿瘤抗原特异性克隆增生的免疫细胞数量以及诱导免疫细胞凋亡的方式,帮助肿瘤细胞免受机体免疫系统的攻击[4-5]。目前,临床上通过各种途径调节机体的免疫系统来达到特异性或非特异性辅助治疗肿瘤的治疗模式已经得到推广。其中,以特异性较高的免疫药物针对特异性的靶点开展治疗目前还存在一定的技术上的壁垒。但是,通过应用一些免疫调节剂并依靠非特异性地增强机体的免疫功能,激活机体的抗肿瘤免疫应答,以达到治疗肿瘤的模式已经在临床广泛的推广。临床观察发现晚期肿瘤病人大多伴有免疫功能紊乱,因此在手术切除肿瘤后使用免疫增强药物,往往可以到达调整机体的免疫功能,提高机体抗肿瘤的作用,减少肿瘤复发的作用[6-7]。其中,香菇多糖作为一种辅助性的免疫调节剂在临床的使用较为广泛,该药物的使用对于提高抗肿瘤药物的治疗效果以及缓解患者症状方面均显现出较高的应用价值。香菇多糖作为一种免疫调节剂发挥作用的机制目前有着多种理论探讨,该机制是否与机体内吲哚胺2-3双加氧酶的转录与表达间存在某种联系,目前还没有相关的探讨。介于以上背景,笔者设计本次观察,旨在通过观察香菇多糖对于乳腺癌细胞中吲哚胺2-3双加氧酶表达的影响的初步探讨,力求探索香菇多糖辅助性治疗肿瘤疗效的机制,为解除机体对肿瘤的免疫耐受,提高肿瘤的治疗效果提供理论依据。
1 资料与方法
1.1 一般资料
收集我院住院手术切除的新鲜肿瘤组织100例。其中浸润性导管癌89例、小叶癌7例、其他类型4例。根据美国肿瘤联合会制定的第六版分期标准,I期7例,IIA期25例,IIB期39例,IIIA期22例,IIIC期7例。所有病例均得到术后确切的病理学诊断。随机分为两组,香菇多糖组:浸润性导管癌41例,小叶癌3例,其他类型2例,其中,I期3例,IIA期12例,IIB期19例,IIIA期10例,IIIC期3例;空白对照组:浸润性导管癌48例,小叶癌4例,其他类型2例。其中,I期4例,IIA期13例,IIB期20例,IIIA期12例,IIIC期4例。
1.2 主要试剂
噻唑蓝(MTT)为美国Sigma公司产品;RT-PCR试剂盒购自Sigma公司;蛋白提取试剂盒购自Active Motif公司;兔抗人吲哚胺2-3双加氧酶抗体购自Alexis公司、羊抗兔二抗购自Sigma公司。
1.3 MTT法测定香菇多糖对细胞增殖的影响
在无菌条件下从刚切除的标本上取癌组织1 g,经过两次生理盐水漂洗,剪碎后放入0.25%胰蛋白酶消化液。细胞消化液经200目细胞筛过滤,制成单细胞悬液,分别加入96孔培养板中,5 000个细胞/孔。实验分香菇多糖组(分别加入香菇多糖10、20、40 uM)、空白对照组(不加药物,只加细胞悬液)。培养24 h后,每孔加入MTT溶液(5 g/L)20 uL,37℃继续孵育4 h后终止培养,吸弃孔内上清液,每孔加入150 Ul DMSO振荡15 min后利用酶标一检测各孔在570 nm波长除的吸光度值,然后计算抑制率。抑制率(%)=[1-(空白对照组A值-香菇多糖组A值)/空白对照组A值]×100%。
1.4 RT-PCR检测香菇多糖对肿瘤细胞内吲哚胺2-3双加氧酶编码基因转录的影响
取单细胞悬液,以2×105/孔的浓度接种于6孔板种。当细胞培养至约70%的覆盖率时根据加香菇多糖情况分成4组:空白对照组、香菇多糖10、20、40 uM组,培养24 h。使用Trizol抽提总RNA,按照RT-PCR试剂盒逆转录为cDNA,从cDNA上扩增目的基因。配置2.0%琼脂糖凝胶,在120 V、25 min条件下对PCR产物进行电泳检测,并用凝胶成像系统进行图片的采集。
1.5 Western Blot法检测香菇多糖对肿瘤细胞内吲哚胺2-3双加氧酶蛋白表达的影响
取单细胞悬液,以2×105/孔的浓度接种于6孔板种。根据加香菇多糖情况分成5组:空白对照组、香菇多糖10、20、40 uM组,培养24 h。总蛋白提取严格按照提取试剂盒说明书操作进行。蛋白通过SDS-聚丙烯酰胺凝胶电泳分离后,采用湿转膜法。先用5% 脱脂牛奶封闭后,再用TBST洗膜,分别加入各种一抗,4度过夜后,加入二抗室温反应1 h。洗脱后显影。根据预期分子量大小区域出现的特异性条带判断蛋白表达量的高低。应用Bio-Rad公司Quantity-one软件分析。
1.6 统计学分析
2 结果
2.1 香菇多糖对肿瘤细胞增殖的影响
MTT结果显示,香菇多糖对肿瘤细胞的增殖产生抑制效应,且该效应随药物浓度的增加而增大。其中,10、20、40 uM香菇多糖对细胞的抑制率分别为(6.4±1.19)%,(10.3±1.67)%,(23.5±3.79)%。
2.2 香菇多糖处理后各组细胞中吲哚胺2-3双加氧酶编码基因转录水平的变化
RT-PCR结果显示,香菇多糖处理细胞可以抑制肿瘤细胞中吲哚胺2-3双加氧酶编码基因的表达,结果见图1。药物处理组细胞间吲哚胺2-3双加氧酶编码基因表达呈现药物剂量依赖性,其中,40 uM香菇多糖处理组细胞中目的基因转录表达水平最低。药物处理组与对照组间比较,差异有统计学意义。具体结果见图2。
2.3 香菇多糖处理后各组细胞中吲哚胺2-3双加氧酶蛋白表达的变化
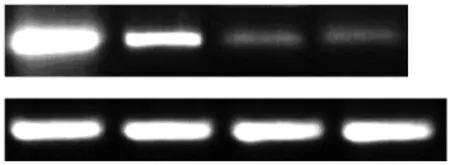
图1 香菇多糖处理2-3双加氧酶基因表达
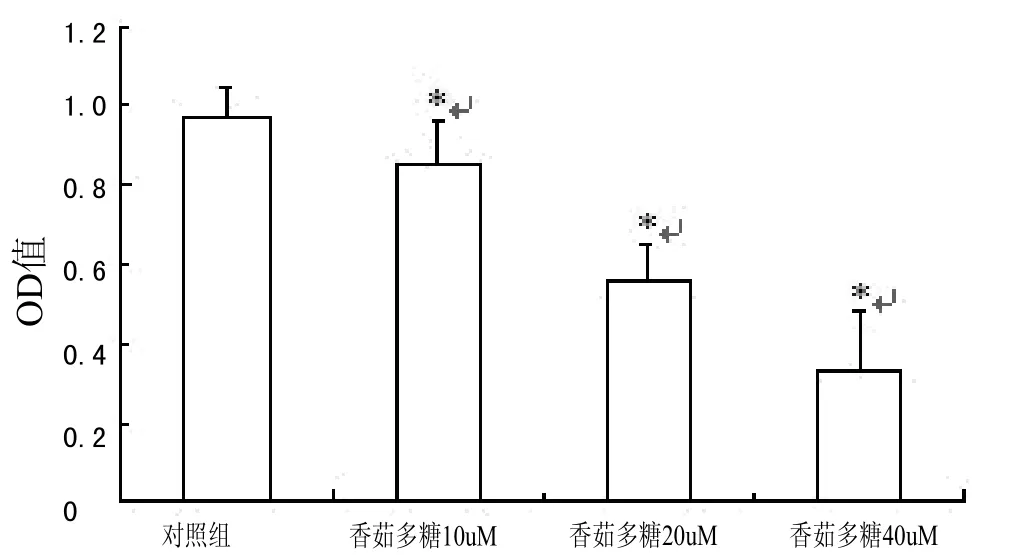
图2 吲哚胺2-3双加氧酶编码基因表达灰度分析
Western blot检测结果显示,香菇多糖作用肿瘤细胞后,吲哚胺2-3双加氧酶表达呈浓度依赖性下调趋势,与对照组比较,差异有统计学意义。具体结果见图3,图4。

图3 香菇多糖处理2-3双加氧酶蛋白表达
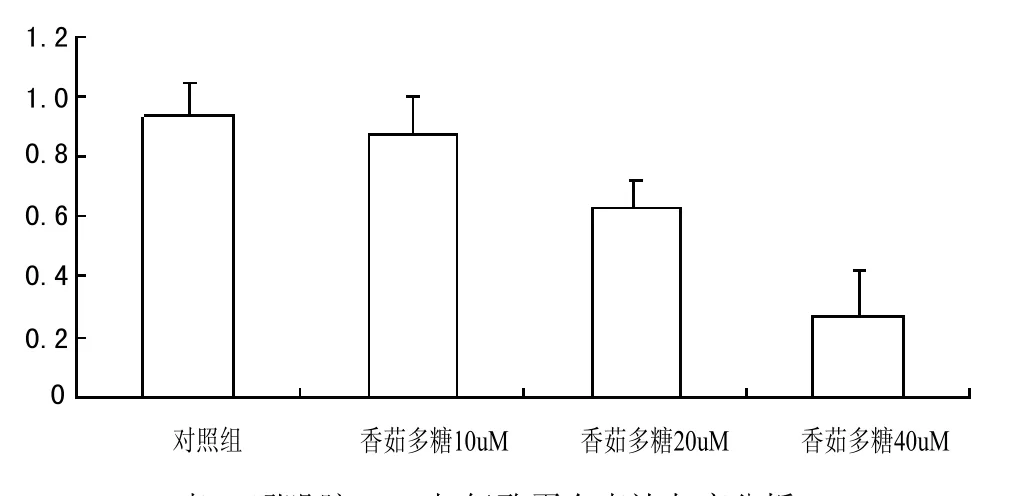
表4 吲哚胺2-3双加氧酶蛋白表达灰度分析
3 讨论
乳腺癌是女性最常见的恶性肿瘤之一,据资料统计,发病率占全身各种恶性肿瘤的7%~10%。它的发病常与遗传有关,以及40~60岁之间、绝经期前后的妇女发病率较高。乳腺癌的治疗与机体免疫系统状态的关系是一个极具挑战的领域。其中,关于乳腺癌患者自发性消退现象、许多乳腺癌病人能够带瘤生存、部分患者虽然在血液中检测出肿瘤细胞,但并未出现远处转移等等现象,均提示我们该类肿瘤的生长与机体的免疫系统的防御能力关系密切。我们有充足的里有相信乳腺癌的发生、发展以及药物的治疗效果与机体的免疫状态有着直接的因果关系[8-10]。香菇多糖是一种生物反应的调节剂,该药是继手术、放疗和化疗三大治疗手段之后的第四种治疗肿瘤的办法,它通过增强机体的抗肿瘤免疫防御反应或改变机体对肿瘤细胞的生物学效应而产生机体或细胞介导的抗肿瘤效果,发挥间接的抗肿瘤作用。长期的临床观察发现该药物具有副作用轻微、对正常细胞无杀伤作用的特点。
近年来大量的研究表明,吲哚胺2-3双加氧酶在肿瘤的免疫微环境以及肿瘤的发生过程中起重要作用。多种组织的原代肿瘤细胞以及肿瘤细胞株均高表达吲哚胺2-3双加氧酶。目前的研究明确,高表达的吲哚胺2-3双加氧酶可以导致肿瘤细胞所处的细胞微环境中色氨酸饥饿状态,使得机体的免疫细胞合成停滞于G1期,导致增殖受到抑制。另外,吲哚胺2-3双加氧酶可以通过诱导色氨酸代谢产物的细胞毒性作用,发挥对免疫细胞的直接溶解作用[11]。
为了明确香菇多糖对于乳腺癌细胞的治疗作用以及该作用对于机体免疫系统影响,作者设计了本次观察。香菇多糖对肿瘤细胞增殖作用的影响实验表明,它能够明显的降低乳腺癌细胞的增殖能力,发挥明确的抗肿瘤作用,并且这种作用的强度与药物剂量呈现相关性。介于吲哚胺2-3加氧酶对于肿瘤微环境中免疫体系的作用,以及香菇多糖作为一种免疫系统调节剂的治疗角色。作者还观察了香菇多糖对于肿瘤细胞吲哚胺2-3双加氧酶的基因转录以及蛋白表达的影响。研究结果显示,香菇多糖处理细胞可以抑制肿瘤细胞中吲哚胺2-3双加氧酶编码基因的表达。香菇多糖组细胞间吲哚胺2-3双加氧酶编码基因表达呈现药物剂量依赖性。同时,这种基因水平的抑制作用可以在蛋白水平得到验证。Western blot检测结果显示,香菇多糖作用肿瘤细胞后,吲哚胺2-3双加氧酶表达呈浓度依赖性下调趋势。
因此,香菇多糖对于乳腺癌细胞的抑制增殖作用机制与抑制吲哚胺2-3双加氧酶基因以及蛋白水平的表达有关,通过该机制使得机体的免疫微环境能够保持较高的活性状态,从而发挥监视、治疗肿瘤的功效。
[1]Colombo MP, Piconese S. Regulatory-T-cell inhibition versus depletion: the right choice in cancer immunotherapy [J]. Nat Rev Cancer,2007, 7: 880-887.
[2]Zheng X, Koropatrick J, Li M, et al. Reinstalling antirusive molecule by inhibiting tumor-derived immunosuppressive molecule IDO throng RNA interference [J]. J Immunol, 2006, 177: 5 639-5 646.
[3]Chang M, Boulden J, Sutanto-Ward E, et al. Binlablation in mammary gland delays tissue remodeling and drives cancer progression [J]. Cancer Res, 2007, 67: 100-107.
[4]Munn DH, Mellor AL. Indoleamine 2,3-dioxygenase and tumorinduced tolerance [J]. J Clin Invest, 2007, 117: 1 147-1 154.
[5]Terness P, Chuang JJ, Opelz G. The immunoregulatory role of IDO-producing human dendritic cells revisited [J]. Trends Immunol, 2006,27: 68-73.
[6]Wayne AS. Application of immunotherapy in pediatric leukemia [J].Curr Hematol Malig Rep, 2009 ,4:159-166.
[7]Cohen EP, Chopra A, O-Sullivan I, et al. Enhancing cellular cancer vaccines [J]. Immunotherapy,2009,1:495-504.
[8]Uemura H, Fujimoto K, Mine T, et al. Immunological evaluation of personalized peptide vaccination monotherapy in patients with castration-resistant prostate cancer [J]. Cancer Sci, 2010 ,101:601-608.
[9]Sungarian A, Cielo D, Sampath P, et al. Potential Role of Thymosinalpha1 Adjuvant Therapy for Glioblastoma [J]. J Oncol, 2009, 3:671-672.
[10]Clegg-Lamptey JN, Dakubo JC, Attobra YN. Psychosocial aspects of breast cancer treatment in Accra, Ghana [J]. East Afr Med J,2009,86:348-353.
[11]Okamoto A, Nikaido T, Ochiai K, et al. Indoleamine 2,3-dioxygenase serves as a marker of poor prognosis in gene expression prof i les of serous ovarian cancer cells [J]. Clin Cancer Res, 2005, 11: 6 030-6 039.
