口服华法林对心脏瓣膜钙化的影响
2010-06-19王宇玫孟娟娟王永刚陈春鸣
王宇玫,孟娟娟,王永刚,陈春鸣,张 红,孙 伟
心脏瓣膜的僵硬和钙化是心脏功能的直接影响 因素,动脉钙化和瓣膜钙化是使心血管病病死率增加的独立危险因子[1]。华法林是临床上常用的抗凝药物,目前广泛地用于血栓性疾病的治疗和预防。此药物还是建立血管钙化动物模型的主要诱导剂,在人体也有引起动脉钙化、支气管钙化的报道[2]。但其对人体心脏瓣膜钙化的影响报道很少。本研究试图分析长期服用华法林对心脏瓣膜钙化的影响。
1 资料与方法
1.1 对象选择 2006年1月以来解放军总医院第一附属医院口服华法林1年以上并进行超声心动图检查的患者,共 34例,男12例,女22例,年龄35~81(65±7)岁。患者情况:下肢深静脉血栓5例,肺栓塞13例,心房颤动12例,心脏瓣膜置换术后4例(二尖瓣和主动脉各2例,均为机械瓣膜)。另外选取年龄、性别和其他情况相似的患者18例作为对照,排除风湿性心脏病、先天性心脏病、肾功能衰竭、痛风、甲状旁腺疾病、结缔组织疾病、肿瘤等原因所致的瓣膜钙化性病变。
1.2 病史 详细询问并记录患者的病史,包括高血压、糖尿病、骨质疏松等情况。
1.3 超声检查 所有患者行超声心动图检查(型号为Phillip 5500,机器标配4S探头),检查者固定。主动脉瓣钙化、二尖瓣环钙化的超声诊断标准为:取胸骨旁左室长轴切面、胸骨旁大动脉短轴切面、心尖四腔切面、心尖左室长轴切面进行探测,主动脉瓣回声增强、瓣叶僵硬,且瓣膜厚度>3 mm者诊为主动脉瓣钙化;房室交界处或二尖瓣与左室后壁间呈斑块状回声增强,且厚度>3 mm者诊为二尖瓣环钙化。
1.4 观察指标的测定方法 采取测试者的血清标本,同位素化学发光法检测甲状旁腺素(parathyroid hormone,PT H);ELISA方法测定血清中骨桥蛋白(osteopontin,OPN,R&D公司)、血清 Fetuin-A(Epitope Diagnostic)、血清基质Gla蛋白(matric gla protein,MGP,BiomedicaTM);生化分析仪测定血脂、碱性磷酸酶(alkaline phosphatase,AKP)、高敏C-反应蛋白(high-sensitive C reactive protein,HsCRP)等其他生化和离子浓度指标。
1.5 统计学方法 采用SPSS 12.0软件包进行统计学分析。计量数据用±s表示。两两比较采用t检验;计数资料比较采用 χ2检验。P<0.05表明差异有统计学意义。
2 结 果
2.1 患者情况 口服华法林组和对照组患者基本情况大致相同(表1),华法林组患者的年龄、性别比例、高血压和糖尿病者的比例与对照组相比无明显差异。华法林组服药时间为 1~12年,其中服药1~2年者26例,2~3年者4例,5年者2例,8年者1例,12年者1例,中位时间1.6年(1年7个月),4例服药5年以上者均为风湿性二尖瓣病变而行瓣膜置换术后患者。INR值维持在1.5~2.0者27例,2.0~2.5者5例,2.5~3.0者2例。华法林平均日用量为(2.1±0.5)mg。服用华法林组中骨质疏松的比例为52.6%,明显高于对照组38.9%(表1)。
2.2 瓣膜钙化情况 两组患者均分别在应用华法林前进行心脏超声,评估心脏情况。服华法林后每3~6个月进行复查,评估心脏情况并对心脏瓣膜钙化进行针对性评估。2次以上的超声心动图检查间隔时间超过6个月。口服华法林组中有2例患者有二尖瓣环钙化,3例为主动脉瓣硬化;其中2例为主动脉瓣硬化,1例可见瓣叶上钙化沉积,但均未造成明显狭窄,重复的超声结果未发现瓣膜病变的显著进展。对照组有2例主动脉瓣增厚和僵硬病例,无显著的钙盐沉积。两组患者心脏瓣膜钙化的发生率分别为14.7%和11.1%,无明显差异。
2.3 相关血清检测结果 分析口服华法林患者血清炎症反应因子、钙化相关的细胞外基质蛋白和血清钙磷代谢指标,表2结果显示,HsCRP和低密度脂蛋白胆固醇水平在两组中无明显差异;而血清中维生素K依赖的MGP水平在口服华法林组为(3.7±1.9)nmol/L,明显低于对照组(11.0±4.3)nmol/L,说明华法林抑制了 MGP的产生;华法林组患者的OPN水平为(154±56)μ g/L,明显高于对照组(86±35)μ g/L;而Fetuin-A在两组患者血清中的浓度分别为(0.69±0.32)g/L和(0.76±0.24)g/L,无显著性差异。两组患者的血钙和血磷水平均在正常范围内,大致相同,但血清AKP水平华法林组明显高于对照组,分别为(79±10)U/L和(65±8)U/L,血清PTH的结果正相反,华法林组略低于对照组,分别为(267±108)ng/L和(306±199)ng/L,但差异无统计学意义。
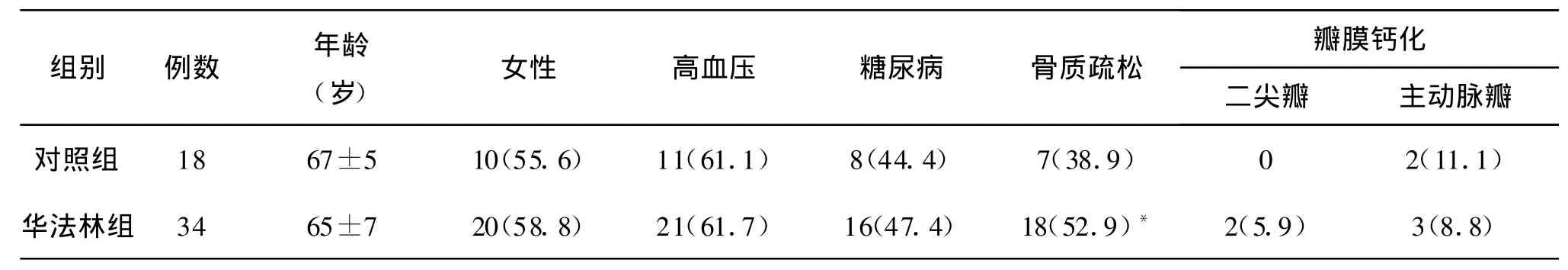
表1 华法林组与对照组患者的基本情况〔例数(%)〕

表2 华法林组和对照组患者血清相关指标比较
3 讨 论
心脏瓣膜的非炎症性钙化在过去一直被认为是一种退行性变化,随年龄增加而发生,现在则被认为是一个主动调节的过程,受到许多因素的影响,包括各种心血管危险因素,如高血压、高血脂、高血糖和代谢异常等,同时还受到全身代谢情况的控制,如尿毒症、钙磷代谢异常等,是机体异位钙化的一部分[3]。心脏的瓣膜组织与机体的其他组织一样,都存在着促进钙质和抑制钙盐沉积的动态平衡,一旦这种平衡被打破,就会出现软组织的钙盐沉积,骨组织的钙盐减少。目前的研究认为,钙盐在瓣膜和其他组织的沉积中,局部细胞及间质起重要作用。华法林的基本作用原理是维生素K拮抗,不仅能够抑制维生素K依赖的凝血因子的合成,同时也可抑制维生素K依赖的MGP的合成,后者是各种软组织包括心脏瓣膜中清除和抑制钙化的重要成分。因此,在基础研究中可用注射过量华法林的方法制作动脉钙化的模型[4],且已得到广泛应用。
本研究用超声方法观察了长时间服用华法林(1年以上)患者的心脏瓣膜,初步评估华法林是否会影响心脏瓣膜的钙化。以超声作为判定心脏瓣膜的状态和钙化情况是目前常用的方法,简便、可靠、重复性好。从本研究的结果来看,长期服用治疗剂量的华法林并未增加或加重瓣膜钙化。本组患者瓣膜钙化的出现与华法林的时间和剂量均无明显的因果关系。其原因可能有:(1)人体常规治疗剂量的华法林尚不足以造成整个机体软组织钙盐沉积调节的失衡,不会增加或者导致软组织包括心脏瓣膜的钙化;(2)华法林影响具有系统性,全身各个组织均受影响,而这一作用可能会在相对静止的组织(如动脉壁)可以显现,而对于不断受到血流冲刷的活动心脏瓣膜影响不大,不足以导致瓣膜的钙化;(3)在瓣膜钙化的形成中,局部的损伤因素如血流的冲击、局部的炎症反应和血液循环的状态可能是导致瓣膜钙化形成的更主要因素,MGP的作用以及华法林的影响相对微小;(4)另外,比较重要的一点是,瓣膜的钙化是一个漫长的过程,本研究观察时间相对短,尚不能显示出华法林对心脏瓣膜局部钙化的影响,病例数也较少。
本研究还同时对几种与钙化密切相关的基质蛋白的血清浓度作了对比分析:(1)MGP是一种存在于组织细胞外液的一种间质蛋白,作用是抑制钙盐在软组织中的沉积。MGP中含有γ 2羧基谷氨酸(γ 2 carboxyglutamic acid,Gla)基团,只有在羧化后,才能充分发挥其生物学活性,这种羧化作用依赖维生素K,华法林因是维生素K拮抗剂,因此能够抑制谷氨酸γ-羧化,也就能够抑制活性MGP的产生。华法林组患者血中MGP水平明显低于对照组,血清浓度仅为对照组的35%,反映了华法林的作用,此结果与其他研究结果相似[2]。本组中口服华法林并未明显增加心脏瓣膜的钙化,这与其明显促进血管钙化不同,反映出瓣膜的局部钙化与动脉钙化存在不同之处。(2)Fetuin A是一种由肝脏产生的,分泌到血浆中的钙盐沉积抑制剂,可与MGP及钙磷酸盐矿物质结合形成循环蛋白-矿物复合物以防止血管钙化,还可抑制其他因子的促钙化作用。Fetuin A基因缺失大鼠表现出广泛的软组织和血管间转移性钙化[5]。本研究中口服华法林组和对照组的血清Fetuin A水平并无显著差异,推测Fetuin A的浓度变化受异位钙化程度和范围的影响或控制,而不直接受MGP或者华法林的影响,其在异位钙化中的变化是继发性的或者受到反馈调节。(3)OPN是一种可由多种细胞合成分泌,对钙化具有抑制作用的基质蛋白,可由血管平滑肌细胞表面的单核/巨噬细胞分泌[6]。本组中华法林组的血浆OPN略高于对照组,推测可能与华法林引起的全身钙磷代谢特别是钙盐的沉积紊乱有关,华法林组患者骨质疏松的发生率高于对照组可能为这种钙盐沉积紊乱的表现,AKP浓度增加也提示华法林组骨骼的钙磷动员活跃,沉积的紊乱并不打破血浆中钙磷浓度的稳态,因此不表现为血钙和血磷甚至PTH的浓度变化,也未导致瓣膜钙化的增加。
本研究还分析了一些动脉内膜炎症相关的参照指标,如低密度脂蛋白-胆固醇和HsCRP,结果并未在是否服用华法林的患者中显示出差异,反映口服华法林可能并未影响低密度脂蛋白代谢和炎症过程。发生于动脉内膜的钙化多与粥样硬化及其斑块有关,而此类斑块很少发生在心脏瓣膜,这可能是由于瓣膜钙化与动脉内膜粥样斑块钙化产生于不同的机制。本研究中,服用华法林的患者血清AKP水平升高,骨质疏松的患者也多于对照组,提示华法林对机体的骨骼代谢产生影响,这种影响不表现为血清钙磷浓度的变化,而更侧重于钙盐结晶的移位,即从骨骼中动员出来而沉积于其他软组织中。国外有报道瓣膜钙化的老年女性骨质疏松的发生率增高[7],说明瓣膜钙化与机体钙盐沉积的变化相关,是钙盐沉积异位的一个部分,而骨质疏松则是这个异常的另外一个方面。
本研究的局限性与不足:未能同时分析动脉钙化的情况,无法对比说明华法林对心血管系统和钙盐移位的整体影响,从而更有针对性地突出反映心脏瓣膜钙化的特殊性。另外由于一部分数据是回顾性的,缺乏必要的用药前的基线资料,如果有此作为前后对比,则更有利于说明问题。不过,初步研究的结果显示,口服抗凝剂量的华法林在本研究观察的期间内并未引起或加重心脏瓣膜的钙化,由其引起的与钙化相关的细胞外基质变化会对骨骼和其他部位的钙化发生影响,如有可能增加骨质疏松的发生。但更可靠的结果还有赖于大规模的前瞻性临床研究和长期随访。
[1]Rennenberg RJ,Kessels AG,Schurgers LJ,et al.Vascular calcifications as a marker of increased cardiovascular risk:a meta-analysis[J].Vasc Health Risk Manag,2009,5(1):185-197.
[2]刘立新,王士雯,赵玉生.华法林与血管钙化[J].解放军药学学报,2005,25(2):138-140.
[3]Schoen FJ.Evolving concepts of cardiac valve dynamics:the continuum of development,functional structure,pathobiology,and tissue engineering[J].Circulation,2008,118(18):1864-1880.
[4]Schurgers LJ,Spronk HM,Soute BA,et al.Regression of warfarin-induced medial elastocalcinosis by high intake of vitamin K in rats[J].Blood,2007,109(7):2823-2831.
[5]Ix JH,Chertow GM,Shlipak MG,et al.Association of fetuin-A with mitral annular calcification and aortic stenosis among persons with coronary heart disease:data from the Heart and Soul Study[J].Circulation,2007,115(19):2533-2539.
[6]Speer MY,McKee MD,Guldberg RE,et al.Inactivation of the osteopontin gene enhances vascular calcification of matrix Gla protein-deficient mice:evidence for osteopontin as an inducible inhibitor of vascular calcification in vivo[J].J Exp Med,2002,196(8):1047-1055.
[7]Davutoglu V,Yilmaz M,Soydinc S,et al.Mitral annular calcification is associated with osteoporosis in women[J].Am Heart J,2004,147(6):1113-1116.
