原发性胆汁性肝硬化患者肝硬化期外周血淋巴细胞计数及T细胞亚群检测与分析
2010-06-13赵丹彤闫惠平廖慧钰刘燕敏黄云丽孔祥沙
赵丹彤,闫惠平*,廖慧钰,赵 艳,刘燕敏,刘 妍,黄云丽,冯 霞,孔祥沙
(1.首都医科大学附属北京佑安医院自身免疫性肝病临床研究中心,北京100069;2.首都医科大学 临床检验诊断学系,北京100050)
原发性胆汁性肝硬化(primary biliary cirrhosis,PBC)是一种原因不明的以血清中出现高滴度抗线粒体抗体(antimitochondrial autoantibodies,AMAs)及自身免疫介导的肝内小胆管进行性破坏和炎细胞浸润为主要特点的自身免疫性肝病,现已证实PBC患者肝组织和外周血中存在自身反应性T细胞[1]。T细胞亚群检测可用于评价机体免疫功能,我们对86例肝硬化期PBC患者外周血淋巴细胞计数及T细胞亚群结果进行回顾性分析,从定量角度探讨肝硬化阶段PBC患者外周血淋巴细胞总数及T细胞亚群特点并分析影响因素及临床意义。
1 材料与方法
1.1研究对象2003年6月至2008年12月间北京佑安医院住院PBC患者86例。其中,女性71例,年龄29-83岁,平均58.3±12.2岁。PBC患者的一般资料和临床表现,见表1。
1.2诊断标准PBC诊断标准符合2000年美国肝病学会制定的PBC诊断指导建议[2],包括:(1)ALP等反映胆汁淤积的生物化学指标升高;(2)B超或胆管造影检查显示胆管正常;(3)AMA或AMA-M2阳性;(4)如血清AMA或AMA-M2阴性,病理学检查需符合PBC的改变。同时排除病毒性肝炎,酒精性、药物性肝损害及原发性肝癌。
1.3分组本次研究对象均为进展至肝硬化阶段的PBC患者,相当于PBC自然史中的症状期及出现肝硬化失代偿的肝衰前期[3]。根据肝硬化程度和临床表现,将PBC患者分为代偿期组和失代偿期组。代偿期组主要为肝功能异常伴有乏力、皮肤瘙痒等临床表现的PBC症状期患者;失代偿期组为出现腹水、黄疸、静脉曲张和上消化道出血等肝硬化失代偿表现的PBC患者。其中,代偿期患者40例,失代偿期患者46例。
1.4方法
1.4.1肝功及免疫学指标检测 丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、碱性磷酸酶(ALP)、γ-谷氨酰转肽酶(GGT)、总胆红素(TBil)、白蛋白(ALB)采用日本Olympus AU5400全自动生化分析仪检测;血清总 IgG、IgA、IgM 采用Array 360全自动分析仪检测。
1.4.2自身抗体检测 采用间接免疫荧光法检测自身抗体谱,免疫印迹法检测AMA-M2。试剂购自德国欧盟公司。
1.4.3血常规检测 外周血白细胞计数(WBC)、淋巴细胞计数(LYMPH)、淋巴细胞百分比(LYMPH%)等参数采用日本Sysmex XE-2100五分类全自动血细胞分析仪检测。
1.4.4外周血T细胞亚群检测 T细胞绝对数(CD3+)、T辅助细胞百分比(CD3+CD4+%)、T辅助细胞绝对数(CD3+CD4+)、T抑制细胞百分比(CD3+CD8+%)、T抑制细胞绝对数(CD3+CD8+)和T辅助细胞比T抑制细胞(CD4+/CD8+)检测采用美国BD公司FACSCalibur流式细胞仪,抗体选用BD公司3色荧光抗体TriTEST CD3PerCp/CD4FITC/CD8PE,单平台法,前向和侧向散射光设门;绝对计数采用BD trucount tubes,裂解红细胞为FACS Lysing法,根据厂家提供的操作规程检测。
1.4.5Mayo评分模型[4]R=0.871×loge[0.058×胆红素(μ ol/L)]-2.53×loge[0.1×白蛋白(g/L)]+0.039×[年龄(岁)]+2.38×loge[凝血酶原时间(s)]+0.859×(水肿积分)。水肿积分:无水肿,0分;水肿可控制,0.5分;水肿难控制,1分。
1.5统计学分析采用SPSS16.0统计软件进行分析,正态分布定量资料以均数±标准差(s)表示,采用独立样本t检验进行组间比较;偏态分布定量资料以Median(Range)表示,采用Wilcoxon秩和检验;计数资料用行×列 χ2检验;偏态分布定量资料或分类变量资料采用Spearman秩相关分析法,P<0.05差异有统计学意义。
2 结果
2.1临床、生化及免疫学特点46例肝硬化失代偿期PBC患者中有4例(8.7%)出现上消化道出血、36例(78.3%)出现腹水,8例(17.4%)出现肝性脑病;40例代偿期PBC患者有26例(65.0%)伴脾大或脾切除。失代偿期患者平均年龄、黄疸比例、脾大或脾切除比例、TBil、IgA 、Mayo评分高于代偿期患者(P<0.05),而ALT、ALB 低于代偿期患者(P <0.05);女性比例、皮肤瘙痒、乏力等PBC常见临床特点两组间比较差异无统计学意义;AST、ALP、GGT、IgG 、IgM、ANA阳性率、AMA-M2阳性率两组间比较差异无统计学意义(P>0.05),见表1、2。
2.2外周血淋巴细胞计数与T细胞亚群检测肝硬化代偿期 PBC患者 LYMPH、LYMPH%、CD3+、CD3+CD4+和CD3+CD8+结果均高于失代偿期患者(P <0.05);WBC、CD3+CD4+%、CD3+CD8+%、CD4+/CD8+两组间比较差异无统计学意义(P>0.05),见表3。
2.3外周血淋巴细胞计数及T细胞亚群结果正常与异常患者频率根据外周血淋巴细胞计数正常参考值范围,进一步将检测结果分为减低、正常、增高三种情况,比较代偿期和失代偿期相应指标正常与异常患者频率。在LYMPH、LYMPH%、CD3+、CD3+CD4+和CD3+CD8+检测结果中,失代偿期减低者频率均高于代偿期,失代偿期增高者频率均低于代偿期,各指标结果正常与异常患者构成比两组间差异均有统计学意义(P<0.05),见表4。

表1 PBC肝硬化期患者一般资料、临床表现及比较
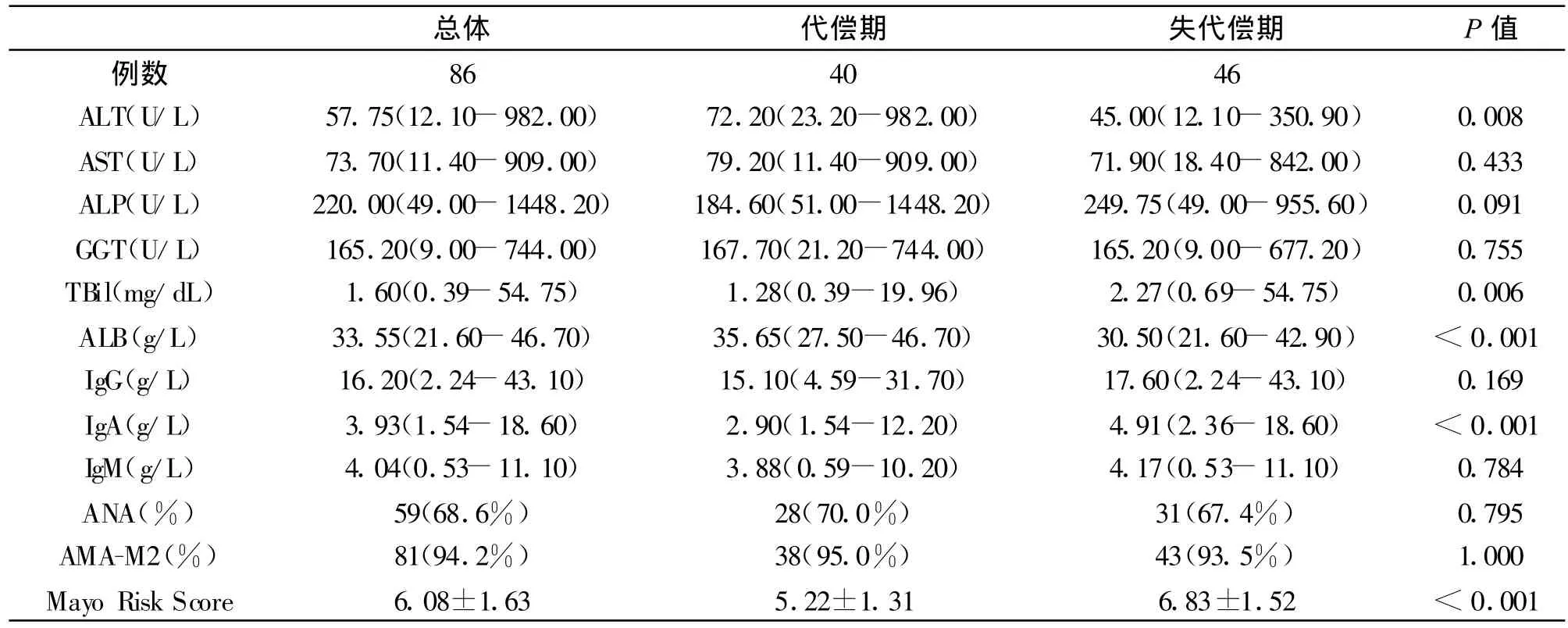
表2 PBC肝硬化期患者肝功、免疫学特点及比较

表3 PBC肝硬化期患者外周血淋巴细胞计数结果及比较
2.4外周血淋巴细胞计数与T细胞亚群影响因素在可能的影响因素中,年龄、Mayo评分、上消化道出血、脾大或脾切除、腹水等肝硬化失代偿表现对结果影响呈负相关;而ALT、ALB对结果影响呈正相关,见表5。

表4 PBC肝硬化期外周血淋巴细胞计数结果正常与异常患者频率及比较
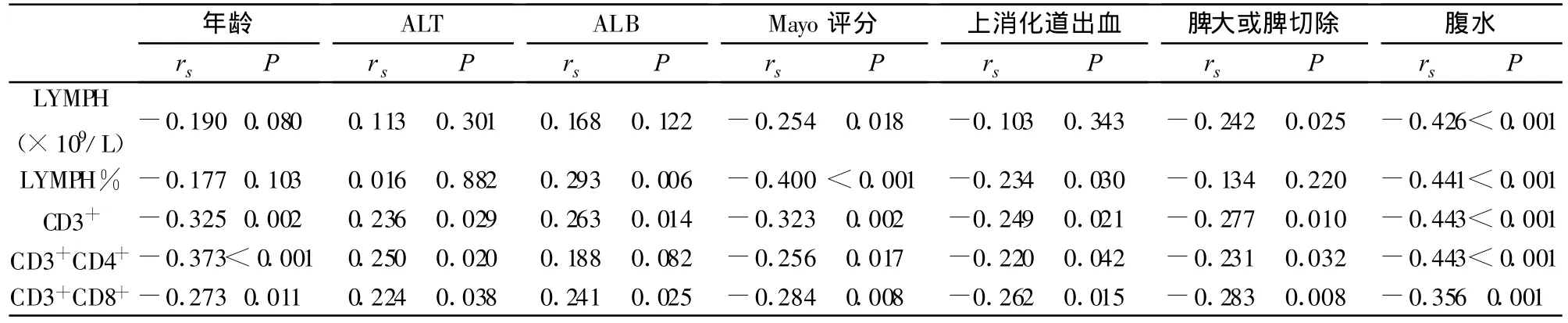
表5 PBC肝硬化期患者外周血淋巴细胞计数主要影响因素及相关性
3 讨论
PBC多累及女性,具有遗传易感性,90%患者血清中可检测到AMAs,但自身抗体的致病机制仍未被证实[5]。随着对AMAs阴性PBC的认识以及发现PBC患者淋巴细胞浸润小胆管及肝组织[6],人们发现PBC患者存在细胞免疫反应的异常[7]。T细胞亚群检测可从定量角度评价机体免疫水平、特别是评估免疫缺陷患者的细胞免疫水平。PBC患者的细胞免疫状态受多种因素影响,纵向比较肝硬化代偿期和失代偿期PBC患者细胞免疫水平比横向比较PBC患者和健康对照者更有临床意义。刘海英等[8]分析了51例PBC患者淋巴细胞亚群百分比,未发现不同临床分期PBC患者间差异有统计学意义,据此认为常规的细胞免疫检测如T细胞亚群分析对病情或疾病阶段的判断帮助不大。本研究在扩大样本量的基础上,首先比较了肝硬化代偿期和失代偿期PBC患者临床、生化和免疫学特点,发现肝硬化代偿期患者平均年龄、TBil、IgA及Mayo评分低于失代偿期患者,而ALT、ALB高于失代偿期患者。Mayo评分是美国Mayo Clinic Center建立的用于预测PBC患者生存率的评分模型,可以无需肝穿预测PBC患者预后,包括年龄、血清胆红素水平、白蛋白水平、凝血酶原时间和水肿程度,评分越高预后越差,而评分>7.8被认为是进行肝移植的最佳时机[4,9,10],本研究中失代偿期PBC患者Mayo评分明显高于代偿期PBC患者,说明失代偿期PBC患者肝功损害更严重,由于肝细胞大量坏死或出现肝纤维化,肝脏产生转氨酶能力逐渐丧失、合成ALB水平逐渐下降。
本研究发现,代偿期PBC患者外周血LYMPH、LYMPH%、CD3+、CD3+CD4+、CD3+CD8+结果高于失代偿期患者。虽然两组患者上述结果均数均在正常参考值范围内,但不能据此认为PBC患者淋巴细胞计数和亚群分类计数与健康人之间没有差别。为了排除样本构成对结论的影响,进一步将每组患者检测结果分为减低、正常、增高三种情况,对每种结果频数分布进行多组间比较,发现代偿期外周血淋巴细胞计数和亚群分类计数结果正常或增高的患者频率较高,而失代偿期上述结果正常或减低的患者频率较高,说明代偿期患者外周血淋巴细胞计数和亚群分类计数以正常或升高为主,失代偿期患者以正常或减低为主。
PBC虽然为器官特异性自身免疫病,细胞免疫和/或体液免疫亢进会导致靶器官功能障碍,但患者整体免疫水平受多种因素影响。研究发现,年龄、Mayo评分、上消化道出血、脾大或脾切除、腹水等肝硬化失代偿表现与结果呈负相关,即随着年龄的增长及肝硬化程度的加深,PBC患者淋巴细胞总数及T细胞亚群分类计数减少。ALT、ALB与结果呈正相关,不难理解,随着肝硬化的程度加深,肝脏合成ALB水平逐渐下降,淋巴细胞总数及亚群分类计数呈平行降低;ALT在PBC早期可反映肝细胞损害程度,此时外周血淋巴细胞及肝脏侵润淋巴细胞增加,肝组织局部免疫反应增强,而到肝硬化阶段,由于肝细胞大量坏死或出现肝纤维化,肝脏产生转氨酶能力逐渐丧失,此时淋巴细胞总数及T细胞亚群分类计数也呈平行降低。
在肝硬化门脉高压时,由于大量的血细胞在肿大的脾脏中停留而被巨噬细胞所破坏,出现白细胞、红细胞、血小板等血细胞减少的脾功能亢进表现,为了缓解症状,使血象正常或接近正常,患者通常进行脾切除。脾脏是不仅是重要的储血器官,也是重要的免疫器官,脾切除虽然可以暂缓症状,但脾脏过滤功能消失,IgM减少、调节素和调理素水平降低、T淋巴细胞系统出现紊乱、外周血淋巴细胞数量以及淋巴细胞转换率明显下降,导致爆发感染的机会显著增加,因此,脾大可能是肝硬化失代偿期患者免疫功能异常的重要原因之一[11],也是影响肝硬化期PBC患者外周血淋巴细胞总数及T细胞亚群分类计数结果的重要因素。
本研究的PBC患者多数为初次诊断时就已发展到肝硬化代偿期,平均肝病史为2.5年,受规范治疗的人少,而失代偿期患者平均肝病史为4年,多数患者已接受或正在接受熊去氧胆酸(UDCA)的治疗,而UDCA具有促进肝细胞分泌胆汁酸和免疫调节的作用。汪群英等[12]对23例PBC患者治疗前后T细胞表型变化进行了比较,发现CD4+、CD4+/CD8+指标治疗后比治疗前明显下降,但CD8+T细胞无明显变化。因此,不能排除失代偿期PBC患者淋巴细胞分类计数结果相对减低与治疗无关。外周血淋巴细胞亚群检测可从定量角度考察PBC患者,特别是疾病进展期患者的细胞免疫水平,若能结合患者病情和治疗状况对淋巴细胞功能进行体外研究,将有助于PBC患者免疫状态的综合评价,这对指导治疗及提高患者生存质量有一定的意义。
[1]Ishibashi H,Nakamura M,Shimoda S,GershwinME.T cell immunity and primary biliary cirrhosis[J].Autoimmun Rev,2003,2:19.
[2]Heathcote E J.Management of primary biliary cirrhosis.The AmericanAssociation for the Study of Liver Diseases practice guidelines[J].Hepatolgy,2000,31:1005.
[3]Gershwin ME,Vierling JM,Manns MP.Liver Immunology:principles and practice[M].NY:Humana Press,2007.235-247.
[4]Dickson ER,Grambsch PM,Fleming TR,Fisher LD,Langworthy A.Prognosis in primary biliary cirrhosis:model for decisionmaking[J].Hepatology,1989,10:1.
[5]GershwinME,Ansari AA,Mackay IR,et al.Primary biliary cirrhosis:an orchestrated immune response against epithelial cells[J].Immunol Rev,2000,174:210.
[6]Dienes H P,Lohse A W,Gcrken G,et al.Bile duet epithelia as target cells in primary biliary cirrhosis and primary scleroaing cholangitis[J].Vimhows Arch,1997,431:119.
[7]闫惠平,庄 辉,刘燕敏,等.原发性胆汁性肝硬化患者的免疫学特点分析[J].中华肝脏病杂志,2005,13:12.
[8]刘海英,邓安澎,朱 烨,等.原发性胆汁性肝硬化患者外周血临床免疫指标分析[J].广东医学,2006,27:984.
[9]Klion FM,Fabry TL,PalmerM,Schaffner F.Prediction of survival of patients with primary biliary cirrhosis.Examination of the Mayo Clinic model on a group of patients with known endpoint[J].Gastroenterology,1992,102:310.
[10]KimWR,Wiesner RH,Therneau TM,et al.Optimal timing of livertransplantation for primary biliary cirrhosis[J].Hepatology,1998,28:33.
[11]张友才,邓长生,朱尤庆,等.肝硬化脾大部分栓塞对T细胞亚群及sIL-2R水平影响及临床意义[J].中国现代医学杂志.2001,11:4.
[12]汪群英,徐芸,李建生,等.原发性胆汁性肝硬化患者外周血T细胞表型及细胞因子的变化及意义[J].临床荟萃,2008,23:477.
