二穗短柄草幼胚再生体系及农杆菌介导转化的初步研究
2010-06-08吴雪莉刘金星KlausNielsen杨志民高彩霞
吴雪莉,刘金星,Klaus K Nielsen,杨志民*,高彩霞,*
(1.南京农业大学园艺学院,江苏 南京210095;2.中国科学院遗传与发育生物学研究所,植物细胞与染色体工程国家重点实验室,北京100101;3.Research Division,DLF-TRIFOLIUM A/S,丹麦466060)
二穗短柄草(Brachypodiumdistachyon)是温带一年生禾本科早熟禾亚科短柄草属植物。原产于非洲北部、欧洲南部和亚洲中部,包含约10个亚种[1],它与大多数的禾草亲缘关系很近,与小麦(Triticumaestivum)、大麦(Hordeumvulgare)、燕麦(Avenasativa)等粮食作物的亲缘关系比水稻更近[2-4]。水稻作为禾草最基本的模式植物[5,6],其生长周期长,对生长环境要求高,尤其是在高产基因实验方面要求更高,此外,它属于稻亚科,与早熟禾亚科之间的亲缘关系较远,因而并不是理想的禾草模式植物。而二穗短柄草在很多方面与拟南芥(Arabidopsisthaliana)有共同特点,拥有模式植物必备的物理特性和生物学特性[7-15]:基因组小、染色体少、DNA重复序列少、植株较矮、生长周期短、自花授粉等。与小麦族植物一样具有二倍体、四倍体和六倍体,且不需要严格的生长条件和栽培措施,可以作为一种新型的禾草模式植物。目前,人们已经开始对二穗短柄草进行多方面的研究,从而更全面地确认它作为模式植物的必然性。
遗传转化体系的建立是模式植物作为有效工具的关键,开展关于二穗短柄草遗传转化方面的研究具有重要意义。近几年来,短柄草越来越引起国内外分子生物学研究者的重视,对其植物学特性、细胞遗传学特性、分子生物学特性、基因组学发掘、组织培养和遗传转化性能等进行了研究,但目前国内尚未见有关二穗短柄草遗传转化方面的研究报道。本试验以国际短柄草协会正在构建遗传连锁图的二穗短柄草BD21和BD21-3品系及植株健壮、生长迅速的BDR018品系的幼胚为材料,研究了幼胚大小对胚性愈伤组织诱导及再生的影响,并探讨了愈伤组织年龄及浸染过程中的不同处理对农杆菌介导的BDR018遗传转化效率的影响,对建立高效稳定的二穗短柄草离体再生和遗传转化体系具有重要意义。
1 材料与方法
1.1 植物材料
2008年5月选取国际短柄草协会正在构建遗传连锁图的二穗短柄草BD21和BD21-3品系及植株健壮、生长迅速的BDR018品系的幼胚为材料,每个处理设3个重复,取抽穗2周左右的幼嫩籽粒,用1.5%的次氯酸钠消毒15~20 min,无菌水冲洗5~6次,于超净工作台内剥取幼胚,置于诱导培养基上,26~28℃、黑暗条件下诱导胚性愈伤组织,5 d左右拔除幼芽。愈伤组织每2周在相同培养基上继代1次。
1.2 农杆菌菌株和质粒
本研究采用根癌农杆菌菌株AGL1,质粒载体PDM805如图1[内含bar基因(膦丝菌素乙酰转移酶基因)和gus报告基因(β-葡萄糖醛酸糖苷酶基因)]由丹麦DLF公司提供。
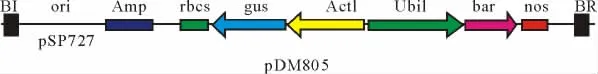
图1 质粒p DM805结构示意图Fig.1 Map of plasmid pDM805
1.3 幼胚离体培养基
MS基本培养基:MS大量元素+MS微量元素+MS铁盐+MS有机成分+MS维生素。
诱导培养基(MS2.5):MS基本培养基+2,4-二氯苯氧乙酸(2,4-D)(2.5 mg/L)+水解酪蛋白(0.5 mg/L)+CuSO4(0.6 mg/L)+蔗糖30 g/L+结冷胶(Gelrite)3.75 g/L。
选择诱导培养基(MS2.5-5B-Cefo200):MS基本培养基+2,4-D(2.5 mg/L)+水解酪蛋白(0.5 mg/L)+Cu-SO4(0.6 mg/L)+蔗糖30 g/L+Gelrite 3.75 g/L+双丙氨磷(Bialaphos)(5 mg/L)+头孢噻肟(Cefotaxime)(400 mg/L)。
再生培养基(M1G):MS基本培养基+激动素 Kinetin(0.2 mg/L)+蔗糖30 g/L+Gelrite 3.75 g/L。
选择再生培养基(M1G-5B-Cefo200):MS基本培养基+Kinetin(0.2 mg/L)+蔗糖30 g/L+Gelrite 3.75 g/L+Bialaphos(5 mg/L)+Cefotaxime(400 mg/L)。
壮苗培养基:1/2 MS基本培养基+蔗糖30 g/L+Gelrite 3.75 g/L。上述所有培养基均调p H值至5.8,121℃高压蒸汽灭菌20 min。
1.4 幼胚愈伤组织的遗传转化
从-80℃冰箱中取出含有质粒p DM805的农杆菌AGL1[9]菌液200μL(保存于15%甘油中,农杆菌与甘油1∶1混合),接种于20~25 m L含有50 mg/L利福平以及20 mg/L四环素的YEP(酵母菌)液体培养基中,28℃,200 r/min振荡培养12~18 h。当培养至OD600值为0.6~1.0后,将培养物于4 300 r/min离心10 min,收集菌体。用 MS 2.5液体培养基[MS基本培养基+2,4-D(2.5 mg/L)+水解酪蛋白(0.5 mg/L)+CuSO4(0.6 mg/L)+蔗糖30 g/L,p H 值5.8]洗涤2次后重新悬浮,调至OD600值为0.6~1.0。
选择颜色鲜黄,生长旺盛,结构密实的BDR018胚性愈伤组织(颗粒大小为1~2 mm),于农杆菌菌液中浸染15~20 min,吸去菌液,并用灭菌滤纸吸干愈伤组织表面的菌液,转移到盖有滤纸的诱导培养基上,26~28℃,暗培养48~72 h后,将共培养的愈伤组织用含有头孢霉素(Cefotaxime,200 mg/L)的无菌水漂洗2~3次,每次1 min左右,将愈伤组织上的水分吸干,置于空培养皿中12~24 h,MS2.5液体培养基漂洗1次后转移到选择诱导培养基上,26~28℃,暗培养2~3周。
1.5 转化体的筛选与抗性植株再生
转化2~3周后,将愈伤组织继代到新的选择诱导培养基上,于光照培养箱(25℃,16 h光照,8 h黑暗)培养。每2周继代1次。2次继代后,将抗性愈伤组织转移到选择再生培养基上培养。待抗性再生绿苗长至3~4 cm时,转移至壮苗培养基内,待抗性再生苗具有较健壮的根后,转入花盆中,于温室内种植。
1.6 GUS基因化学组织检测
将抗性再生植株叶片浸于X-Gluc溶液[含乙二胺四乙酸(EDTA)10 mmol/L、磷酸缓冲液100 mmol/L、亚铁氰化钾0.5 mmol/L、高铁氰化钾0.5 mmol/L、20%(V/V)甲醇和0.1%X-Gluc(W/V)]中,37℃下保温数小时,96%乙醇脱色,观察蓝色反应。
1.7 转化植株的PCR(聚合酶链反应)鉴定
取抗性再生植株和未转化植株叶片,用十六烷基三甲基溴化铵(CTAB)法[10]微量提取植物DNA。本试验扩增bar基因片断的引物为 MS126(5′-GGATCTACCATGAGCCCAGA-3′)和 MS127(5′-TGCCTCCAGGGACTTCAG-3′)。PCR所用Taq酶、d NTP等购于Ampliqon公司,引物由Invitrogen公司合成。PCR扩增外源目的基因的大小约为357 bp。
1.8 数据统计
成愈率(%)=愈伤组织数/接种幼胚数×100%。再生率(%)=再生绿苗数/愈伤组织数×100%。白化率(%)=再生白化苗数/愈伤组织数×100%。
2 结果与分析
2.1 幼胚大小对胚性愈伤组织诱导的影响
根据幼胚(胚轴方向)长度将其分成3类即:Ⅰ类:幼胚长度小于0.5 mm(图2A);Ⅱ类:幼胚长度介于0.5~1.0 mm之间 (图2B);Ⅲ类:幼胚长度大于1.0 mm(图2C)。2周后,统计幼胚的成愈率(表1)。
Ⅰ类幼胚,透明,胚的形状稍不明显。诱导过程中,出芽率极低,生长速度慢,胚性愈伤组织颜色鲜黄,颗粒致密紧实。Ⅱ类幼胚,半透明,胚的形状明显,出芽率较低,胚性愈伤组织颜色鲜黄,颗粒致密紧实,生长速度快于Ⅰ类,少量愈伤组织略带水浸状。Ⅲ类幼胚,不透明,近乳黄色,与成熟胚相似,出芽率高,生长速度快,但水浸状愈伤组织较多。
二穗短柄草3个品系 BD21,BDR21-3,BDR018的成愈率与幼胚大小有关(表1)。Ⅰ类幼胚成愈率最低,Ⅱ类幼胚成愈率最高,Ⅲ类幼胚成愈率介于Ⅰ类幼胚和Ⅱ类幼胚之间。相同幼胚大小,不同品系的幼胚成愈率也不同。Ⅰ类幼胚中BDR018的成愈率最低,仅13.8%。Ⅱ类幼胚中BD21的成愈率最高,达87.8%,BDR21-3和BDR018的成愈率分别为85.6%和72.9%。Ⅲ类幼胚中BD21的成愈率最高,各品系成愈率均在50%左右。由此可见,长度介于0.5~1.0 mm之间的Ⅱ类幼胚,成愈率最高且愈伤组织颗粒致密,结构紧实,颜色鲜黄,生长速度较快,适合用于农杆菌转化受体的愈伤组织诱导培养。
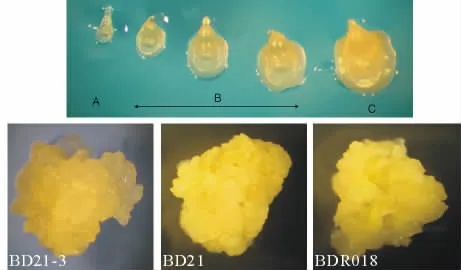
图2 幼胚大小和愈伤组织Fig.2 Size of immature embryo and embryonic calluses of
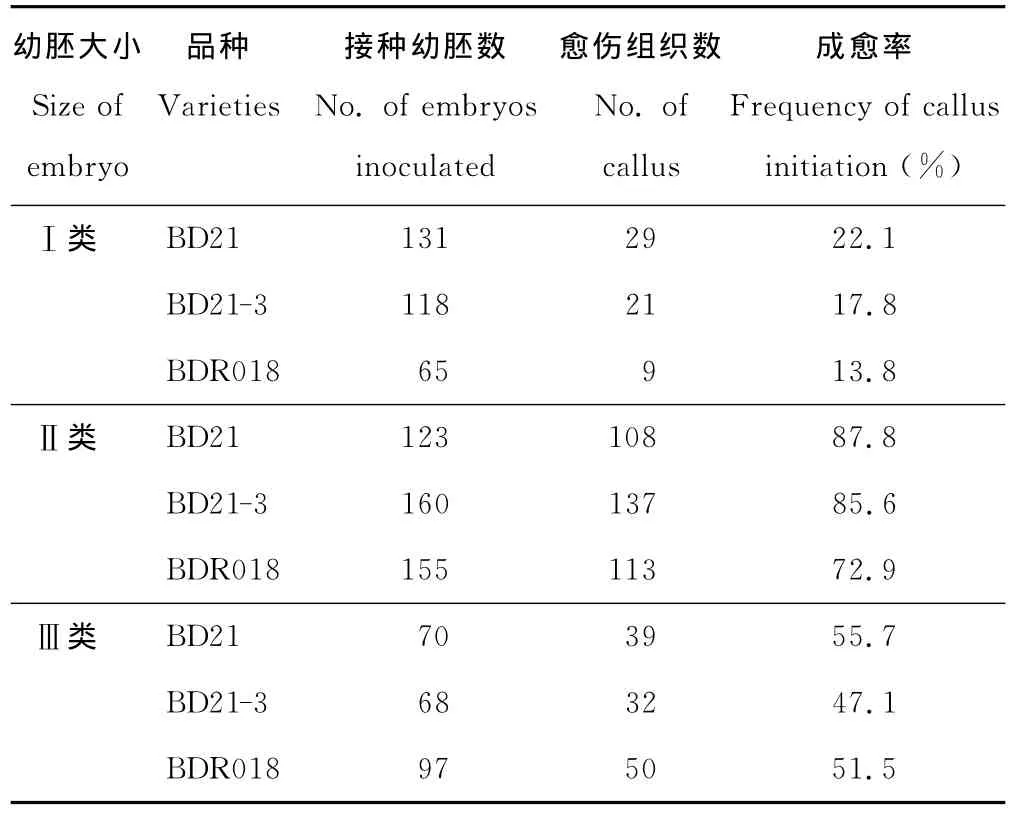
表1 幼胚大小对二穗短柄草幼胚成愈率的影响Table 1 Effect of embryo size on frequency of calli initiation in three B.distachyon accessions
2.2 愈伤组织年龄对愈伤组织分化的影响
将诱导出的胚性愈伤组织,按照不同年龄,接种在再生培养基上(M1G)于光照培养箱(25℃,16 h光照,8 h黑暗)进行分化培养。3周后统计再生率和白化率(图3)。
随愈伤组织年龄的增加,BDR018,BD21,BD21-3愈伤组织的再生率下降,白化率上升。愈伤组织年龄为5周时再生率最高,分别为100%,100%和85.3%(图3)。21周时再生率最低,分别为14.7%,30.3%和17.6%。5周时各品系的白化率最低。其中BDR018和BD21的白化苗和非再生愈伤组织从8周开始出现,而BD21-3从5周开始已有非再生现象产生。BDR018和BD21的胚性愈伤组织在5~8周范围内具有高的再生率和低的白化率,BDR018的再生率较其他2个品系最高。BDR018、BD21和BD21-3的再生率大于60%的愈伤组织,年龄分别为18,15,11周。综合上述BDR018的胚性愈伤组织的成愈率及分化再生率均较高,且可作为遗传转化受体材料的愈伤组织年龄范围最宽。以下遗传转化试验均以BDR018胚性愈伤作为转化受体。

图3 愈伤年龄对愈伤组织分化的影响Fig.3 Effect of different age of callus on differentiation in three B.distachyon accessions
2.3 愈伤组织年龄对转化的影响
以5,8,11,15,18,21周的BDR018胚性愈伤组织为受体材料,菌体由MS2.5液体培养基重新悬浮,菌液中加入0.01%的Silwet L-77,混合均匀,浸染愈伤组织15~20 min进行遗传转化,统计转化率(转化率=抗性再生植株数/愈伤组织数)。结果表明(表2),愈伤组织年龄为5~8周时转化率较高,平均转化率为39.6%和37.4%。随着愈伤组织年龄的增加,转化率明显降低。21周时转化率最低仅2.8%。不同年龄愈伤组织的平均转化率为21.4%。
2.4 真空处理和Silwet L-77处理对转化的影响
以5周的BDR018愈伤组织为受体材料进行遗传转化,比较了不同处理对转化率的影响。Ⅰ处理为对照,菌体在MS2.5液体培养基中重新悬浮后直接浸染愈伤组织;Ⅱ处理在菌体由MS2.5液体培养基重新悬浮后,在菌液中加入0.01%的Silwet L-77,混合均匀浸染愈伤组织。Ⅲ处理的菌液与Ⅰ对照处理相同,愈伤组织于空培养皿中,加入菌液浸染30 min,其间将培养皿放入基因枪真空室中进行真空处理,真空室内压力保持50 m bar,处理时间为5 min。
结果表明(表3),真空处理和0.01%的Silwet L-77处理均可显著提高转化率。真空处理和0.01%Silwet L-77处理的平均转化率分别为39.6%和41.0%,显著高于对照的平均转化率14.1%,真空处理和0.01%的Silwet L-77处理的转化率相近。
2.5 GUS检测结果
待抗性植株移至温室后,取植株新鲜叶片进行gus基因化学组织检测,叶片GUS染色结果从无色到深蓝色表现不一致(图4),无色的叶片说明GUS基因未在植物中表达,浅蓝色和深蓝色叶片说明GUS基因已经在植物中得到稳定表达。
2.6 转基因植株的PCR检测
随机选取12株转基因抗性植株和2株非转基因对照植物进行PCR检测。结果表明,除了非转基因对照植物以外,所有的转基因植株均扩增出了357 bp的bar基因DNA片断(图5),证明bar基因已整合进二穗短柄草基因组中。
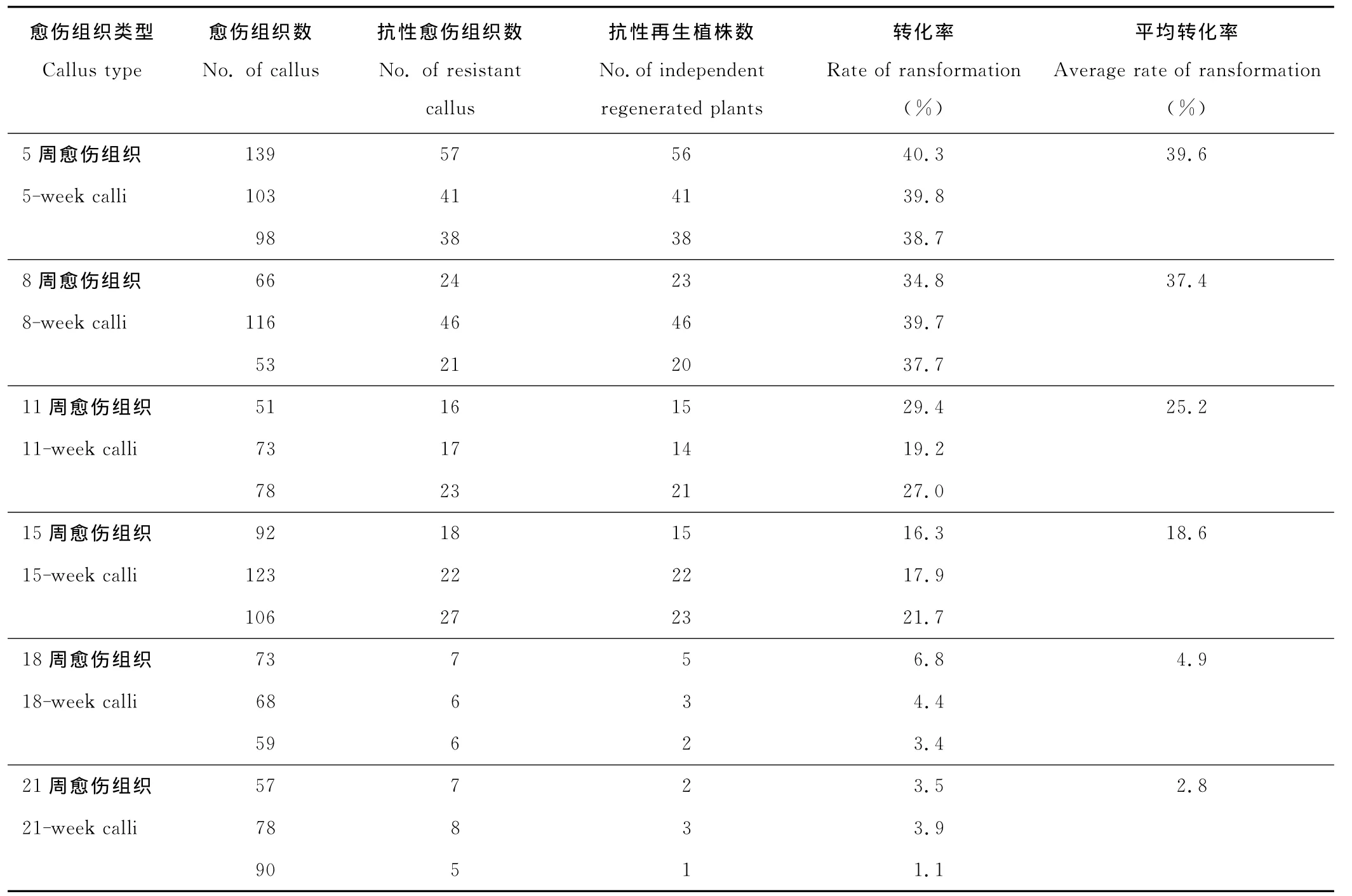
表2 愈伤组织年龄对转化率的影响Table 2 Effect of different age of calli on the efficiency of transformation
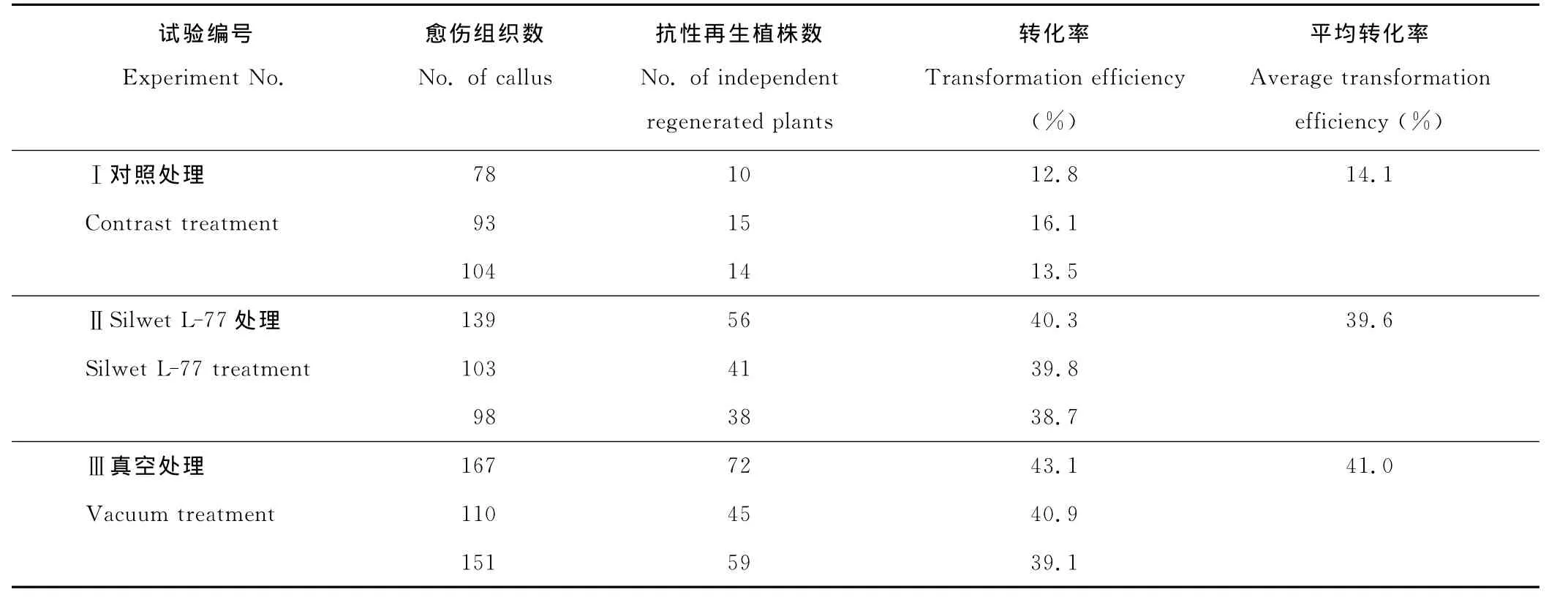
表3 真空处理和0.01%Silwet L-77处理对转化率的影响Table 3 Effect of vacuum infiltration or 0.01%Silwet L-77 on the efficiency of transformation
3 讨论
高频的离体再生系统及稳定的外植体来源是转化受体系统必备的条件,也是影响遗传转化效率提高的重要因素。在禾谷类转基因研究中,虽然成熟胚取材和操作方便,生理状态一致,是组织培养和遗传转化理想的外植体,但幼胚再生能力较高,在成熟胚高频率再生体系尚未建立的情况下,幼胚培养具有重要作用。研究表明幼胚大小介于0.5~1.0 mm之间时,胚性愈伤组织的诱导率最高。大于1.0 mm的幼胚愈伤组织诱导率均在50%左右,且出芽率较高,水浸状愈伤组织较多,这可能是由于较大的幼胚接近于成熟胚,具有较高的分化程度,而脱分化和再生能力下降。这与Draper等[2]对幼胚大小的研究具有相似结论,取二穗短柄草二倍体基因型ABR1不同大小的未成熟胚分别接种在LS和N6附加2.5 mg/L 2,4-D培养基上诱导愈伤组织,长度0.3~0.7 mm的未成熟胚诱导愈伤组织的潜力最大,在LS2.5培养基上胚性愈伤组织诱导率为45%,胚性愈伤组织白苗分化率仅为7%,而在N62.5培养基产生的胚性愈伤组织白苗分化率高达45%。但Draper等[2]是以二穗短柄草二倍体基因型ABR1为材料,而相同幼胚大小,不同基因型的诱导率之间仍存在显著差异。BD21诱导率最高达87.8%,BD21-3和BDR018诱导率分别为85.6%,72.9%。BD21和BDR018的诱导率均高于他人报道的68%和46%,而BD21-3的诱导率低于Philippe等[11]的研究结果94%,这可能与基因型对诱导培养基的选择有关[12]。
愈伤组织年龄对不同基因型的愈伤组织的分化再生具有显著影响。研究表明,在5~8周内胚性愈伤组织具有较高再生率,为转化提供了良好的受体系统。这一结果与Christiansen等[13]对二倍体基因型和四倍体基因型幼胚培养的研究相同。BDR017、BDR030、BDR001和BDR018愈伤组织愈龄3~6周时的再生率为90%~100%,8周时的再生率低于80%,培养时间越长再生率越低,如BDR017、BDR030愈伤组织培养16周时的再生率分别为30%和55%。

图4 GUS染色Fig.4 GUS staining
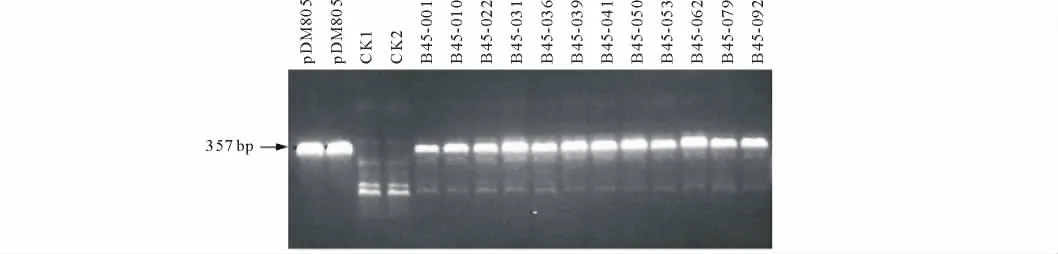
图5 PCR检测bar基因在转基因植株中的表达Fig.5 Expression of bar in transgenic plants
农杆菌介导二穗短柄草的遗传转化研究,主要集中于对BD21的转化研究,而对BDR018的研究目前仅有少数,国内尚未见关于BDR018遗传转化的研究报道。Vogel和Leong等[14]利用幼胚和成熟胚来源的胚性愈伤组织及AGL1菌系和p OL001载体首次开展了农杆菌介导转化短柄草的研究,14个基因型中有10个获得了转基因植株,转化率0.4%~15.0%。Christiansen等[13]用基因枪转化法对BDR018幼胚的胚性愈伤组织进行转化平均转化率5.3%,Vain等[15]用农杆菌转化法对BDR018幼胚愈伤组织进行转化,BDR018农杆菌转化的效率高达55%,高于本实验中愈龄为5周的BDR018胚性愈伤组织的最高转化效率40.3%和真空处理5 min的最高转化效率43.1%。原因可能是由于实验中转化的愈伤组织年龄为5周高于前两者作为受体材料的愈伤组织年龄,但是由于培养5周的愈伤组织可以获得更多的转化受体材料,因此虽然转化效率稍低,但仍具有重要的意义。浸染过程中,真空处理5 min和菌液中加入0.01%的Silwet L-77,均可提高转化效率。真空处理可提高转化率可能是由于真空使浸染环境产生负压,使菌液充满微孔从而提高转化效率。苜蓿(Medicagosativa)[16]、结缕草(Zoysiajaponica)[17]、花生(Arachishypogaea)[18]等的遗传转化中利用负压处理,转化效率也得到不同程度的提高。
[1]Tateoka T.Proposition of a new phylogenic system of Poaceae[J].Japan Bot,1957,32:275-287.
[2]Draper J,Mur L A J,Jenkins G,etal.Brachypodiumdistachyon:A new model system for functional genomics in grasses[J].Plant Physiology,2001,127:1539-1555.
[3]Kellogg E A.Evolutionary history of the grasses[J].Plant Physiology,2001,125:1198-1205.
[4]Gaut B S.Evolutionary dynamics of grass genomes[J].New Phytologist,2002,154:15-28.
[5]Havukkala I J.Cereal genome analysis using rice as a model[J].Current Opinion in Genetics & Development,1996,6:711-714.
[6]Tyagi A k,Mohanty A.Rice transformation for crop improvement and functional genomics[J].Plant Science,158:1-18.
[7]Shi Y,Draper J,Stace C.Ribosomal DNA variation and its phylogenetic implication in the genusBrachypodium(Poaceae)[J].Plant Syst Evol,1993,188:125-138.
[8]Vogel J,Garvin D,Leong O,etal.Agrobacteriummediated transformation and inbred line development in the model grassBrachypodiumdistachyon[J].Plant Cell,Tissue and Organ Culture,2006,85:199-211.
[9]Tingay S,McElroy D,Kalla R,etal.Agrobacteriumtumefaciens-mediated barley transformation[J].Plant Journal,1997,11:1369-1376.
[10]杨成丽,刘树楠,周吉源,等.高效烟草遗传转化体系的建立及甜蛋白基因的导入[J].生物技术,2004,14:9-11.
[11]Philippe V,Barbare W,Vera T,etal.Agrobacterium-Mwndiated transformation of the temperate grassBrachypodium distachyon(genotype BD21)for T-DNA insertional mutagenesis[J].Plant Biotechnology,2008,6(3):236-245.
[12]Cheng Ming.Invited review:Factors influencingAgrobacterium-mediated transformation of monocotyledonous species,In Vitro Cell.Dev[J].Biology of Plant,2004,40:31-45.
[13]Christiansen P,Didion T,Andersen C H,etal.A rapid and efficient transformation protocol for the grassBrachypodium distachyon[J].Plant Cell Reports,2005,23:751-758
[14]Vogel J P,Leong O M.Agrobacterium-mediated transformation of the model grassBrachypodiumdistachyon(abstract)[J].In Vitro Cellular and Developmental Biology,2004,40:29.
[15]Vain P,Worland B,etal.Agrobacterium-mediated transformation of the temperate grassBrachypodiumdistachyon(genotype Bd21)for T-DNA insertional mutagenesis[J].Plant Biotechnology,2008,6:236-245.
[16]黎茵,黄霞,黄学林.根癌农杆菌介导的苜蓿体胚转化[J].植物生理与分子生物学学报,2003,29(2):109-113.
[17]张磊,吴殿星,胡繁荣,等.结缕草组织培养及农杆菌介导转化的主要因子优化[J].草业学报,2004,13(4):100-105.
[18]邹湘辉,庄东红,胡忠,等.负压和超声波处理对农杆菌介导的花生遗传转化效率的影响[J].中国油料作物学报,2004,26(1):12-16.
