马铃薯块茎GBSSⅠ基因的cDNA克隆及其序列特征分析
2010-06-08沈宝云刘玉汇张俊莲王蒂
沈宝云,刘玉汇,张俊莲*,王蒂*
(1.甘肃省作物遗传改良与种质创新重点实验室,甘肃 兰州730070;2.甘肃农业大学农学院,甘肃 兰州730070)
淀粉是高等植物光合产物主要储存形式。淀粉合成酶是调控淀粉生物合成的关键酶,它催化形成α-1,4-糖苷键,将ADP葡萄糖连接在α-1,4-葡聚糖的非还原端,延长α-1,4-葡聚糖链[1]。淀粉合成酶以2种形式存在,即颗粒结合淀粉合成酶(granule-bound starch synthase,GBSS)和可溶性淀粉合成酶(soluble starch synthase,SSS),并具多种同工型。根据其编码基因的cDNA序列和以此推定的氨基酸序列的同源性差异将其分为:GBSSⅠ、GBSSⅡ、SSSⅠ、SSSⅡ、SSSⅢ等,其中GBSSⅠ又称 Waxy蛋白,在淀粉贮存组织中对直链淀粉的合成起关键作用[2]。
马铃薯(Solanum tuberosum)是营养丰富、用途广泛的作物,除粮菜兼用外,其在食品加工、淀粉加工等方面的作用更为重要。目前,马铃薯淀粉的生产量和商品量仅次于玉米淀粉,是位居第2的植物淀粉[3]。马铃薯淀粉中,直链淀粉约占20%~25%,支链淀粉约占75%~80%,其淀粉含量及其直/支链淀粉比例是影响马铃薯加工淀粉的产量及其在食品加工、造纸、化工等工业中的用途[4]。直链淀粉含量越高,分子间易结合,易发生凝沉,糊化越难[5,6],可用于胶片和胶条的制造,且该类胶片(条)具有突出的透明度、弹性、抗拉强度和抗水性。高直链淀粉也是生产光解塑料的最佳原料,是解决“白色污染”的有效途径。高支链淀粉则具有较好的稳定性、溶解性、粘滞性和透明性,适于作增稠预制剂、乳化剂、粘着剂等,被广泛用于香肠、汤羹类罐头、冷冻食品、膨化食品等食品添加剂,也在造纸、纺织、建筑、石油化工等方面具有广泛用途[7,8]。因此,利用基因工程技术进行马铃薯GBSS I基因的过量表达或抑制表达,是改变马铃薯淀粉结构、获得高直链淀粉或高支链淀粉新品种、开拓马铃薯淀粉应用新领域的最有效途径。本研究利用RT-PCR技术(方法逆转录-聚合酶链反应,reverse transcription-polymerase chain reaction)从马铃薯块茎中克隆到GBSSⅠ基因的cDNA序列,同时利用基因和蛋白数据库资料对该序列及其推导的氨基酸序列进行功能分析,为其进一步利用奠定良好基础。
1 材料与方法
1.1 材料
1.1.1 植物材料 马铃薯四倍体栽培种“甘农薯2号”的微型薯,由甘肃省作物遗传改良与种质创新重点实验室(以下简称重点实验室)提供。整个试验于2007年5月至2008年12月在重点实验室进行。
1.1.2 菌株和载体 大肠杆菌(Escherichiacoli)菌株 DH5α感受态细胞、p GEM?-T Easy Vector[抗性标记为氨苄青霉素(Ampr)],购自Promega公司。
1.1.3 酶和试剂 各种限制性内切酶、T4DNA连接酶、Taq DNA聚合酶购自TaKaRa公司;PureLinkTMPlant RNA Reagent、SuperscriptTMⅢ逆转录试剂盒购自美国Invitrogen(英杰)生命技术有限公司(以下简称Invitrogen公司);DNA凝胶回收试剂盒购自北京天为时代公司;其他生化试剂为国产分析纯。
1.1.4 引物设计 根据GenBank(accession number X58453)中马铃薯GBSSⅠ基因序列,设计1对引物,即上游引物p1:5′-CGCTCGAG (XhoI)ATGGCAAGCATCACAGCTTCACAC-3′,下游引物 p2:5′-CGGGATCC(Bam HI)GGGAGTGGCTACATTTTCCTTGGC-3′,由北京赛百盛公司合成。
1.2 GBSS I基因的cDNA克隆
1.2.1 逆转录合成c DNA第1链 1)总RNA提取。利用Pure LinkTMPlant RNA Reagent试剂盒抽提马铃薯块茎总RNA,重复5次。提取方法见试剂盒说明书。整个实验操作严格按文献[9]的有关要求进行,防止RNase污染。提取的总RNA在经焦碳酸二乙酯(DEPC)处理的l%琼脂糖凝胶上电泳,溴化乙锭(EB)染色后检查RNA的完整性;2)cDNA第1链合成。利用SuperscriptTMⅢ逆转录试剂盒,其中以Oligo(d T)20为引物,在 M-MLV反转录酶作用下合成c DNA第1链,具体操作过程见试剂盒说明书。3)保存。-20℃下保存cDNA第1链。
1.2.2 PCR扩增 以p1和p2为引物,在Taq DNA聚合酶作用下,克隆GBSSⅠ基因的cDNA序列,重复5次。扩增反应体系为25μL,由2μL cDNA 摸板、2.5μL 10×buffer、1μL d NTP(10 mmol/L)、1μL引物p1(10 mmol/L)、1μL引物p2(10 mmol/L)、0.5μL Taq DNA聚合酶、17μL dd H2O组成。扩增条件为:94℃预变性1 min后,进行94℃50 s、53℃50 s、72℃2 min的35个循环,再在72℃下延伸10 min。扩增产物EB染色后在1%琼脂糖凝胶上电泳检测。
1.2.3 cDNA序列与T载体连接 扩增产物经1%琼脂糖凝胶电泳分离后回收,回收方法见试剂盒说明书。回收产物与p GEM?-T Easy Vector载体连接,然后转化感受态细胞,连接和转化方法见试剂盒说明,重复10次。
1.2.4 重组质粒的获得 将转化细胞涂布在含50μg/m L Ampr、l00μL(20 mg/m L)5-溴-4-氯-3-吲哚-β-D-半乳糖苷(X-gal)和12μL(0.8 mol/L)异丙基-β-D-硫代半乳糖苷(IPTG)的LB平板上进行蓝白斑筛选,对所获得的白斑通过滞后质粒、PCR扩增、XhoI和Bam HI双酶切鉴定,重复10次,-80℃下保存。
1.3 序列测定及分析
送白斑菌株到上海生工公司测序,重复10次。所测序列用Lynnon biosoft公司的DNAMAN version 6.0软件进行分析。然后通过NCBI网站的Blast X和Blast P程序进行序列相似性分析和氨基酸保守性预测;用ClustalW2网站的软件进行氨基酸序列比对和相似序列进化树分析;链接至http://au.expasy.org/prosite网站进行蛋白质结构域分析;用PredictProtein Server网站的软件分析蛋白质二级结构;将GBSSⅠ氨基酸序列提交至Phyre网站,进行GBSSⅠ蛋白质三级结构预测及比对分析,并用Rasmol 2.6软件查看GBSSⅠ三级结构。
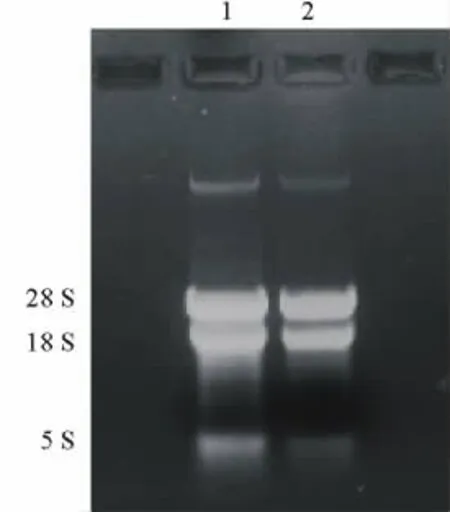
图1 马铃薯总RNAFig.1 Total RNA of S.tuberosum
2 结果与分析
2.1 马铃薯块茎GBSSⅠ基因的cDNA克隆
马铃薯块茎由于富含多糖和酚类物质,其RNA提取难度较大。本研究用Invitrogen公司的Pure-LinkTMPlant RNA Reagent提取试剂盒进行块茎总RNA的提取,琼脂糖凝胶电泳结果显示,总RNA的5 S,18 S和28 S三条带清晰、完整(图1),表明RNA的完整性良好,说明该试剂盒适合马铃薯块茎的总RNA提取。利用cDNA第1链合成试剂盒,在反转录酶M-MLV的作用下,获得了马铃薯块茎的cDNA第1链。根据已发表的马铃薯GBSSⅠ基因序列,利用设计的1对特异性引物,以cDNA第1链为模板,在Taq DNA聚合酶的作用下进行PCR扩增,期望获得约1 824 bp大小的DNA片段。对扩增产物电泳检查结果表明,其大小与预期片段基本一致(图2),说明可能获得了GBSSⅠ基因的cDNA克隆。
2.2 重组质粒的获得
将扩增获得的GBSSⅠ基因片段与T载体连接。蓝白斑筛选后,进行滞后质粒筛选(图3),然后利用PCR及XhoI和Bam HI双酶切鉴定。结果显示,扩增到或切下约1 824 bp大小的DNA片段(图4a,b),将其定义为p GBSS-T。
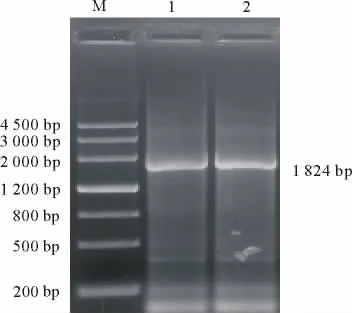
图2 马铃薯GBSS I基因的PCR扩增Fig.2 PCR amplification of GBSSⅠgene

图3 T-载体上滞后质粒的筛选Fig.3 Identification of delayed plasmid of T-vector

图4 白斑滞后质粒的PCR及Bam HI和XhoI酶切鉴定Fig.4 Identification of white color plasmid by PCR,Bam HI and XhoI
2.3 GBSSⅠ基因的cDNA序列及蛋白序列分析
2.3.1 GBSSⅠ基因的cDNA序列分析 将p GBSS-T质粒交上海生工公司测序。测序结果与原序列(accession number X58453)比较后发现,二者同源性达99.78%,其开放阅读框架为1 824 bp,编码607个氨基酸和1个终止密码子(TAA)(图5)。将该基因登记在GenBank中,登录号为EU403426。

图5 马铃薯GBSSⅠ基因的cDNA序列及其推测的氨基酸序列Fig.5 Nucleotide sequence and deduced amino sequence of GBSSⅠ cDNA of S.tuberosum
用DNAMAN软件对该序列与GenBank中登记的部分物种的GBSSⅠ基因的cDNA序列进行同源性比较。结果发现,该序列与其他学者登录的马铃薯GBSSⅠ基因的同源性很高,达99.20%以上,但与其他科植物同源性较低,为59%~77%。其中,与旋花科甘薯和大戟科木薯的同源性较高,其次为豆科类作物,而与禾本科作物的同源性较低(表1),说明同科植物特别是同种植物,该基因的保守性强,而不同科植物的GBSSⅠ基因间差异较大。
2.3.2 GBSSⅠ基因的蛋白质序列特征分析 利用Blast P软件在蛋白保守区数据库(Conserved Domain Database,CDD)对包括该基因在内的16种植物(10种双子叶植物和6种单子叶植物)的蛋白保守区进行分析,结果发现了3个完全保守区,即Glycos_transf(糖基转移酶,glycosyl transferase)、glg A(糖原/淀粉合成酶,glycogen/starch synthases,ADP-glucose type)和 Glyco_transf(淀粉合成酶催化区,starch synthase catalytic region),分别在97-101(GGLGD)、480-490(SRFEPCGLXQL)和503-510(STGGLVDT)氨基酸残基处(图5,6),表明这些区域具有十分重要的功能,如glg A为ADP_葡萄糖结合位点[10-13]。
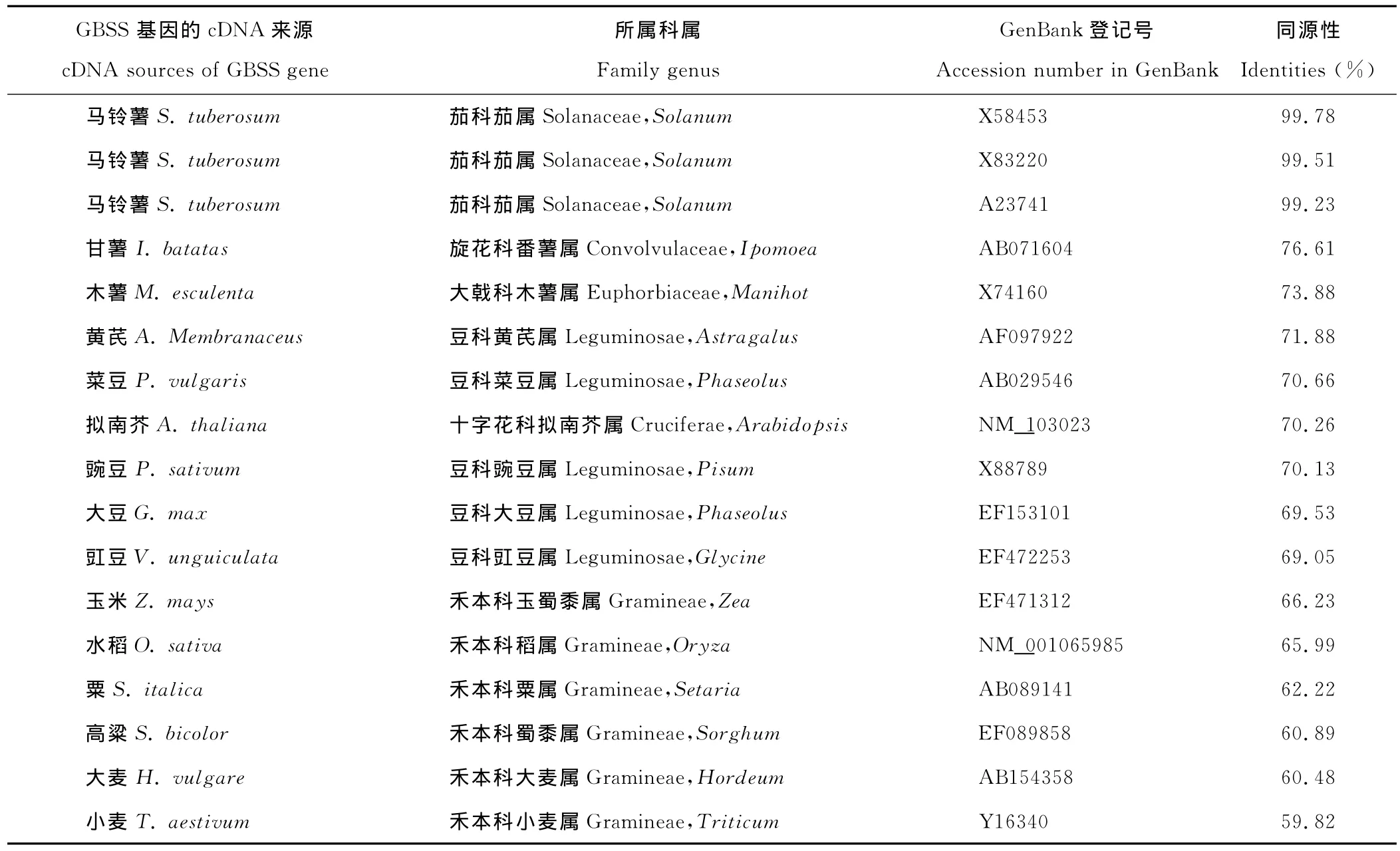
表1 马铃薯GBSS基因cDNA与其他植物GBSS基因cDNA序列同源性比较Table 1 Alignment of nucleotide sequence of GBSS gene with other homologues
另外,该蛋白在第57-59,66-68,121-123,313-315,362-364,435-437,510-512和567-569处具有蛋白激酶C功能(图5,用“——”表示),能将靶蛋白的Ser/thr磷酸化,从而激活细胞质中某些酶的活性,参与生化反应调控;还可与核中转录因子相互作用,参与基因表达调控。在第364-370氨基酸处(图5,用“【】”表示),该蛋白具有1个酪氨酸蛋白激酶磷酸化位点,可将自身的酪氨酸磷酸化或将各种不同靶蛋白的酪氨酸磷酸化来实现信号传递,其转导的信号通常与细胞生长、繁殖、分化、生存有关。此外,该蛋白分别在第16-19,271-274,329-332,374-377,480-483,510-513,585-588个氨基酸残基处还具有7个酪蛋白激酶Ⅱ磷酸化位点(图5,用“{}”表示);这是一种真核细胞中普遍存在的信使非依赖性丝/苏氨酸蛋白激酶,在细胞生存、生长、增殖及凋亡过程中具有重要的功能;位于第31-34和第213-216个氨基酸处具有2个N端糖基化位点(图5,用“⬆”表示),使蛋白质能够抵抗消化酶的作用、赋予蛋白质传导信号的功能、或某些蛋白只有在糖基化之后才能正确折叠;2个酰胺化位点,位于第299-302和第435-438个氨基酸处(图5,用“□”表示);7个N端酰基化位点,分别在第70-75,105-110,250-255,309-314,348-353,506-511,581-586个氨基酸处(图5,用“■”表示)。
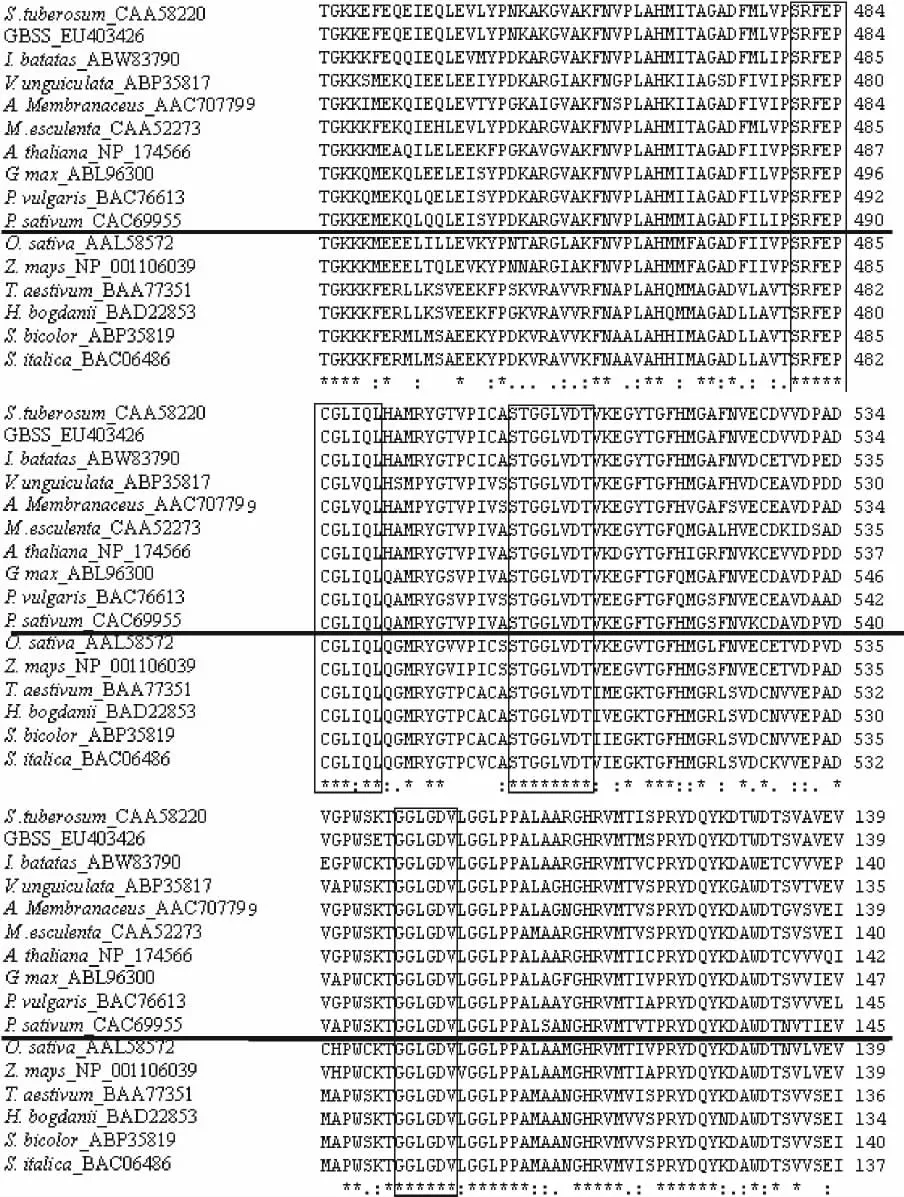
图6 马铃薯GBSSⅠ与其他植物GBSSⅠ基因氨基酸序列比较Fig.6 Alignment of amino acid sequence of GBSSⅠgene with other homologues
2.3.3 蛋白质二级结构和三级结构预测 通过PredictProtein Server网站的相关软件分析发现,组成GBSSⅠ蛋白的607个氨基酸中,169个氨基酸可能形成α螺旋结构,115个氨基酸可能形成β折叠片,323个氨基酸可能形成无规则卷曲。进一步登录Phyre网站,将GBSSⅠ氨基酸序列提交给CPHmodels和Phyre,用PSI-BLAST(位点特性反复BLAST)标准方法通过多序列比对建模,结果发现有10个推荐模型。对其进行比对分析后选取d1rzua(糖原合成酶,glycogen synthase 1)-Glg A fromAgrobacteriumtumefaciens[31%i.d.,E-value(E期望值)=0,estimated precision(估计精度)=100%]作为模板进行GBSSⅠ蛋白三级结构预测分析,将Phyre网站返回的d1rzua模板和GBSSⅠ模型用Rasmol软件查看,结果发现两者单体结构十分相似(图7,8),表明马铃薯GBSSⅠ蛋白与原核生物农杆菌的淀粉合成酶可能具有相同的功能(图6)。
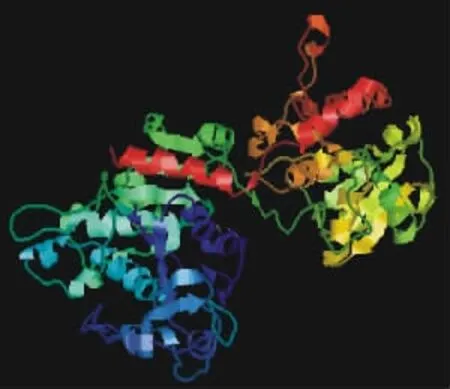
图7 d1ruza单体三级结构Fig.7 The monomer 3D structure of d1ruza

图8 GBSSⅠ预测单体三级结构Fig.8 The predicted monomer 3D structure of GBSSⅠ
3 讨论
多项研究结果表明,反义GBSSⅠ基因或RNAi沉默GBSSⅠ基因,可显著降低被干扰植株的直链淀粉含量,培育糯质型作物新品种[14,15];而增加GBSSⅠ基因的过量表达,则有望创制高直链淀粉含量的转基因植株,培育膜用型作物新品种[16,17],表明GBSSⅠ基因的过量表达或抑制表达是改变作物淀粉结构、创制新型淀粉类型、培育专用型作物新品种的有效途径。马铃薯GBSS基因有2种同工型,GBSSⅠ基因主要在贮藏器官块茎中表达,负责直链淀粉合成,GBSSⅡ主要在茎叶等非贮藏器官中表达[18],因此,分离并克隆控制马铃薯块茎直链淀粉含量的GBSSⅠ基因的cDNA序列,是利用基因工程技术改良马铃薯淀粉结构首先且必要的条件。
马铃薯GBSSⅠ基因为单拷贝,有13个内含子[19],其cDNA序列提取方法与无内含子基因的DNA提取方法不同[20]。本研究以Gen Bank中已公布序列(X58453)设计特异引物,利用RT-PCR和序列测定技术获得了该基因的cDNA序列。分析比对后发现,其与已公布的马铃薯该基因的cDNA序列同源性很高,达99.20%以上,但与其他物种间的同源性较低,为59%~77%,说明同科植物特别是同种植物,该基因的保守性很强,这与其他研究者对不同基因或不同物种同源性分析时的结论是一致的,即属内同源性高,属间相对低[21-23]。
生物信息学是一门发展迅速的新兴科学,利用相关软件可分析基因组或目的基因的序列特征、功能蛋白的结构和功能、分子遗传图谱的构建等[23,24],为利用功能基因改良作物遗传特性奠定基础。本研究对克隆到的GBSSⅠ基因的cDNA片段利用相关软件进行了分析,发现其编码607个氨基酸和1个终止密码子,具3个与其他15种植物完全一样的保守功能区域,存在着蛋白激酶C、酪氨酸蛋白激酶磷酸化、酪蛋白激酶Ⅱ磷酸化、糖基化、酰胺化和酰基化等功能位点。三级结构预测表明,其与农杆菌淀粉合成酶具有十分相似的三级结构模型,表明该蛋白具有淀粉合成功能。本研究为利用基因工程创制马铃薯新型淀粉结构奠定了基础。
[1]Visser R G F,Jacobsen E.Towards modifying plants for altered starch content and composition[J].Trends Biotechnol,1993,11:63-68.
[2]Li Z,Rahman S,Kosar-Hashemi B,etal.Cloning and characterization of a gene encoding wheat starch synthase I[J].Theoretical and Applied Genetics,1999,98:1208-1216.
[3]于天峰.马铃薯淀粉的糊化特性、用途及品质改良[J].中国马铃薯,2005,19(4):223-225.
[4]秦波涛,李和平,王晓曦.薯类加工[M].北京:中国轻工业出版社,2001.
[5]王中荣,刘雄.高直链淀粉性质及应用研究[J].粮食与油脂,2005,11:10-13.
[6]王立梅,齐斌.直链淀粉含量的影响因素及其应用研究进展[J].食品科学,2007,28(10):604-608.
[7]于天峰,夏平.马铃薯淀粉特性及其利用研究[J].中国农学通报,2005,21(1):55-58.
[8]陈芳,赵景文,胡小松.我国马铃薯加工业的现状、问题及发展对策[J].中国农业科技导报,2002,4(2):66-68.
[9]Sambrook J,RuSSell D W.分子克隆实验指南(第三版)[M].黄培堂,译.北京:科学技术出版社,2002.
[10]Feike R,vander Leij F R,Richard G F,etal.Sequence of the structural gene for granule_bound starch synthase of potato(SolanumtuberosumL.)and evidence for a single point deletion in the amf allele[J].Molecular and General Genetics,1991,228:240-248.
[11]彭佶松,吴晓俊,刘涤,等.黄芪毛状根GBSSI基因cDNA克隆及其结构分析[J].植物学报,2000,42(9):940-945.
[12]Dry I,Smith A,Edwards A,etal.Characterization of cDNAs encoding two isoforms of granule-bound starch synthase which show differential expression in developing storage organs of pea and potato[J].Plant Journal,1992,2(2):193-202.
[13]Fulton D C,Edwards A,Pilling E.Role of granule-bound starch synthase in determination of amylopectin structure and starch granule morpholpgy in potato[J].Biochemical Journal,2002,277(13):10834-10841.
[14]戴朝曦,孙顺娣,于品华,等.用生物技术培育马铃薯加工型品种的研究[A].陈伊里:面向21世纪的中国马铃薯产业[M].哈尔滨:哈尔滨工程大学出版社,2000:103-107.
[15]李加瑞,赵伟,李全梓,等.Waxy基因的RNA沉默使转基因小麦种子中直链淀粉含量下降[J].遗传学报,2005,32(8):846-854.
[16]史振声,王志斌,李凤海,等.国内外高直链淀粉玉米的研究与利用[J].辽宁农业科学,2002,1(6):30-33.
[17]黄晓杰,张春红,赵前程,等.高直链玉米淀粉-PVA共混塑料薄膜的制作工艺的研究[J].食品工业科技,2006,3:160-161.
[18]谷宏,马涛,赵增煜.高直链玉米淀粉可食性膜的研制[J].包装工程,2007,28(5):15-17.
[19]Christine H H,Walter M,Hermann H.Detection of the starch modifying gbss-antisense construct in transgenic potatoes[J].Zeitschrift für Lebensmittel-Untersuchung und-Forschung A,1998,206:83-87.
[20]张改娜,贾敬芬.豌豆清蛋白1(PA1)基因的克隆及对苜蓿的转化[J].草业学报,2009,18(3):117-125.
[21]吴建明,李杨瑞,王爱勤,等.甘蔗GA20氧化酶基因片段克隆及序列分析[J].热带作物学报,2009,30(6):817-821.
[22]尚以顺,杨春燕,钟理.贵州野生匍匐剪股颖种质资源遗传多样性的ISSR分析[J].草业学报,2009,18(3):67-73.
[23]吴旺泽,彭晓莉,王晓明,等.马铃薯水通道蛋白基因cDNA克隆、序列分析及表达[J].农业生物技术学报,2007,15(4):677-683.
[24]郑轶琦,刘建秀.草坪草分子遗传图谱的构建与应用研究进展[J].草业学报,2009,18(1):155-162.
