人脂肪组织来源干细胞生物学特性研究
2010-06-05朱艳霞,刘天庆*,宋克东,姜丽丽,马学虎,崔占峰
朱 艳 霞,刘 天 庆*, 宋 克 东, 姜 丽 丽, 马 学 虎, 崔 占 峰
(1.大连理工大学 干细胞与组织工程研发中心,辽宁 大连 116024;2.牛津大学 工程科学系 组织工程与生物处理中心,英国 牛津 OX1 3PJ)
0 引 言
自2001年Zuk等[1]证实吸脂获得的脂肪组织中存在具有多向分化潜能的细胞群,脂肪干细胞(adipose-derived stem cells,ADSC)逐渐被人们认识并进入干细胞研究领域.ADSC具有与骨髓间充质干细胞相似的生物学特性,并且脂肪组织分布广泛、体内储备量大,可以多次取材并且损伤小,因此,ADSC作为组织工程和再生治疗的种子细胞前景十分广阔.
目前国内外对ADSC体外增殖及定向诱导分化能力认识还存在分歧,研究者们通过不同方法获得了不同量的脂肪干细胞[1、2],要想获得高质、高量的ADSC,必须建立一套更简便有效的分离培养方法.另外,大多数研究显示ADSC的增殖周期是6~7 d,然而有研究表明ADSC在增殖2周过程中,细胞的蛋白合成率和总蛋白量一直持续增加[3].因此,ADSC的生长特性还有待进一步阐明.
本实验改进现有的ADSC体外分离培养方法,对其获得率、体外增殖能力等进行研究,以期ADSC为种子细胞的细胞治疗和组织构建提供细胞学基础.
1 材料和方法
1.1 脂肪干细胞的分离培养
自外科手术患者(年龄16~60岁)皮下获取正常脂肪组织,约500 mg,无钙镁 Hank′s液冲洗,用眼科剪尽量剪破脂肪组织中肉眼可见的细小血管,冲洗血液后剪碎脂肪组织,移入大玻璃管中,加入0.25%胰蛋白酶(sigma)和0.1%胶原酶(I型,sigma)(体积比1∶1),37℃恒温摇床振荡消化20 min.此时液面分为3层:上层为黄色油状脂肪细胞层,中层为脂肪组织层,下层为含单个核细胞的液体.吸出下层液体移入含完全培养基(10%胎牛血清(hyclone)+高糖 DMEM (gibco))的离心管中终止消化.在剩余脂肪中加入新的胰酶和胶原酶,重复以上步骤继续消化,重复2~3次,将收集到的液体1500 r/min离心10 min,去除悬浮的脂肪细胞和脂滴,去上清,向细胞沉淀中加入含10%胎牛血清DMEM重悬细胞,移入培养瓶中,37℃、5%CO2培养箱孵育,每2~3 d换液.细胞达到100%融合时,用0.25%胰酶和0.04%EDTA(体积比1∶1)消化传代.
1.2 细胞形态学观察
使用倒置显微镜(IX70-131,OLYMPUS)观察细胞生长,并对传代贴壁生长在培养瓶中的脂肪干细胞的生长、纯化情况及增殖进行连续观察、摄像.
1.3 细胞增殖动力学分析
将第4代ADSC以不同密度6.25×104、1.25×105、2.50×105、5.00×105、1.00×106和2.00×106cells/m L种于96孔板内,获得细胞密度与光密度值的标准曲线.以5.00×103cells/m L的密度接种细胞并分别检测和绘制第3、7和15代细胞的生长曲线.采用cck-8测量细胞增殖,每100μL培养液中加10μL无菌cck-8,孵育3 h后在酶联免疫检测仪上测各孔450 nm的光吸收值,参比波长630 nm.每组设置3个平行对照,实验重复3次.
当细胞传至20代时,分别将20代细胞按传统的每5 d传代1次(99%融合)和每14 d传代1次(此时细胞重叠生长),两种传代方法传代至25代时,分别绘制2个25代细胞的生长曲线.
1.4 累计群体倍增时间
根据生长曲线的指数增殖期计算群体倍增时间.群体倍增时间Td=T×[lg 2/lg(Nt/N0)],T代表生长曲线中的指数增殖时间段,N0是接种时的细胞数,Nt是指数增殖末期的细胞数.据此公式计算25代细胞的群体倍增时间Td.
1.5 细胞表面分子测定
取第4、20及2个25代细胞检测其干细胞相关表面标记的表达,操作步骤如下:培养的脂肪干细胞经过消化离心(1000 r/min,5 min)后细胞重悬;细胞计数后将细胞浓度调整为1×107cells/m L,分 别 与 人 抗 CD13-PE、CD29-PE、CD34-FITC、CD44-FITC、CD45-FITC、CD105-FITC、CD166-PE 和 HLA-DR-PE作用20 min,PBS洗涤2次后用PBS重悬细胞,流式细胞仪(BD,San Jose,CA,USA)进行检测.
1.6 逆转录聚合酶链式反应(RT-PCR)
分别提取第4、20、30及2个25代细胞的总RNA,用合成第1链cDNA试剂盒(Ta KaRa,日本)逆转录合成cDNA、Nanog、Oct-4、Sox-2和Rex-1的引物分别进行扩增,GAPDH作为参照.PCR产物进行1.5%琼脂糖凝胶电泳,Scion Image图像分析软件对电泳条带进行分析.
1.7 多向分化潜能的检测
1.7.1 成脂肪诱导 取第4代及2个25代细胞,以1×105cells/m L的密度接种于24孔板中.当细胞贴壁生长达80%融合时,换成脂肪诱导试剂[1],对照组加常规培养液.诱导14 d进行油红染色以观察细胞脂滴形成情况.
1.7.2 成骨诱导 当细胞贴壁生长达80%融合时,换成骨诱导试剂[1].细胞诱导培养1周时进行钙钴法碱性磷酸酶 (ALP)染色,3周进行Von Kossa染色,干燥后镜下观察.
1.7.3 成软骨诱导 取第4代及2个25代细胞,调整细胞密度2×107cells/m L,取10μL滴于24孔板内,于37℃培养箱孵育3 h后加软骨诱导剂[1].诱导培养2周后进行甲苯胺蓝染色,干燥后显微镜下观察.
1.7.4 成心肌诱导 取第4代及2个25代细胞,以1×105cells/m L的密度接种于24孔板中.当细胞贴壁生长达80%融合时加9μmol/L 5-氮胞苷,作用24 h后换新鲜培养基继续培养4周.用心肌特异性连接蛋白Connexin-43进行免疫荧光检测,荧光显微镜下观察.
1.8 统计学分析
采用SPSS 12.0软件进行统计学处理,所有数据以均数±标准差表示,组间比较采用t检验.P<0.05为有显著性差异.
2 结 果
2.1 细胞形态
接种后ADSC在24 h内开始贴壁,初为短梭形,细胞大小不等,核浆比例较大.2~4 d可见细胞伸展,大多数细胞为长梭形,形态类似成纤维细胞,核椭圆形,较大(图1(a)).原代培养的细胞3~4 d即达90%融合,传代后第3代细胞生长出现方向性(图1(b));体外培养20代以后,细胞的增殖速度无明显减慢,细胞形态无明显改变(图1(c));30代以后的细胞体积明显增大(图1(d)).
2.2 细胞增殖动力学
在本文的培养条件下,ADSC可传至30代以上.从图2(b)可以看出在最初3 d ADSC处于生长适应期,第4 d开始细胞进入对数生长期,然而第8 d后细胞处于生长停滞期.但与其他研究结果不同的是细胞并未出现接触抑制,而是继续增殖到第10 d时达到又一个增殖峰值.接下来的几天,细胞数量虽然有所减少,第12 d后细胞又进入另一个对数增殖期.从图2还可以看出,随着传代次数的增加细胞的增殖能力有所下降.图2(c)显示了两种传代方法得到的第25代细胞的生长曲线.与图2(b)类似,这两种细胞的生长曲线表现出多个对数增殖期和增殖峰值,两种方法得到的25代细胞都具有较强的增殖能力.

图1 体外培养的脂肪干细胞形态学改变Fig.1 Morphology change of h ADSCs from subcutaneous fat tissue cultured in vitro

图2 脂肪干细胞生长曲线Fig.2 Growth curves of h ADSC
显微镜下ADSC的形态学改变(图3)与生长曲线一致.第6 d细胞达到90%融合,第10 d即出现局部重叠生长.然而第11 d,镜下观察到单层ADSC上有一些卷曲溶解的细胞,接下来的几天,细胞继续重叠生长,形成一个厚的细胞片层.20 d后,细胞片层从孔板边缘卷起,细胞向卷起的空白区伸展增殖,跨过卷起的细胞片层和空白区.当细胞增殖至35 d以上,细胞片层完全卷起,此时通过cck-8检测细胞数量,发现其OD值与20 d左右细胞的OD值无显著性差异.
根据生长曲线计算细胞的群体倍增时间,发现细胞的群体倍增时间随传代次数的增加而增加,从第3代的36 h增加到第25代的96 h(图4).每代细胞几个对数增殖期的倍增时间没有显著性差异,但第2个对数增殖期倍增时间稍短于其他对数增殖期的倍增时间.

图3 对应于生长曲线不同时刻脂肪干细胞形态学改变Fig.3 Morphology changes of h ADSC in accordance with the growth curves
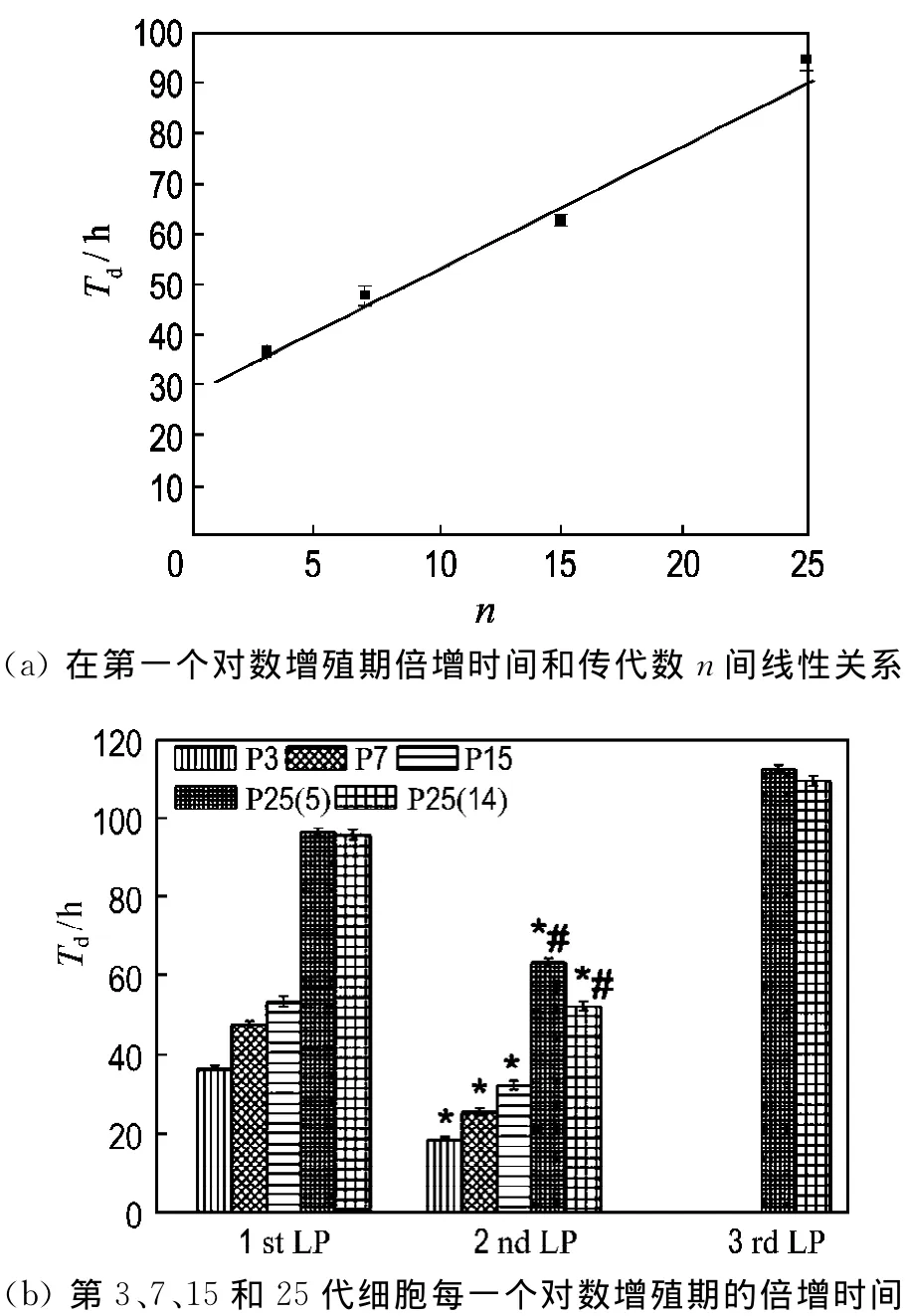
图4 ADSC倍增时间的检测Fig.4 Doubling time determination for ADSC
原代细胞增殖迅速,2~3 d细胞即达90%融合,随着传代纯化,到第4代细胞得到完全纯化时,ADSC细胞总量约为8×107个.根据细胞倍增时间计算可知每400~600 mg脂肪组织共可收获约5×105个ADSC.
2.3 表面标志物的鉴定
流式细胞仪检测结果发现(表1),第4、20、25代细胞中大多数细胞CD13、CD29、CD44、CD105和CD166阳性表达,而CD34、CD45和 HLA-DR都呈阴性表达.第4代细胞的阳性表达率稍高于第20代.本文还发现每隔14 d传代得到的25代细胞干细胞相关表面标志的表达率要高于常规5 d传代得到的25代细胞的表达率(P<0.05).
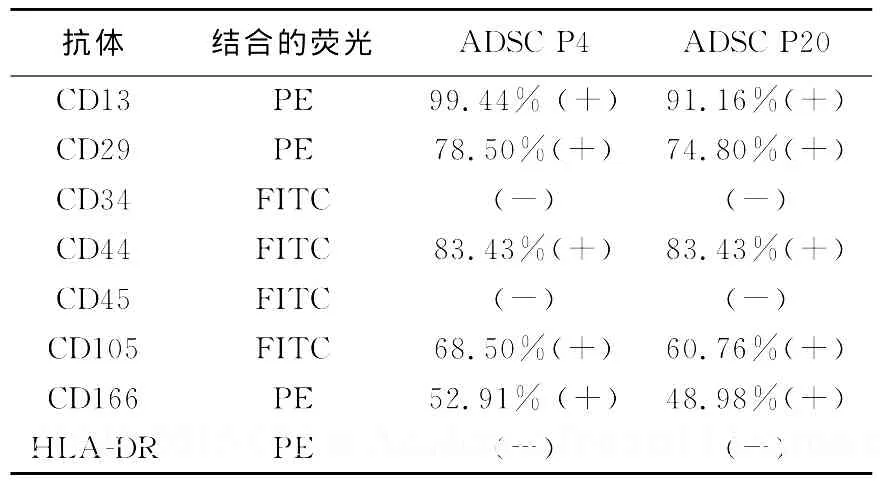
表1 第4和第20代脂肪干细胞表面CD标志物的表达Tab.1 Expression of cell surface CD markers of ADSCs of passages 4 and 20
2.4 转录因子的表达
第4和20代细胞转录因子Nanog、Oct-4、Sox-2和Rex-1都呈阳性表达,两者的表达率R没有显著性差异.第30代细胞 Nanog、Oct-4、Sox-2和Rex-1 m RNA虽然也呈阳性表达,但表达率明显低于其他两代细胞(P<0.05)(图5(a)、6(a)).每14 d传代得到的25代细胞Nanog、Oct-4、Sox-2和Rex-1的表达率明显高于每5 d传代得到的25代细胞的表达率(图5(b)、6(b)).
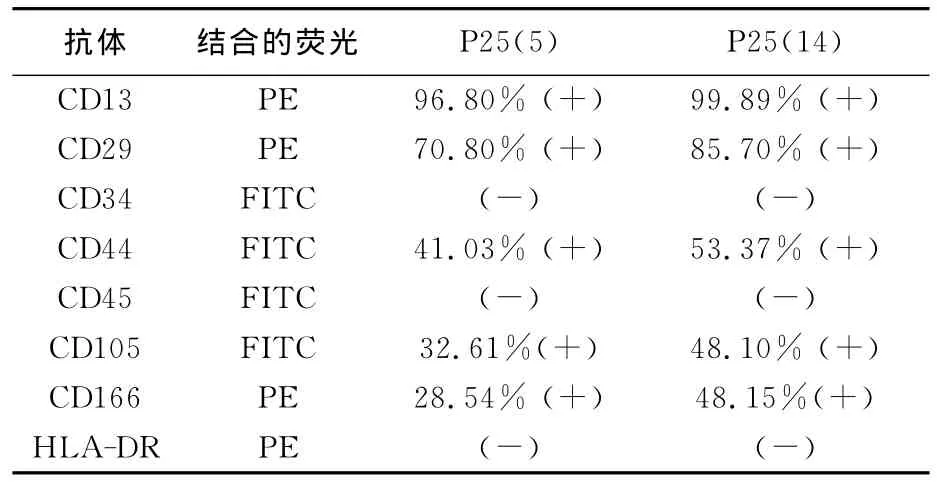
表2 两种传代方法得到的25代细胞表面CD标志的表达Tab.2 Expression of cell surface CD markers of ADSC of passage 25 with two subculture methods
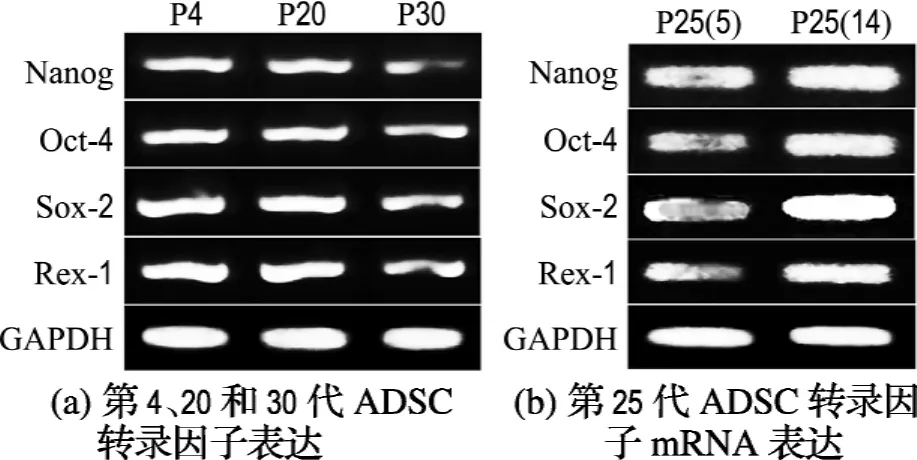
图5 不同代数脂肪干细胞转录因子m RNA的表达情况Fig.5 Transcription factors mRNA expression in h ADSC of different passages
2.5 多向分化潜能
2.5.1 成脂肪潜能 ADSCs经脂肪诱导液向脂肪诱导分化5 d后,胞浆内出现少量脂滴并逐渐聚集.8 d后,细胞形态发生明显改变,从长梭形类成纤维细胞外观逐渐变圆,并且开始出现充满脂滴的细胞.脂肪分化诱导2周后出现了大量的脂滴(图7(a1)).油红“O”染色后细胞内出现大量红染颗粒(图7(a2)、(a3)、(a4)),证明镜下所见细胞内颗粒确为脂滴.另外,从半定量分析结果(图8)可知,第25代细胞成脂肪能力明显弱于第4代细胞.而2个25代细胞的成脂肪潜能没有显著性差异.
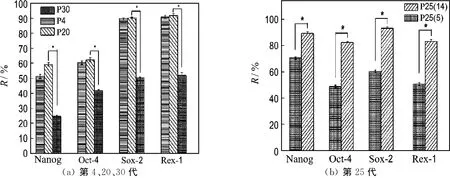
图6 RT-PCR结果半定量分析Fig.6 Semiquantitative RT-PCR analysis
2.5.2 成骨潜能ADSCs 成骨诱导后约7 d长满单层,生长略慢.细胞多为梭形,随时间延长,密度增高,细胞呈多层生长,细胞外分泌基质增多.经ALP染色后见第4代细胞具有较强的碱性磷酸酶的活性(图7(b2)),而第25代细胞诱导7 d后碱性磷酸酶的活性明显低于第4代(图7(b3)、7(b4)).14 d时有局灶型点状钙化斑形成,21 d时形成明显的矿化结节沉积,随诱导时间增加,结节状沉积愈加明显,颜色加深.Von Kossa染色显示结节状沉积为黑色(图7(c2)、(c3)、(c4)),证实了结节状沉积为钙盐沉积.同样,第25代细胞形成的钙化结节明显少于第4代细胞.2个25代细胞碱性磷酸酶活性和钙化结节形成都没有显著性差异(图8).

图7 脂肪干细胞多向分化潜能的检测Fig.7 Multi-differentiation potentials of h ADSCs toward mesodermal and endodermal lineages
2.5.3 成软骨潜能 经软骨诱导液培养后,细胞体积增大,生长相对变慢,细胞由成纤维样变为椭圆形及三角形,有的呈肾形(图7(d1)).诱导培养14 d可见细胞周围有基质分泌.甲苯胺蓝染色后,可见大量异染性基质,呈蓝紫色(图7(d2)、(d3)、(d4)),表现为软骨细胞分化特点(见图4).2个25代细胞成软骨潜能没有显著性差异,但都明显低于第4代细胞.
2.5.4 成心肌潜能 5-氮胞苷作用24 h,继续培养4周后细胞重叠生长,但并没有发现明显的形态学改变和自发搏动的细胞.荧光染色后显微镜下观察,第4代ADSC少有的几个细胞出现绿色荧光(图7(e2)),而第25代细胞诱导染色后未见绿色荧光(图7(e3)、(e4)).
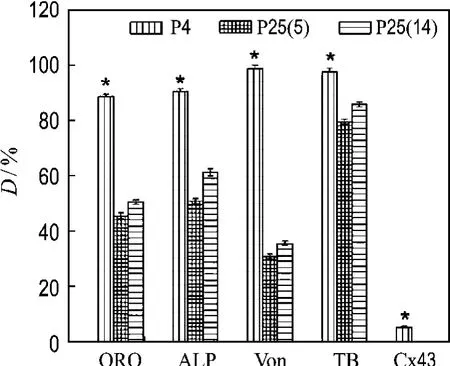
图8 脂肪干细胞分化率的半定量分析Fig.8 Semiquantitative analysis of differentiation ratio of ADSCs
3 讨 论
用本文改进的分离方法,每500 mg脂肪组织平均可获得5×105个干细胞,比文献报道的细胞获得率[4]高20倍以上.这是因为本文应用胰酶和胶原酶联合消化,可大大缩短消化时间,从而避免了酶对细胞的过度损伤.此外,为排除红细胞的干扰,一般都使用NH4Cl破坏红细胞[5],而本文是通过换液的方法去除红细胞,2次换液后红细胞基本消失,这样就避免了NH4Cl对细胞的损伤.
本文分离培养的ADSC比前人的具有更强的增殖能力,25 d内出现3个对数增殖期,虽然在每个对数增殖期末有生长停滞现象,镜下可观察到细胞出现接触抑制,有少量细胞死亡,但通过反馈作用细胞又继续分裂增殖,进入另一个增殖高峰.ADSC 如此强的增殖能力是以前报道[6、7]中从未出现过的.
虽然体外长期传代培养后ADSC仍能保持较强的增殖能力,但还是随着传代次数的增加有所下降,表明传代时胰酶的作用会对细胞造成一定的损伤.为减少胰酶的作用次数,本文将培养至20代的细胞分别按常规5 d传代,或14 d传代,传至25代时发现每14 d传代得到的细胞增殖力略高于每5 d传代得到的细胞,并且细胞数量是常规传代的20倍.
本文所培养的ADSC其CD34和CD45都呈阴性表达,HLA-DR作为排除成纤维细胞的表面标志也是持续阴性表达,这可以为ADSC的自体或同种异体移植提供理论依据.同时CD13、CD29、CD44、CD105和CD166都呈阳性表达,与其他研究结果一致[2、8].间充质标志物持续表达说明贴壁的ADSC可以增殖而没有丢失干细胞相关的表面标志物,反映了ADSC向间充质起源细胞系的分化能力,如脂肪、软骨和成骨.
转录因子 Nanog、Oct-4、Sox-2和 Rex-1,特别是Oct-4、Nanog和Sox-2在指导干细胞的多向分化潜能中起着重要的作用[9].本文培养的ADSC传至30代时仍能表达 Oct-4、Nanog、Sox-2和Rex-1 mRNA,而且每隔14 d传代得到的25代细胞的表达率高于每隔5 d传代得到的细胞.因为这4个转录因子启动、维持并调节多能干细胞的分化潜能[10],因此每隔14 d传代得到的细胞与常规传代的细胞相比具有更强的分化潜能.
4 结 语
本研究方法可以从500 mg人脂肪组织中获得5×105个干细胞,而且所分离的细胞可快速长期持续增殖(3~4 d即可达到95%融合,1个月出现3个对数增殖期);增殖至25代以上仍能较好保持干细胞表型特征和多向分化潜能;如果每隔14 d传代而非常规5 d传代,可获得更多更高质量的干细胞.因此ADSC相对于MSC是一个更好的干细胞资源,在细胞移植和组织工程中将有很好的应用前景.
[1]ZUK P A, ZHU M, MIZUNO H,etal.Multilineage cells from human adipose tissue:implications for cell-based therapies [J]. Tissue Engineering,2001,7(2):211-228
[2]LEI L,LIAO W M,SHENG P Y,etal.Biological character of human adipose-derived adult stem cells and influence of donor age on cell replication in culture[J].Science in China Series C:Life Sciences,2007,50(3):320-328
[3]WANG D W,FERMOR B,GIMBLE J M,etal.Influence of oxygen on the proliferation and metabolism of adipose derived adult stem cells [J].Journal of Cellular Physiology,2005,204(1):184-191
[4]AUST L,DEVLIN B,FOSTER S J,etal.Yield of human adipose-derived adult stem cells from liposuction aspirates[J].Cytotherapy,2004,6(1):7-14
[5]REZA I,CYNTHIA T,BINDIYA P,etal.Biologic properties of mesenchymal stem cells derived from bone marrow and adipose tissue [J].Journal of Cellular Biochemistry,2006,99(5):1285-1297
[6]朱 茗,高建华,鲁 峰,等.脂肪组织来源干细胞的细胞生物学研究[J].南方医科大学学报,2007,27(4):518-523
[7]PENG L,LI H,GU L,etal.Comparison of biological characteristics of marrow mesenchymal stem cells in hepatitis B patients and normal adults[J]. World Journal of Gastroenterology, 2007,13(11):1743-1746
[8]SCHAFFLER A,BUCHLER C.Concise review:Adipose tissue-derived stromal cells-basic and clinical implications for novel cell-based therapies [J].Stem Cells,2007,25(4):818-827
[9]GONZALEZA R,MAKIA C B,PACCHIAROTTI J,etal. Pluripotent marker expression and differentiation of human second trimester mesenchymal stem cells [J]. Biochemical and Biophysical Research Communications,2007,362(2):491-497
[10]LI X,KATO Y,TSUNODA Y.Comparative analysis of development-related gene expression in mouse preimplantation embryos with different developmental potential[J].Molecular Reproduction and Development,2005,72(2):152-160
