2,3-丁二醇发酵过程的菌体生物质回收利用初步研究
2010-06-04孙金杰,郝英利,周文瑜等
目前,国内外生物行业发展迅速。在微生物发酵过程中,发酵末期的菌体往往不是目的产物,因此会产生大量的废菌体。一般的处理方法是将废菌体在污水处理厂中分解,或是燃烧处理,这不仅污染环境、破坏生态,也造成了严重的资源和能源浪费[1~5]。若能循环利用废菌体,不仅可以节能减排,还可节约资源,对于建设科技含量高、资源消耗少、环境污染小的新型产业具有重大而深远的意义。
2,3-丁二醇(BD)是一种很有潜力的替代能源,燃烧值为27 200 kJ·kg-1,可进一步制得多种用途广泛的衍生物,如甲乙酮、1,3-丁二烯[6]、辛烷[7]等。在脱氢酶的作用下,2,3-丁二醇可以氧化生成3-羟基-2-丁酮(乙偶姻,AC),AC是一种应用广泛、令人喜爱的食用香料[8,9]。国内市场近几年对2,3-丁二醇的需求逐年上升。
作者尝试将粘质沙雷氏菌利用蔗糖生产2,3-丁二醇发酵过程中的废菌体回收处理,研究并优化回收废菌体作为发酵培养基成分的方法。将废菌体进行离心、悬浮、高压均质、再离心等处理后,制备成溶菌液,作为发酵培养基中的氮源。对酵母粉和溶菌液分别作为氮源的发酵效果进行了比较,对多次回收废菌体制备的溶菌液作为发酵培养基中的氮源进行了研究,并将溶菌液作为氮源的发酵条件在3.7 L发酵罐上进行放大验证实验。
1 实验
1.1 溶菌液的制备
发酵末期的发酵液,用冷冻离心机于7000 r· min-1离心60 min,得到菌体沉淀,-20℃下冷冻保藏待用[10]。
融化冷冻的菌体,按菌体沉淀与去离子水质量比约为1∶4的比例,将菌体沉淀悬浮于去离子水中,得到悬浮菌液。在冷冻-融化的过程中,部分菌体发生了破碎。悬浮菌液在高压均质机的作用下进行细胞破碎,压力为80 MPa,循环破碎3次,温度保持在30℃以下。均质后的液体,先用冷冻离心机于7000 r· min-1离心60 min,将较大颗粒沉淀去除,再用冷冻离心机于10 000 r· min-1离心30 min,去除沉淀,得到的上清液即为溶菌液。溶菌液在-20℃下冷冻保藏待用。
以酵母粉为氮源进行发酵,所得废菌体制备成的溶菌液为Lysate 1;以Lysate 1为氮源进行发酵,所得废菌体制备成的溶菌液为Lysate 2。
1.2 菌种和培养基
粘质沙雷氏菌(Serratiamarcescens),自行保藏,保存于斜面培养基中。
斜面培养基(g·L-1):葡萄糖 20,酵母粉 10,蛋白胨 10,琼脂粉 20,以NaOH调pH值7.0~7.2,115℃灭菌20 min。
种子培养基(g·L-1):葡萄糖10,酵母粉1,蛋白胨2,(NH4)2SO46,K2HPO410,NaCl 0.5,MgSO40.5,接种前以NaOH调pH值7.0~7.2,115℃灭菌20 min。
基础发酵培养基(g·L-1) :蔗糖90,酵母粉25,柠檬酸三钠14,MnSO40.05,NH4H2PO43,FeSO40.02,MgSO40.5,以NaOH调pH值7.0~7.2,115℃灭菌20 min。
优化发酵培养基Ⅰ:以含氮量相当于25 g·L-1酵母粉的Lysate 1代替基础发酵培养基中的酵母粉作为氮源。
优化发酵培养基Ⅱ:以含氮量相当于25 g·L-1酵母粉的Lysate 2代替基础发酵培养基中的酵母粉作为氮源。
1.3 仪器
KLF2000型3.7 L比欧发酵罐;Beckman J-26XP型离心机、J2-HS型离心机;AH110B型高压均质机;UV-2008H型分光光度计;Aglient GC 9860型气相色谱议;Vario EL Ⅲ型元素分析仪。
1.4 培养方法
1.4.1 菌种活化
取保藏菌种,划线接种于斜面培养基中,30℃ 恒温培养约24 h。
1.4.2 种子培养
在250 mL摇瓶中装入30 mL种子培养基,接两环保存在斜面培养基上的种子至种子培养基中,于30℃、200 r· min-1下摇床培养11~12 h。
1.4.3 摇瓶发酵培养
Yeast extract组和Lysate组分别利用基础发酵培养基和优化发酵培养基Ⅰ。按5%(体积分数)的接种量转接种子液至装有50 mL发酵培养基的250 mL摇瓶中,于30℃、200 r· min-1下摇床培养,蔗糖消耗完,发酵结束。
1.4.4 以多次回收废菌体制备的溶菌液作为氮源的摇瓶发酵培养
Yeast extract组、Lysate 1组和Lysate 2组分别利用基础发酵培养基、优化发酵培养基Ⅰ和优化发酵培养基Ⅱ。按5%(体积分数)的接种量转接种子液至装有50 mL发酵培养基的250 mL摇瓶中,于30℃、200 r· min-1下摇床培养,蔗糖消耗完,发酵结束。
1.4.5 连续补料发酵培养
利用优化发酵培养基Ⅰ。取100 mL种子液接种于3.7 L比欧发酵罐,起始装液量为1.8 L,起始搅拌转速为300 r· min-1,通气量为1 vvm,发酵温度为30℃。初始蔗糖浓度为90 g·L-1,当残留蔗糖(Residual sucrose)浓度小于10 g·L-1时,采用流加式连续补料,补入浓度为80%的蔗糖水溶液,使发酵罐中残留蔗糖浓度保持在10~30 g·L-1。培养41~45 h,发酵结束。根据实验要求,通过调节搅拌转速来实现发酵液中的不同溶氧水平。
1.5 测定方法
1.5.1 菌体浓度测定
采用分光光度计在波长600 nm下测定吸光度(OD),细胞干重(DCW,g·L-1)由标准曲线(DCW=0.422×OD-0.0363)换算获得。
1.5.2 发酵液中残留蔗糖浓度的测定
样品经离心,取上清液用2 mol·L-1H2SO4水解,再用4 mol·L-1NaOH中和,用葡萄糖液体试剂盒(上海捷门生物技术公司)测出葡萄糖浓度,再换算成残留蔗糖浓度。
1.5.3 产物测定
发酵液离心后用乙酸乙酯萃取,通过气相色谱仪来测定AC和BD的浓度。
色谱柱采用毛细管柱DB-5,并采用FID氢火焰检测器,氮气作为载气,流速为1 mL· min-1,柱温为50℃,保留1.5 min,25℃· min-1升温到180℃,保留10 min,进样口温度为215℃,检测器温度为245℃。
1.5.4 酵母粉和溶菌液中含氮量和含碳量的测定
用真空冷冻干燥机将溶菌液冷冻干燥制成粉末;用元素分析仪测定酵母粉和溶菌液粉末中碳、氮、氢元素的含量[11]。根据酵母粉和溶菌液的含氮量,确定发酵培养基中添加溶菌液的量。
2 结果与讨论
2.1 酵母粉和溶菌液的含氮量
酵母粉和溶菌液粉末中碳、氮、氢元素的含量如表1所示。

表1 酵母粉和溶菌液中N、C、H元素的含量
由表1可知,Lysate 1比安琪酵母粉的含氮量低,Lysate 2比Lysate 1的含氮量低。这可能是因为,利用溶菌液作为氮源进行发酵,由于缺少某些金属离子,菌体衰亡比较快,菌体碎片和灵菌红素等物质较多,因此,经高压均质等工艺制备成的溶菌液含氮量较低。
2.2 摇瓶发酵培养
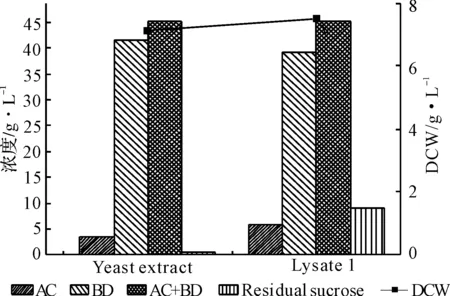
图1 酵母粉和溶菌液作为氮源的比较
由图1可知,从菌体生长情况看,溶菌液作为氮源比酵母粉作为氮源的最大细胞干重要大,达7.5 g·L-1,说明利用溶菌液作为氮源对于菌体生长没有不利的影响;18 h发酵结束时,酵母粉作为氮源的残留蔗糖浓度为0.5 g·L-1,而溶菌液作为氮源的残留蔗糖浓度为9.04 g·L-1,此时,两者的BD浓度分别为41.6 g·L-1和39.3 g·L-1,产物浓度相当。由此可知,用溶菌液代替酵母粉作为氮源进行发酵具有可行性。
2.3 多次回收溶菌液作为氮源实验(图2)

图2 多次回收废菌体制成溶菌液的分批实验
由图2可知,与利用酵母粉和Lysate 1相比,利用Lysate 2的菌体生长情况相差不大,最大细胞干重为7.65~7.83 g·L-1;但是利用Lysate 2的BD浓度略低于利用酵母粉和Lysate 1,酵母粉和Lysate 1作为氮源发酵末期的BD浓度分别为41.6 g·L-1和43.7 g·L-1,而Lysate 2作为氮源发酵末期的BD浓度为38.2 g·L-1。虽然利用Lysate 2作为氮源发酵末期的BD浓度偏低,但是AC和BD的总浓度与利用酵母粉的相当,分别为45.28 g·L-1和45.08 g·L-1。利用Lysate 2部分取代氮源对于节能减排具有积极的意义,可以通过优化,在发酵培养基中添加一些元素,弥补Lysate 2中不足的成分,提高合成BD的浓度。
2.4 连续补料发酵培养(图3)
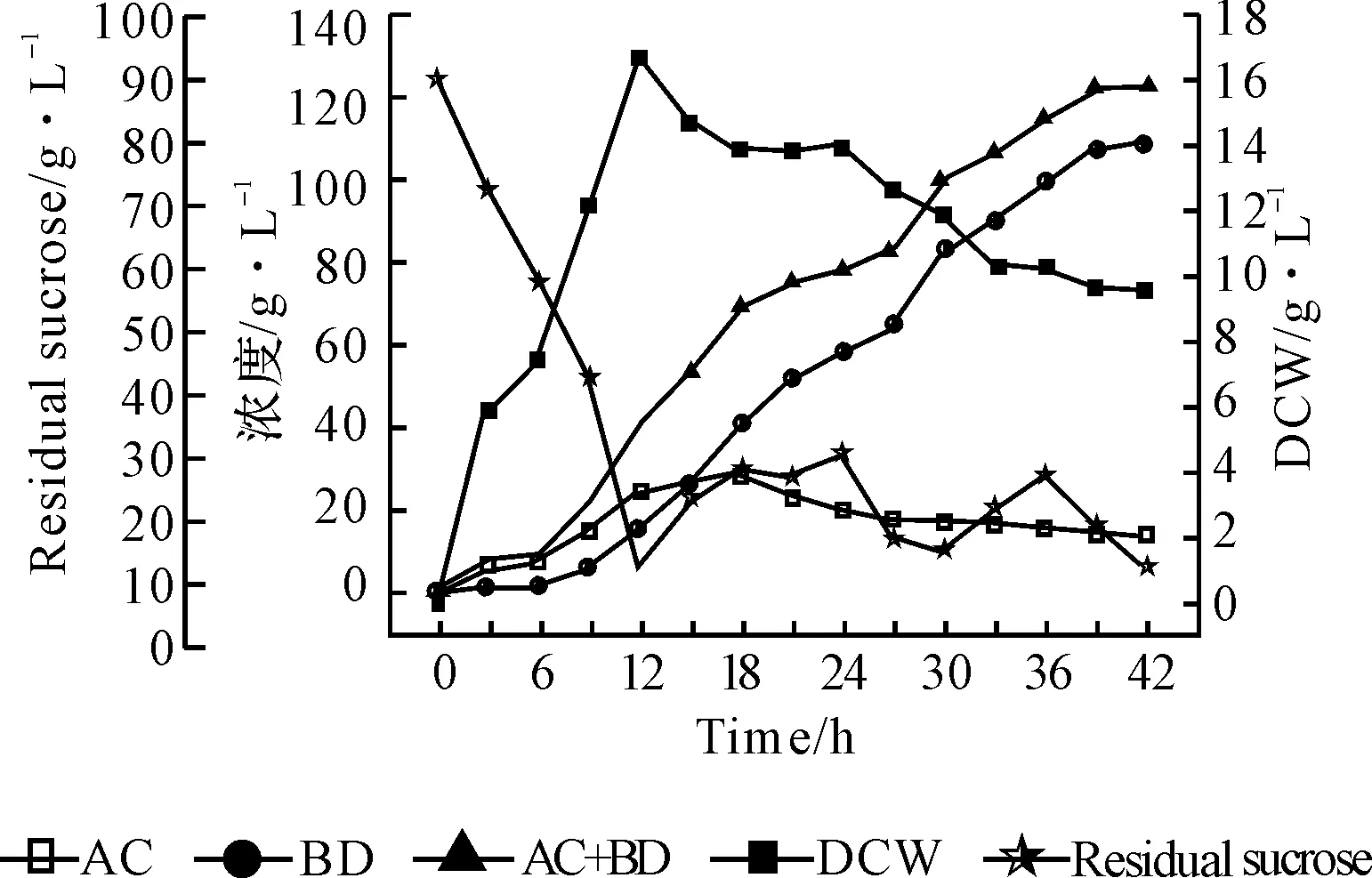
图3 溶菌液作为氮源的3.7 L发酵罐实验
连续补料发酵培养,42 h 结束时,BD浓度为109.2 g·L-1,残留蔗糖浓度为5.2 g·L-1,共有221.95 g·L-1蔗糖被消耗,2,3-丁二醇转化率达到0.492 g·g-1,产率达到2.6 g·L-1·h-1。2,3-丁二醇发酵属于微耗氧发酵,对氧的要求非常严格,其途径是一种混合酸途径,形成的有机酸包括乙酸、乳酸和丁二酸等[12]。由图3可以看出,发酵后期,菌体浓度下降趋势较快,这可能是发酵后期有机酸等副产物积累过多所致。
2.5 讨论
本研究中,溶菌液是回收发酵末期粘质沙雷氏菌废菌体制备而成,溶菌液含有可供菌体生长和产物合成的某些营养物质,特别是各种氨基酸类物质[13],可替代酵母粉,作为发酵培养基中的氮源。另外,溶菌液具有制备工艺简单的特点。因此,不但可以一定程度上减少发酵过程中废菌体的排放,还可以减少对部分原料的需求。
3 结论
将粘质沙雷氏菌利用蔗糖生产2,3-丁二醇发酵末期的废菌体回收利用,制备成溶菌液,替代发酵过程中的氮源。摇瓶发酵培养中,2,3-丁二醇浓度为 39.3 g·L-1,与酵母粉作为氮源相比,产物浓度相当。多次回收废菌体制成溶菌液替代酵母粉作为氮源,2,3-丁二醇浓度略低。连续补料发酵培养中,共有221.95 g·L-1蔗糖被利用,2,3-丁二醇最高浓度为109.2 g·L-1,2,3-丁二醇转化率达到0.492 g·g-1、产率达到2.6 g·L-1·h-1。由此表明,回收废菌体基本具有节能减排的可行性。
参考文献:
[1] Blaesen M,Friehs K,Flaschel E.Produktintegrierter umweltschutz am beispiel der rückführung bakterieller biomasse[J].Chemie Ingenieur Technik,2006,78(3):267-272.
[2] Friehs K,Schierl F,Flaschel E.Aufbereitung bakterieller biomasse zwecks rückführung als mediumskomponente in fermentationsprozesse[J].Chemie Ingenieur Technik,1998,70(4):435-437.
[3] Risse J M,Friehs K,Flaschel E.Biomasserückführung am beispielBacilluslicheniformis[J].Chemie Ingenieur Technik,2000,72 (7):750-754.
[4] Yang Yun-Jeong,Hwang Sung-Ho,Lee Sang-Mok,et al.Continuous cultivation ofLactobacillusrhamnosuswith cell recycling using an acoustic cell settler[J].Biotechnology Bioprocess Engineering,2002,7(6):357-361.
[5] Roca C,Olsson L.Increasing ethanol productivity during xylose fermentation by cell recycling of recombinantSaccharomycescerevisiae[J].Appl Microbiol Biotechnol,2003,60(5):560-563.
[6] 王迪,王凡强,王建华.发酵法生产2,3-丁二醇[J].精细与专用化学品,2000,(7):20-21.
[7] Long S K,Patrick R.The present statue of the 2,3-butylene glycol fermentation[J].Advances in Applied Microbiology,1963,175(5):135-155.
[8] 张小舟,曾崇余,任晓乾.乙偶姻合成工艺[J].南京化工大学学报,2001,23(4):54-57.
[9] 张小舟,曾崇余,任晓乾.乙偶姻合成研究现状及展望[J].江苏化工,2001,29(2):29-31.
[10] Blaesen M,Flaschel E,Friehs K.Sustainable production:Recycling of bacterial biomass resulting from a fermentation process withKlebsiellaplanticola[J].Chemical and Biochemical Engineering,2006,20(3):263-268.
[11] Schumacher Elke,Dindorf Willi,Dittmar Manuela.Exposure to toxic agents alters organic elemental composition in human fingernails[J].Science of the Total Environment,2009,407(7):2151-2157.
[12] 杨云龙,张燎原,孙建安,等.粘质沙雷氏菌利用蔗糖和柠檬酸铵生产2,3-丁二醇的研究[J].化学与生物工程,2009,26(9):41-44.
[13] Blaesen Markus,Friehs Karl,Flaschel Erwin.Recycling of bacterial biomass in a process of L-threonine production by means of a recombinant strain ofEscherichiacoli[J].Journal of Biotechnology,2007,132(4):431-437.
