荧光法研究钙离子存在下槲皮素与牛血清白蛋白的相互作用
2010-06-04吕鉴泉,舒韵,周娟等
槲皮素(Quercetin,Qct)是一种植物中广泛存在的生理及药理活性显著的多羟基黄酮类化合物,具有防治心血管疾病、增强免疫、抗癌、抗菌、抗炎、抗病毒等功能[1~5],受到人们的广泛关注[6]。其中槲皮素与生物大分子的相互作用成为研究的焦点。有研究者[7~9]用荧光光谱法研究了槲皮素和牛血清白蛋白相互作用的光谱特征,丁德智等[10]用荧光光谱法研究了槲皮素和人血清白蛋白的相互作用,刘源[11]用荧光光谱法研究了黄酮类化合物(槲皮素)与核酸的相互作用,周新等[12]用亲和毛细管电泳法测定了槲皮素与人血清白蛋白的结合常数,陈代武等[13]用荧光光谱法研究了碳纳米管存在下槲皮素与牛血清白蛋白的相互作用,建立了“光内滤所致猝灭”的定量评估体系。
上述研究均只针对理想状况下槲皮素与生物大分子的相互作用。然而,在生命体内存在大量金属离子,这些离子势必对槲皮素与生物大分子的相互作用产生影响。鉴于牛血清白蛋白(Bovine serum albumin,BSA)是血浆中含量最丰富的重要载体蛋白,具有储运内源性代谢产物和外源性药物小分子等重要生理功能,作者先后探索了在模拟生理条件和金属离子存在下喹若酮药物与牛血清白蛋白的相互作用[14,15]。在此,采用荧光法研究在模拟生理条件和钙离子存在下,槲皮素与牛血清白蛋白的相互作用规律。
1 实验
1.1 试剂与仪器
槲皮素,Alfa Aesar公司;牛血清白蛋白(BSA),武汉天源生物技术有限公司;其它试剂均为国产分析纯;实验用水为超纯水。
1.0×10-4mol·L-1的牛血清白蛋白溶液:取适量牛血清白蛋白溶于pH=7.4的0.05 mol·L-1Tris-HCl缓冲溶液(内含0.15 mol·L-1NaCl,以调节离子强度),冰箱保存。
1.0×10-3mol·L-1槲皮素溶液:取适量槲皮素溶于无水乙醇;操作液浓度为4.0×10-5mol·L-1。
1.0×10-3mol·L-1CaCl2溶液,pH值 7.4的Tris-HCl 缓冲溶液。
F-4500型荧光分光光度计,日本日立公司。
1.2 方法
准确移取0.1 mL 1.0×10-4mol·L-1BSA溶液于10 mL比色管中,再分别加入一定量的槲皮素、钙离子溶液,用水定容至刻度,摇匀。荧光分光光度计的激发和发射光栅狭缝均设置为5 nm,记录激发波长为282 nm时混合溶液(在1 cm比色皿中)在290~550 nm范围内的荧光光谱。
2 结果与讨论
2.1 钙离子、槲皮素存在下BSA的荧光光谱(图1)
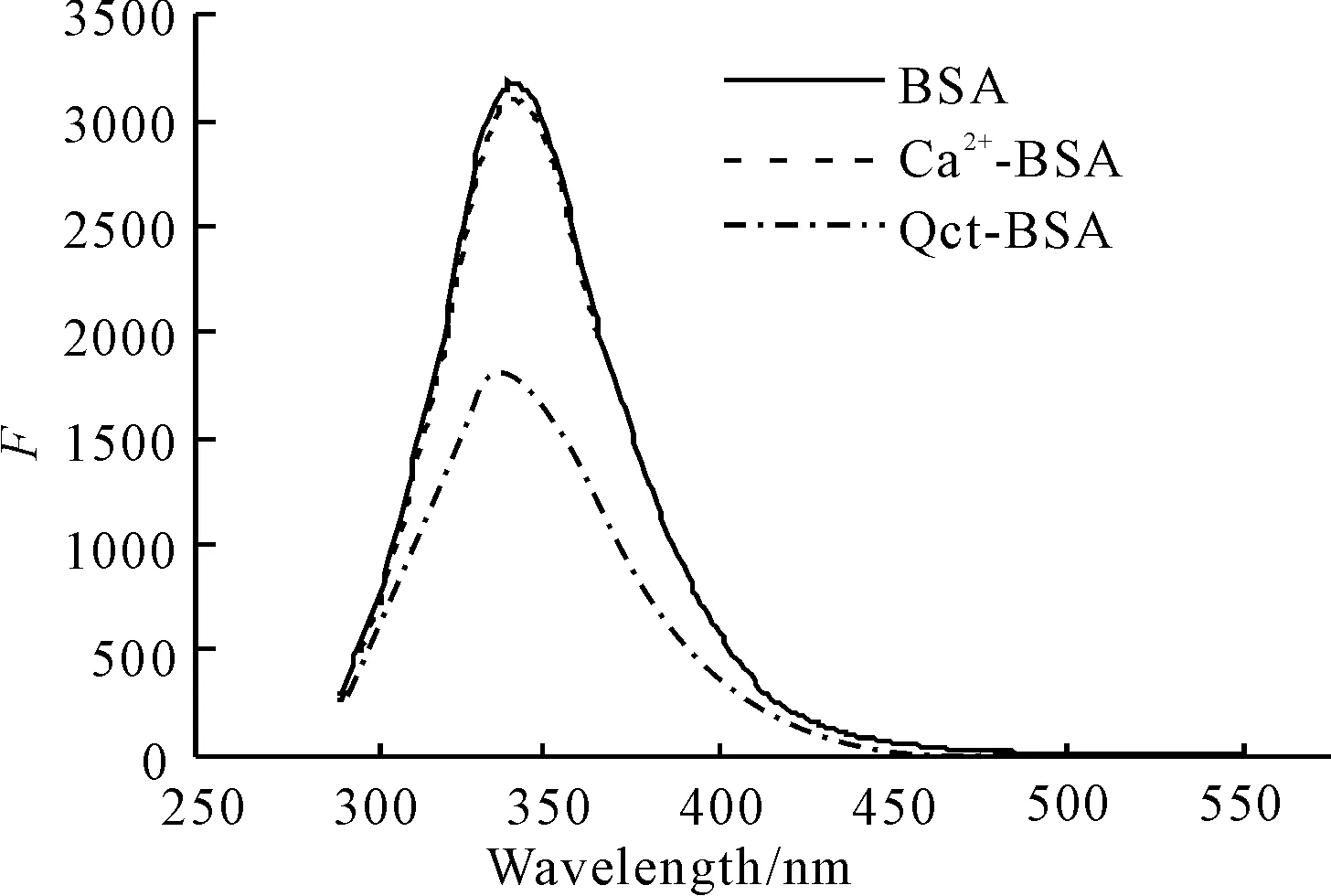
λex=282 nm,cBSA=cCa2+=cQct=1.0×10-6 mol·L-1
由图1可知,BSA 的荧光峰位于340 nm处,分别加入相同浓度的钙离子和槲皮素后,BSA 的荧光峰波长没有发生变化,但荧光强度均有一定的降低,其中钙离子致使BSA荧光降低的程度较缓,而相同浓度的槲皮素则使BSA荧光显著降低。表明槲皮素和钙离子分别可以与BSA发生相互作用。
2.2 槲皮素对BSA荧光的影响(图2)
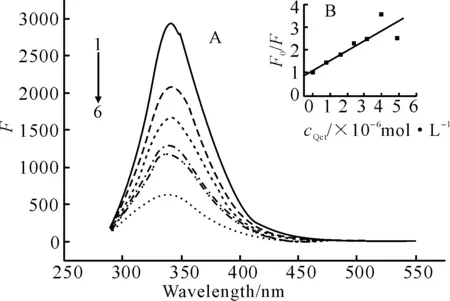
λex/λem=282 nm/340 nm,cBSA为1.0×10-6 mol·L-1,1~6.cQct(×10-6mol·L-1)为0,0.8,1.6,2.4,3.2,4.0
由图2可知,随着槲皮素浓度的增加,BSA的荧光强度明显降低,且激发峰与发射峰的峰形基本不变,说明槲皮素对BSA的荧光有猝灭作用。
荧光猝灭的性质用Stern-Volmer方程[式(1)]来考察。
F0/F=1+Ksv·cQct=1+Kqτ0cQct
(1)
式中:F0是加入猝灭剂前BSA 溶液的荧光强度;F是加入猝灭剂后BSA 溶液的荧光强度;cQct是猝灭剂的总浓度;Ksv描述了生物大分子与荧光猝灭剂分子彼此扩散和相互碰撞到达动态平衡时的量效关系;Kq为双分子表观猝灭常数,反映体系中分子的彼此扩散和相互碰撞对生物大分子荧光寿命衰减速率的影响;τ0为猝灭剂不存在时荧光分子的平均寿命,生物大分子的平均寿命约为10-8s[16]。
按照实验方法测出加入不同浓度的槲皮素后BSA荧光强度的变化,由式(1)绘制BSA荧光猝灭的Stern-Volmer 曲线(图 2B),由该直线斜率求出该体系的猝灭常数Kq为5.304×1013L ·mol-1·s-1。
一般说来,引起荧光猝灭的原因主要有动态猝灭和静态猝灭。动态猝灭是一种能量转移或电子转移过程,不影响蛋白质的结构和生理活性;静态猝灭则是由于发生了配合作用,通常是产生了不发荧光的配合物,对蛋白质的二级结构可产生影响,并可影响其生理活性。对于各类猝灭剂对生物大分子荧光的作用,其最大动态荧光猝灭常数约为 2.0×1010L·mol-1·s-1[17]。本研究所得到的猝灭常数为5.304×1013L ·mol-1·s-1,远大于2.0×1010L ·mol-1·s-1。由此可推断,槲皮素对BSA荧光的猝灭不是动态碰撞引起的,而是由于药物和蛋白形成了配合物而导致的静态猝灭。这一结论,与文献报道一致[18]。
根据静态猝灭理论,有:
log[(F0-F)/F]=logK+nlogcQct
(2)
式中:K为猝灭剂与BSA分子的结合常数;n为结合位点数。
以log[(F0-F)/F]对logcQct作图得一直线,由直线斜率和截距求出槲皮素和BSA的结合常数为5.905×105L·mol-1、结合位点数为1.012。由所得的结合常数可以看出,槲皮素与BSA之间有较强的结合作用。
2.3 槲皮素-钙离子对BSA荧光的影响(图3)
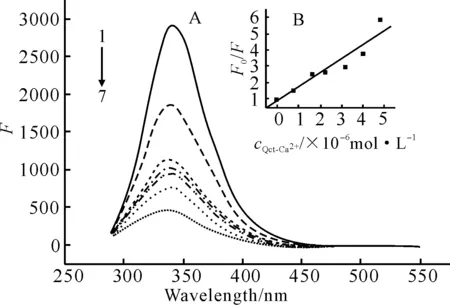
λex/λem=282 nm/340 nm,cBSA=1.0×10-6 mol·L-1,1~7.cQct=cCa2+(×10-6 mol·L-1)为0,0.8,1.6,2.4,3.2,4.0,4.8
由图3可知,随着槲皮素-钙离子浓度的增加,BSA的荧光强度较单用槲皮素降低更明显,且激发峰与发射峰的峰形基本不变,说明槲皮素-钙离子对BSA的荧光有猝灭作用。
同时,由式(1)绘制BSA荧光猝灭的Stern-Volmer曲线(图3B),由该直线斜率得到槲皮素-钙离子猝灭BSA的猝灭常数Kq为8.672×1013L ·mol-1·s-1,也远大于2.0×1010L ·mol-1·s-1,说明槲皮素-钙离子猝灭BSA荧光的过程也为静态猝灭。
以log[(F0-F)/F]对logcQct-Ca2+作图,得一直线,由直线斜率和截距求出槲皮素-钙离子和BSA的结合常数为1.245×106L·mol-1、 结合位点数为1.037。由所得的结合常数可以看出,槲皮素-钙离子和BSA之间有较强的结合作用,较槲皮素与BSA之间的更强。
2.4 槲皮素-钙离子猝灭BSA荧光的机理
将槲皮素-牛血清白蛋白、槲皮素-钙离子-牛血清白蛋白体系的结合参数进行比较,结果见表1。

表1 二个体系结合参数的比较
由表1可知:(1)槲皮素和钙离子共存下对BSA的猝灭程度和猝灭常数强于单用槲皮素;(2)槲皮素-钙离子-BSA的结合常数大于槲皮素- BSA的结合常数;(3)槲皮素-钙离子-BSA的结合位点数略多于槲皮素- BSA的结合位点数。
二个体系的参数存在明显的差异,这可能是因为:(1)槲皮素和钙离子协同猝灭BSA的荧光,即BSA荧光的猝灭是两者各自猝灭的累加;(2)槲皮素与钙离子形成配合物后再对BSA的荧光有猝灭作用。针对可能的机理,设置实验予以探讨。
一方面,配制系列槲皮素、钙离子和槲皮素-钙离子的溶液,加入到相同浓度的BSA溶液中,再按照实验方法测定BSA的荧光强度。结果表明,在相同浓度的情况下,三个体系对BSA荧光的猝灭程度大不相同,以槲皮素-钙离子最强、槲皮素次之、钙离子最弱,并且槲皮素-钙离子体系对BSA荧光的减弱值远强于相同浓度下槲皮素和钙离子对BSA荧光减弱值的加和。这说明,槲皮素-钙离子猝灭BSA的荧光不是槲皮素和钙离子各自猝灭的简单累加。
另一方面,考察了样品加入方式对BSA荧光猝灭的影响,分别采用槲皮素和钙离子混合后加入BSA溶液、钙离子加入BSA溶液混合后再加槲皮素溶液、槲皮素加入BSA溶液混合后再加钙离子溶液等三种方式。结果表明,槲皮素与钙离子混合对BSA荧光的减弱值最大,其它两种方式的减弱值基本相仿但与前者有较大的差别。
基于上述分析,作者认为:在所研究的三元体系中,槲皮素与钙离子形成配合物,钙离子的存在促进了槲皮素与牛血清白蛋白的相互作用,这可能就是药物在生理条件和金属离子的存在下更易被蛋白质储存和运输的原因。
3 结论
通过荧光光谱法研究了钙离子存在下槲皮素和牛血清白蛋白的相互作用。结果表明,同槲皮素一样,槲皮素-钙离子以形成配合物的方式静态猝灭牛血清白蛋白的内源性荧光,钙离子在一定范围内对槲皮素与牛血清白蛋白的结合起着重要的作用。槲皮素与牛血清白蛋白、槲皮素-钙离子与牛血清白蛋白的表观结合常数/结合位点数分别为5.905×105L·mol-1/1.012、1.245×106L·mol-1/1.037。
参考文献:
[1] 吕蔡,张杰.槲皮素的药理作用[J].国外医药·植物药分册,2005,20(3):108-112.
[2] 宋玉乔,姚凌云,曹蔚,等.槲皮素的药理作用研究近况[J].西北药学杂志,2002,17(1):40-42.
[3] 王艳芳,王新,朱宇同.槲皮素药理作用研究进展[J].天然产物研究与开发,2003,15(2):171-173.
[4] 赵雪英,顾振纶.槲皮素对培养内皮细胞产生和释放内皮素和环磷酸鸟苷的影响[J].中国药理学报,1996,17(5):442-447.
[5] 龚珊,张玉英,俞光第,等.槲皮素镇痛作用的观察[J].中草药,1996,27(10):612-613.
[6] Rice-Evans C.Flavonoid antioxidants[J].Curr Med Chem,2001,8(7):797-807.
[7] 廖卫平,司芝坤.荧光光谱法研究槲皮素与牛血清白蛋白的相互作用[J].烟台大学学报(自然科学与工程版),2006,19(1):20-24.
[8] 王春,吴秋华,王志,等.槲皮素与牛血清白蛋白相互作用的研究[J].光谱学与光谱分析,2006,26(9):1672-1675.
[9] Rawel H M,Meidtner K,Kaoll J.Binding of selected phenolic compounds to proteins[J].J Agric Food Chem,2005,53(10):4228-4235.
[10] 丁德智,黄祖云,陈震华,等.人血清白蛋白与槲皮素荧光光谱[J].中南民族学院院报(自然科学版),1996,15(3):61-64.
[11] 刘源.黄酮类化合物和姜黄素与核酸的相互作用及其分析应用的研究[D].济南:山东大学,2006.
[12] 周新,汪子明,邹明强,等.中草药中槲皮素的毛细管电泳法测定[J].高等学校化学学报,2005,26(4):657-659.
[13] 陈代武,谢青季,蒋雪琴,等.槲皮素与酪蛋白和牛血清白蛋白的相互作用及共存碳纳米管的影响[J].物理化学学报,2008,24(3):379-387.
[14] Jin F,Lu J Q,Zhou X W,et al.Spectroscopic study on interaction of lomefloxacin with human serum albumin in the presence of copper ion[J].Chin J Chem,2007,25(11):1675-1680.
[15] Lu J Q,Jin F,Sun T Q,et al.Multi-spectroscopic study on interaction of bovine serum albumin with lomefloxacin-copper(Ⅱ) complex[J].Int J Biolo Macromole,2007,40(4):299-304.
[16] 邓世星,杨季冬.荧光法研究酚藏花红与牛血清白蛋白的相互作用[J].分析测试学报,2007,26(3):360-364.
[17] 吴根华,汪婕,郭畅,等.荧光光谱法研究氟咯沙星-锌(Ⅱ)-牛血清白蛋白的三元配合物[J].光谱学与光谱分析,2007,27(4):765-768.
[18] 王玲,屈凌波,杨冉,等.槲皮素和芦丁与牛血清白蛋白相互作用研究[J].分析科学学报,2006,22(6):719-722.
