一株产脂肽类生物表面活性剂菌株的分离及代谢产物分析
2010-06-04罗剑波,吴卫霞,张凡等
生物表面活性剂是微生物代谢产生的一种具有表面活性的两性分子,分为糖脂、脂肽、脂蛋白、磷脂以及多聚糖脂等不同种类[1]。从油藏环境中筛选培养可以产生物表面活性剂的微生物(主要是假单胞菌和芽孢杆菌)[2],其代谢产生的生物表面活性剂主要为糖脂和脂肽两大类。
脂肽分子是由亲水的肽链(7~10个氨基酸组成的肽链)和亲油的脂肪酸链(β-羟基脂肪酸链或β-胺基脂肪酸链)两部分组成的, 其中脂肪酸链上的羟基或胺基与肽链氨基酸上的羧基结合形成内酯键或酰胺键,使肽链闭合形成环状脂肽[3]。由于其特殊的结构,脂肽表现出多种生理特性[4,5]:帮助微生物细胞粘附于烃类物质表面进行解烃代谢; 降低表面张力,促进微生物吸收和代谢疏水性物质, 以利于微生物在水不溶性物质中生存;与化学表面活性剂相比,更易于降解;在极端条件下仍能保持其活性[6~8]。因此,脂肽被广泛地应用到石油开采等工业领域中。
作者在此采用多次富集驯化、血平板筛选方法从新疆克拉玛依油田的油水样中分离出3株产生物表面活性剂的菌株。对其中的L1菌株进行研究,通过分子生物学鉴定该菌与土壤芽孢杆菌同源关系最近。为脂肽类生物表面活性剂的进一步研究奠定了基础。
1 实验
1.1 材料、试剂与仪器
油水样取自新疆克拉玛依油田,密封,备用。
TLC 展开剂为氯仿∶甲醇∶水=65∶15∶2(体积比),显色剂为0.2%茚三酮水溶液,HSGF 254 硅胶板。甲醇、氯仿、丙酮、二氯甲烷、乙酸、茚三酮等均为分析纯。
UV-2102C型紫外可见分光光度计,SIGMA Laborzentrifugan 3K15型离心机,K12/ M14型表面张力测定仪,NICOLET 750型显微红外光谱仪。
1.2 培养基
(1)产表面活性剂菌富集培养基:液体石蜡1 g·L-1,MgSO40.2 g·L-1,CaCl20.02 g·L-1,KH2PO41 g·L-1,K2HPO41 g·L-1,FeCl30.05 g·L-1,NH4NO31 g·L-1,酵母膏1 g·L-1,蒸馏水定容至1 L,pH值7.0~7.2。
(2)血琼脂培养基:购自北京绿源旺业科技有限公司。
(3)发酵培养基:葡萄糖25 g·L-1,KH2PO41 g·L-1,K2HPO41 g·L-1, CaCl20.04 g·L-1,NaCl 20 g·L-1, MgSO40.2 g·L-1,Na2HPO46 g·L-1,蛋白胨7.5 g·L-1,酵母膏 0.8 g·L-1,蒸馏水定容至1 L,pH值7.0~7.2。
(4)斜面培养基:牛肉膏5 g·L-1,蛋白胨10 g·L-1, NaCl 5 g·L-1,琼脂 10 g·L-1,蒸馏水定容至1 L,pH值7.0。
1.3 分离方法
1.3.1 菌种的富集与分离
油水样以2%(体积分数)的比例接种到产表面活性剂菌富集培养基中,25℃、165 r·min-1恒温培养3 d。吸取4 mL培养液接种到200 mL已灭菌的新鲜富集培养液中,如此连续转接10次。将富集培养液适当稀释后,取0.1 mL均匀涂布于血平板上,25℃培养24 h,根据溶血环进行初步筛选。挑产溶血环的单菌落于牛肉膏平板上划线分离4次,直至得到单菌落。显微镜观察细菌的形态一致。保存于牛肉膏斜面。
1.3.2 摇瓶培养
分离的菌株接种于发酵培养基中, 170 r·min-1、25℃培养 96 h。
1.3.3 生物表面活性剂的提取[9]
取一定量发酵液,用NaOH 溶液将pH 值调至7.5~9.0,10 000 r·min-1离心15 min; 取上清液,用盐酸调pH 值至2.0,离心收集沉淀,用等体积的CHCl3/CH3OH(体积比3∶1) 连续萃取3次;合并萃取相,浓缩,用pH值2.0 的盐酸水溶液洗涤5 次,减压蒸发除去有机相,用NaOH 溶液将沉淀物的pH 值调至7.0,真空干燥;加入正己烷洗涤3 次除去脂肪酸等,离心收集沉淀物并干燥,最后用CH2Cl2于50℃抽提10 h,除去CH2Cl2,即得生物表面活性剂。
1.4 分析与鉴定
1.4.1 生物表面活性剂的定性分析
采用薄层层析分析法。取提取的生物表面活性剂粗品溶于二氯甲烷中,将样品点在硅胶板上,展开,用茚三酮原位水解显色[10]检测。
1.4.2 乳化指数的测定[11]
发酵液以10 000 r·min-1离心30 min,取上清液 4 mL,加入 6 mL煤油充分振荡 2 min,静置 24 h。观察乳化层高度及稳定性,按下式计算 24 h乳化指数(E24)。
1.4.3 表面张力的测定
发酵液以8000 r·min-1离心20 min,取上清液测定其表面张力,对照样为没有加入菌种的新鲜培养基。
1.4.4 菌株鉴定
将分离纯化后的菌株接种于LB培养基中,25℃、150 r·min-1培养16~20 h,离心收集细胞后用基因组DNA提取试剂盒[Tiangen Biotech (Beijing) Co.,Ltd.]提取纯菌DNA。通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-ACGGCTACCTTACGACT-3′)用于基因组16S rDNA全长扩增,DNA凝胶回收试剂盒[Tiangen Biotech (Beijing) Co.,Ltd.]纯化16S rDNA全长扩增产物。pGEM-T Easy vector system(Promega)将16S rDNA全长扩增片段与载体连接,连接产物通过CaCl2法转化到Trans5αchemically competent cell感受态细胞(北京全式金生物技术有限公司),挑取10个白斑单克隆用于ARDAR分析。牙签挑取少量的菌体作为模板DNA,通用引物T7(5′-GGCCGCGGGAATTCGATT-3′)和Sp6( 5′-GCGAATTCACTAGTGATT-3′)用于阳性克隆验证。阳性克隆PCR产物分别用HinfI 和HhaI进行酶切,酶切产物经2%琼脂糖凝胶电泳分析。挑取2个分型相同的阳性克隆进行测序(SinoGenoMax Co., Ltd., Beijing),应用DNAMAN(Version 5.2.2.0)软件对原序列进行编辑,非嵌合体序列在GenBank (http://www.ncbi.nlm.nih.gov/BLAST/)数据库中进行比对分析,寻找亲缘关系最近的细菌或克隆。
2 结果与讨论
2.1 菌株的筛选
对油水样进行富集培养,稀释10 000倍后,取0.1 mL涂布于血平板上,利用产生物表面活性剂菌可以产生溶血圈的特性,划线分离得到3株菌,其中溶血圈最大的一株命名为L1。
2.2 16S rDNA序列分析结果
菌株L1 16S rDNA(约1500 bp)序列与GenBank中核酸数据库进行同源性比较结果为:该菌株与已培养的土壤芽孢杆菌(Brevibacillusagri)同源性最近,达到了99%。与该菌同源性超过98%的已知菌系统发育分析结果见图1。

图1 依据16S rDNA基因序列构建的菌株L1和相关属菌种的系统发育树
2.3 生物表面活性剂乳化性能
图2是生物表面活性剂对煤油的乳化指数随时间变化的关系。从图2可以看出,在72 h后,乳化指数仍达到64%,说明该生物表面活性剂对煤油乳化稳定性良好。
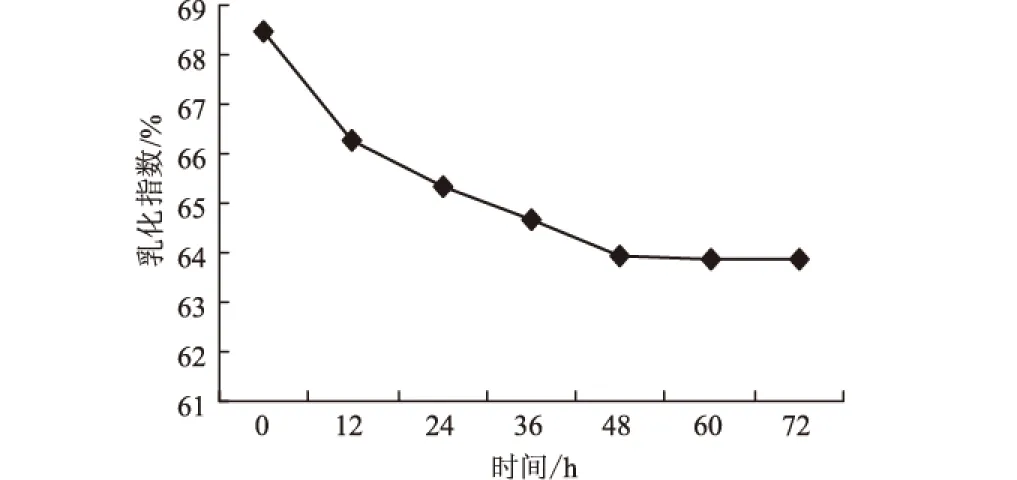
图2 生物表面活性剂的乳化性能
2.4 生物表面活性剂的定性分析
发酵液预处理后,用盐酸调pH值至2,4℃静置过夜,产生沉淀,说明发酵液中有脂肽存在[12]。TLC分析及显色反应发现,直接用茚三酮进行染色,不显色;将薄层板放入装有浓盐酸的密封瓶内于 150℃原位水解后,再用茚三酮染色,显红色斑点。表明表面活性剂本身不含游离氨基,酸解后可产生游离氨基[13],确定发酵液中含有脂肽类表面活性剂。
表面活性剂的红外光谱分析结果见图3。
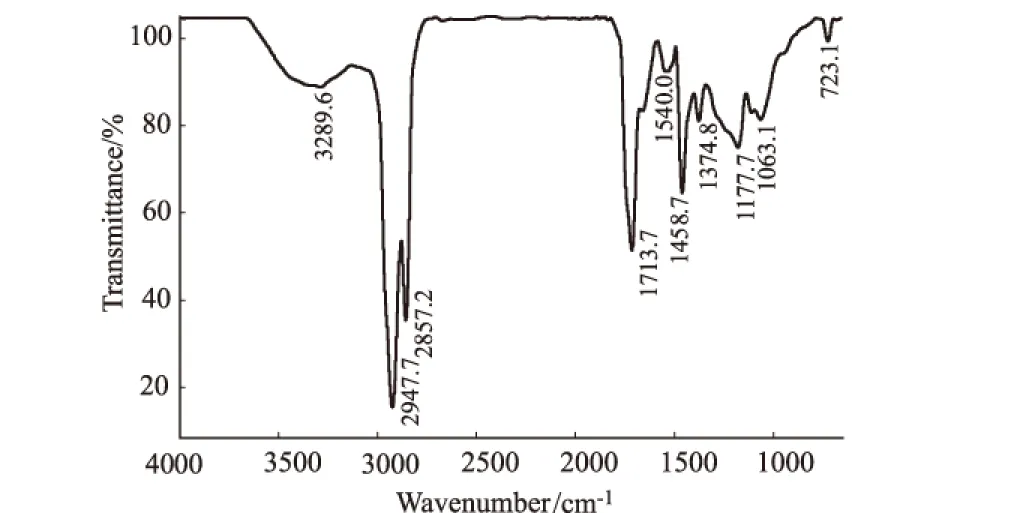
图3 样品的FTIR图
在 FTIR谱图上,3289.6 cm-1是由分子链间氢键引起的NH收缩振动谱带,1540.0 cm-1为酰胺谱带Ⅱ,这表明表面活性剂分子的亲水基是肽链。2947.7~2857.2 cm-1和1458.7~1374.8 cm-1的两处吸收峰是脂肪族碳链的 C—H伸缩振动峰,1713.7 cm-1和1177.7 cm-1是内酯的特征吸收峰,表明表面活性剂分子的疏水基是脂肪酸半分子。因此,可判定该表面活性剂分子是环脂肽类分子。
红外光谱测定的图谱与文献所载的红外光谱图有所不同[9],可能是样品不纯所致,也可能产生的是一种新型脂肽。
菌株在含有0.4%葡萄糖基本无机盐的培养基(pH值为7)中,45℃、170 r·min-1培养不同时间,取样测定细菌浓度和发酵液的表面张力,结果见图4。

图4 细菌浓度和表面张力的关系
由图4可看出,发酵前培养基的表面张力为69.56 mN·m-1,发酵后表面张力为29.36 mN·m-1。随着细菌浓度的增加,表面张力逐渐降低,说明表面活性剂的产量逐渐升高,但是产量的最大值出现在细菌浓度的最大值之后,这说明表面活性剂是细菌的次级代谢产物,细菌在生长迟滞期大量分泌表面活性剂[14]。
3 结论
从克拉玛依油田油水样中分离得到3株产生物表面活性剂的菌株,经分子生物学鉴定,其中一株与土壤芽孢杆菌同源关系最近,能够在基本无机盐培养基中以葡萄糖为碳源、蛋白胨为氮源的条件下生长,其代谢产物为脂肽类生物表面活性剂。
该菌株代谢产物具有降低表面张力的能力,可以将发酵液的表面张力从69.56 mN·m-1降低到29.36 mN·m-1,对煤油具有较高的乳化活性。该菌株在微生物采油上具有较大的应用潜力。
参考文献:
[1] Soumen Mukherjee , Palashpriya Das , Ramkrishna Sen . Rapid quantification of a microbial surfactant by a simple turbidometric method[J].Journal of Microbiological Methods,2009,76(1):38-42.
[2] 佘跃惠,夏晶晶,黄金凤,等.大庆油田聚驱后油藏驱油本源菌研究[J].油田化学,2009,26(1): 98-101.
[3] Kosaric N, Cairns W L. Biosurfactants and Biotechnology[M]. New York:Marcel Dekker Inc, 1987:21-45.
[4] Peypoux F, Bonmatin J M, Wallach J. Recent trends in the biochemistry of surfactin[J]. Appl Microbiol Biotech,1999, 51(5): 553-563.
[5] Tulin E E, Amaki Y, Nagasawa T, et al. ABacillusstearothermophilusesterase produced by a recombinantBacillusbrevisstabilized by sulfhydryl compounds[J]. Biosci Biotechnol Biochem,1993, 57(5): 856-857.
[6] Batista S B, Mounteer A H, Amorim F R,et al. Isolation and characterization of biosurfactant/bioemulsifier-producing bacteria from petroleum contaminated sites[J]. Bioresour Technol, 2006,97(6):868-875.
[7] Costa S G, Nitschke M, Haddad R, et al. Production ofPseudomonasaeruginosaLBI rhamnolipids following growth on Brazilian native oils[J]. Process Biochem, 2006,41(2):483-488.
[8] Thanomsub B, Pumeechockchai W, Limtrakul A, et al. Chemical structures and biological activities of rhamnolipids produced byPseudomonasaeruginosaB189 isolated from milk factory waste[J]. Bioresour Technol, 2006,97(18):1149-1153.
[9] 陈涛, 杨世忠, 牟伯中.微生物发酵液中脂肽类生物表面活性剂的测定[J].油田化学,2004,21(4):385-390.
[10] 吕应年,杨世忠,牟伯中.一种脂肽类生物表面活性剂产生菌的筛选[J].微生物杂志,2005,25(2):4-8.
[11] Cooper D G,Goldenberg B G. Surface-active agents from twoBacillussp.[J]. Appl Environ Microbiol,1987,53(2) :224-229.
[12] 杨乐,鲁建江,王开勇,等.石油降解菌的筛选及其产表面活性剂的研究[J].石河子大学学报(自然科学版),2009,27(2):221-225.
[13] 周俊,谭宁华.植物环肽的薄层化学识别新方法及其在植物化学研究中的应用[J].科学通报,2000,45(10) : 1047-1051.
[14] Ohno A,Ano T,Shoda M. Production of a lipopeptide antibiotic,surfactin,by recombinantBacillussubtilisin solid state fermentation[J].Biotechnology and Bioengineering,1995,47(2):209-214.
