紫花苜蓿高频组培再生体系影响因素研究
2010-06-04徐春波赵海霞李兴酉
徐春波,王 勇,赵海霞,李兴酉
(1.中国农业科学院草原研究所,内蒙古呼和浩特 010010;2.内蒙古农业大学生态环境学院,内蒙古呼和浩特 010018)
紫花苜蓿(Medicago sativa)为多年生豆科植物,是世界上重要的栽培牧草,在我国已有2000年的栽培历史,其营养价值被列在各种牧草的首位,有“牧草之王”的美誉[1]。
随着生物技术的发展,利用基因工程培育和改良植物品种成为便捷和实用的手段。转基因技术通过引入少量有用基因取代了传统育种中大量基因的介入,减少了无用基因对性状改良的不良影响,从而可以快速实现育种目标。因此,通过转基因手段将优良基因转移到栽培品种中,可以加速培育新品种。而转基因的前提就是要建立高效组培再生体系。苜蓿组织培养最早见于Saunders等[2]的报道,通过器官形成和体胚愈伤组织发育2条途径,最终分化成完整的植株,这标志着苜蓿组织培养研究的开始。尽管国内外对苜蓿离体再生体系的研究已经比较深入,但是,再生频率不稳定、受基因型影响大和再生周期长等问题目前仍有待于进一步研究解决。
1 材料和方法
1.1 供试材料
中苜1号(M.sativa cv.Zhongmu No.1),公农 1号(M.sativa cv.Gongnong No.1),猎人河(M.sativa cv.Hunter Rive)和 WL-323(M.sativa cv.WL-323)苜蓿种子由中国农业科学院草原研究所赵来喜、于林清和王照兰提供。
1.2 方法
1.2.1 无菌苗培养 选择饱满、种皮完整无破损的优良苜蓿种子,自来水冲洗种子30 min,70%的酒精消毒1 min,无菌水漂洗30 s,然后转入5%的次氯酸钠中消毒10 min,再用无菌水冲洗5次。用灭菌滤纸吸干种子表面的液体后接种到无激素的1/2 MS培养基上。
1.2.2 培养基 愈伤诱导培养基:
A.MS+1.0 mg/L 2,4-D
B.MS+1.5 mg/L 2,4-D
C.MS+2.0mg/L 2,4-D+0.25 mg/L KT+2 000 mg/L水解酪蛋白
D.改良SH+4.0 mg/L 2,4-D+0.5 mg/L 6-BA
继代培养基:
A1.MSO+0.5 mg/L NAA+1.0 mg/L 6-BA
B1.MSO+0.5 mg/L NAA+1.0 mg/L 6-BA+0.5 mg/L AgNO3
C1.MSO+0.5 mg/L NAA+1.0 mg/L 6-BA+1.0 mg/L AgNO3
D1.MSO+0.5 mg/L NAA+1.0 mg/L 6-BA+1.5 mg/L AgNO3
E1.MSO+0.5 mg/L NAA+1.0 mg/L 6-BA+2.0 mg/L AgNO3
分化培养基:
A11.MS
B11.MS+0.5 mg/L KT
C11.MS+1.0 mg/L KT
D11.MS+1.5 mg/L KT
E11.MS+2.0 mg/L KT
生根培养基:1/2MS。
以上培养基中均附加蔗糖20 g/L,琼脂7.5 g/L,pH5.8,121℃灭菌20 min。培养温度25℃,光照时间16 h/d,光照强度1 000-2 000 lx。
1.2.3 愈伤组织的诱导 叶片,叶柄和茎段取自2周龄的无菌苗,将茎段和三小叶的总叶柄剪成3~5 mm的小段,将叶片从中脉剪开;子叶和胚轴取自萌发6 d的无菌苗,将下胚轴剪成3 mm长的小段,将子叶从中脉剪开。将外植体分别接种到A,B,C,D 4种培养基上,20 d后统计胚性愈伤率。
1.2.4 愈伤组织的继代 将愈伤组织转接到含有不同浓度AgNO3的5种继代培养基A1,B1,C1,D1,E1上,20 d后统计胚性愈伤率。
1.2.5 愈伤组织的分化 将继代培养后的愈伤组织转接到含有不同浓度KT的MS培养基上培养,40 d后统计分化率。
1.2.6 评价指标 胚性愈伤率(%)=胚性愈伤组织数/接种的外植体总数×100%
分化率(%)=分化出苗的愈伤组织数/用于正常分化的愈伤数×100%
2 结果与分析
2.1 培养基对紫花苜蓿愈伤组织诱导及分化的影响
2.1.1 愈伤诱导培养基的选择 将4个紫花苜蓿品种的叶片分别接种于A,B,C,D愈伤组织诱导培养基上,培养20 d后统计胚性愈伤率(表1)。不同的愈伤诱导培养基对4个紫花苜蓿品种胚性愈伤组织的诱导差异较大,4个紫花苜蓿品种叶片都是在D培养基中的胚性愈伤率最高,其次,是C培养基。因此,选择D(改良SH+4.0 mg/L 2,4-D+0.5 mg/L 6-BA)培养基作为4个苜蓿品种的最佳愈伤诱导培养基。

表1 不同培养基对胚性愈伤率的影响Table 1 Effect of different medium on embryonic callus induction
2.1.2 继代培养基的选择 紫花苜蓿外植体在愈伤组织诱导培养基中形成的胚性愈伤组织较少,形成的愈伤组织大多为白色柔软的非胚性愈伤组织,这些愈伤组织在分化培养基中很难分化成苗(图1)。将诱导出来的愈伤组织转入不同的继代培养基上,20 d后统计胚性愈伤率(图2)。可以看出附加不同浓度AgNO3的培养基胚性愈伤率都有所提高,但并不是随着Ag-NO3浓度的增加胚性愈伤率在逐步上升。在添加1.0 mg/L AgNO3的C1继代培养基上胚性愈伤率最高达到75%,而且体胚的分化也十分明显,随着AgNO3浓度的增加胚性愈伤率反而降低,这可能是Ag+的毒害作用所导致。因此,最佳的继代培养基为C1(MSO+0.5 mg/L NAA+1.0 mg/L 6-BA+1.0 mg/L Ag-NO3)培养基。

图1 2种类型愈伤组织的比较Fig.1 Comparison of two types of callus
2.1.3 分化培养基的选择 将继代培养后的愈伤组织转接到含有不同浓度KT的MS分化培养基中,经40 d的培养,愈伤组织分化出苗,统计分化率。不同分化培养基的愈伤分化率有显著差异(图3,4),且随着KT浓度的增大分化率呈下降趋势,没有任何激素的MS培养基上,愈伤分化率达到最高为86.7%,而含有2.0 mg/L KT培养基上的分化率却只有4.3%,KT没有起到促进分化的作用,因此本实验的最佳分化培养基是不加任何激素的MS培养基。

图2 不同继代培养基对胚性愈伤率的影响Fig.2 The effecft of differnt subcul ture medium on embryonic callus rates

图3 不同分化培养基参愈伤组织分化的影响Fig.3 The effect of differentiation medium on callus differentiation

图4 愈伤组织在不同分化培养基上的分化状况Fig.4 Callus in different differential medium
2.2 基因型对愈伤组织分化的影响
将4个紫花苜蓿品种相同时期的下胚轴愈伤组织转接到相同分化培养基上培养,40 d后统计各品种愈伤组织的分化率(图5)。4个紫花苜蓿品种愈伤组织的分化率差异较大,4个品种愈伤组织分化率为51.7%~76.3%,其中WL-323的愈伤组织分化率最高达到76.3%,为最佳基因型。
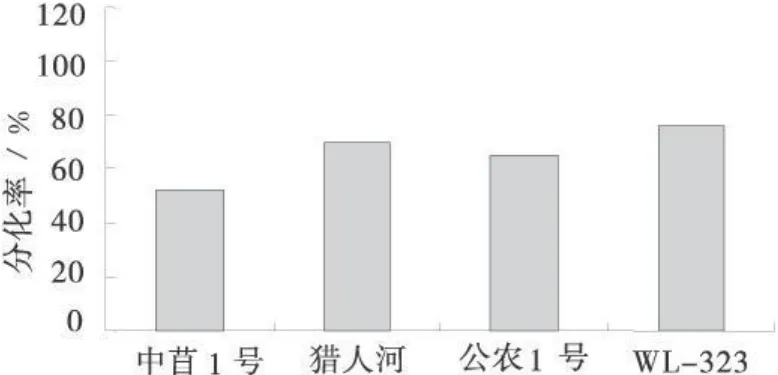
图5 基因型对愈伤组织分化的影响Fig.5 The effect of genotype on callus differentiation
2.3 外植体对愈伤组织分化的影响
将WL-323子叶、叶片、茎段、叶柄和下胚轴5种外植体的愈伤组织分别接种于同一种分化培养基中,40 d后分别统计5种外植体愈伤组织的分化率。5种外植体愈伤组织的分化率差异显著,愈伤组织分化率从高到低的顺序为:下胚轴>茎段>叶柄>子叶>叶片,下胚轴的愈伤组织分化率最高(图6),是进行苜蓿组织培养的最佳外植体。

图6 外植体对愈伤组织分化的影响Fig.6 The effect of explant on callus differentiation
3 讨论
3.1 基因型对愈伤组织分化的影响
基因型是影响植物体细胞胚胎发生的关键因素,同一物种的不同基因型间体细胞胚发生能力存在很大差异[3]。试验中植物细胞全能性表达在各植物之间甚至不同属种之间都有很大的差别,植物的再生性由基因型决定[4,5]。李聪曾对22个国内外不同基因型的紫花苜蓿做了再生试验,并在国内首次提出了不同基因型对体细胞胚的影响,试验表明,紫花苜蓿组织培养在分化苗的能力上,不同基因型品种之间存在着很大的差异[6]。通过研究4个不同品种对愈伤分化的影响,结果表明不同基因型的愈伤组织分化率有较大差别,这与前人的研究结果一致,可能是遗传背景造成的。
3.2 外植体对愈伤组织分化的影响
植株不同器官及部位的生理状态和功能存在着明显的差异,不同外植体的选择必将导致愈伤组织的产生及体细胞胚的形成与发育能力的差异。杨燮荣[7]认为,叶片的分化效果好于叶柄和茎段,其试验未对子叶和胚轴进行比较。试验使用苜蓿子叶、叶片、茎段、叶柄和下胚轴5种外植体进行了研究,结果下胚轴的愈伤分化率最高,说明其细胞胚性较强,生长刺激物及生理活性物质含量较高,有利于细胞的分裂和分化,是理想的试验供体材料。
3.3 AgNO3对胚性愈伤率的影响
植物组织培养是在封闭的容器中进行的,植物细胞会产生乙烯,积累的乙烯可抑制组培植物的生长分化或导致植株的畸形生长和发育[8,9]。Ag+是一种较好的乙烯活性抑制剂,可以竞争性的作用于乙烯作用部位从而促进器官发生和体细胞胚胎的发生。试验中的继代培养基上填加适量AgNO3明显的促进了愈伤质量的改善,胚性愈伤率明显升高,但Ag+对植物细胞有一定的毒害作用,不宜添加过多。
3.4 KT对愈伤组织分化的影响
自然情况下,一些植物细胞再生较困难是由于内源激素调整缓慢或不完全,外界条件不易控制等因素所致[10],因此,研究者常加一定的外源激素促进细胞再生。在诱导苜蓿愈伤组织和分化再生时,研究结果表明,2,4-D,ZT,KT,BA等植物激素的合理组合都能成功地诱导植株再生[11-18],但是,在本试验中加有KT反而不能够促进愈伤组织的分化。KT的作用机制尚不清楚,因此,这一方面还有待于进一步的研究。
[1]黄其满,俞梅敏.生物技术与苜蓿品质改良[J].高技术通讯,2002(3):101-103.
[2]Saunders J W,Bingham E T.Production of alfalfa plants from tissue culture[J].Crop Science,1972,12:804-808.
[3]Dudits D,Gyorgyey J,Bogre L,etal.Molecular biology of somatic embryogenesis[M].Thorpe TA(ed)In Vitro Embryogenesis in Plants,1995:267-308.
[4]郭光沁,夏光敏,李忠谊.小麦原生质体再生细胞直接形成体细胞胚和再生植株[J].中国科学(B辑),1990,9:970-974.
[5]王海波,李向辉,孙勇如,等.小麦原生质体培养-高频率的细胞团形成和植株再生[J].中国科学(B辑),1989,8:829-833.
[6]李聪,熊德邵,耿华珠.苜蓿愈伤组织再生植株的研究[J].中国草地,1989(6):51-56.
[7]杨燮荣,邰根福,周荣仁.苜蓿组织培养及植株的再生[J].植物生理学通报,1981(5):33-34.
[8]Roberts D R,Walker M A,Thompson T E,et al.The effects of inhibitors of polyamine and ethylene biosynthesis on senescence,ethylene production and polyamine levels in cut carnation flowers[J].Plant Cell Physicol,1984,25:315.
[9]Robinson K E P,Adams D O,Lee R Y.Differential physiological and morphological response of inbredlinestothylene precursor1-aminocyclopropane-1carboxylic acid by cultured sunflower shoot lips[J].Plant Cell Physicol,1987,6:405.
[10]崔凯荣,戴若兰.植物体细胞胚胎发生的分子生物学[M].北京:科学出版社,2000.
[11]金淑梅,管清杰,罗秋香,等.苜蓿愈伤组织高频再生遗传和转化体系的建立[J].分子植物育种,2006,4(4):571-578.
[12]刘振虎,卢欣石,葛军.紫花苜蓿愈伤组织及体细胞胚的细胞学观察[J].草业科学,2005,22(2):37-40.
[13]王姝杰,闫淑珍,李世访.紫花苜蓿下胚轴愈伤组织诱导及再生植株的研究[J].植物保护,2005,31(3):50-52.
[14]Barbulova A,Lantcheva A,Zhiponova M,etal.Agrobacterium-mediated transformation for engineering of herbicide-resistance in alfalfa(Medicago sativa L.)[J].Biotechnology and Biotechnological Equipment,2002,16(2):21-27.
[15]Ding Y L,Aldao-Humble G,Ludlow E,et al.Efficient plant regeneration and Agrobacterium-mediated transformationin Medicago and Trifolium species[J].Plant Science,2003,165:1419-1427.
[16]耿小丽,魏臻武,程鹏舞,等.苜蓿花药培养及倍性鉴定[J].草原与草坪,2008(5):1-5.
[17]柴燕文,马晖玲,谢小冬,等.应用正交设计优化紫花苜蓿愈伤组织诱导的激素配比[J].草原与草坪,2008(5):40-43,47.
[18]毛雅妮,张德罡,孙娟,等.KT对白花草木樨不同外植体愈伤组织培养的影响[J].草原与草坪,2009(5):33-34,37.
