农杆菌介导鱼腥草遗传转化的主要影响因素
2010-06-04董燕张莹来慧丽周联王培训
董燕,张莹,来慧丽,周联,王培训
(广州中医药大学免疫与分子生物学技术研究室,广东 广州 510405)
农杆菌介导的基因转化方法已在多种药用植物中实现了遗传转化,如百合、广藿香、人参、美国洋参等,而以鱼腥草为转基因受体进行遗传转化的研究尚未见研究报道。转基因受体材料的种类和生长状态、农杆菌感染能力、菌株质粒组合、添加创伤反应诱导物以及通过改变创伤方式、增强受体材料被感染能力等因素对转化频率影响较大,直接影响转化结果。本研究对药食两用、极具开发潜力的鱼腥草遗传转化的影响因素进行比较分析,筛选适宜转化条件,以提高转化效率,为获得稳定表达外源基因的转基因鱼腥草奠定基础。
鱼腥草为三白草科植物蕺菜(Houttuynia cordata Thunb.)的全草,是多年生草本植物,具清热解毒、消痈排脓、利尿通淋等功效,且其嫩叶、根茎可食用,是药食两用、极具开发潜力的资源之一[1]。由于鱼腥草临床应用广泛,加上新产品的不断开发,市场需求量不断增大,野生资源供不应求,人工栽培发展迅速,已成为经济价值较高的经济作物,但品种退化、抗病力下降、病虫害严重等问题随之产生[2,3]。将基因工程技术应用于鱼腥草种质资源优化或作为生物反应器生产药用蛋白具有良好的发展前景。
1 材料与方法
1.1 植物材料 鱼腥草(Houttuynia cordata Thunb.)无菌苗,培养于MS培养基上,25℃ ~28℃,光照14h·d-1,光照度 2000 lx。
1.2 质粒和菌株 质粒pBI121和质粒pCAMBIA1305.2均携带GUS(β-葡萄糖醛糖苷酶)报告基因和细菌选择标记卡那霉素抗性基因,质粒pBI121具有卡那霉素抗性植物选择标记,pCAMBIA1305.2具有潮霉素抗性植物选择标记;插入抗菌肽基因CN的重组质粒pBI121-CN和pCAMBIA1305.2-CN为本实验室构建;经转化根癌农杆菌(Agrobacterium tumefaciens)LBA4404菌株和EHA105菌株获得LBA4404/pBI121、LBA4404/pBI121-CN 和 EHA105/pCAMBIA1305.2、EHA105/pCAMBIA1305.2-CN。
1.3 主要试剂 植物激素-奈乙酸(NAA)、呋喃氨基嘌呤(KT)、6-苄基腺嘌呤(6-BA),头孢霉素(Cefotaxine)、利福平(Rifampicin)(广州威佳生物技术公司);卡那霉素(Kanamycin)和羧苄青霉素(Carbenicillin)(美国Sigma公司);氯霉素(Chloramphenicol,MEBCHEM公司);潮霉素(hygromycin,Hyg,德国 Roche公司);乙酰丁香酮(Acetosyringone,AS,美国 MEBCHEM);5-溴-4氯-3-吲哚-β-D葡萄糖苷酸酯(X-Gluc,美国Ameresco公司);植物基因组DNA提取试剂盒(DP305,天根生化科技(北京)有限公司);Southern blot试剂盒“DIG High Prime DNA Labeling and Detection Starter KitⅡ”(Roche公司);DNA Ladder 100(宝生物工程(大连)有限公司)。
1.4 培养基 植物组织培养的基本培养基为MS,用于无菌苗的培养;在 MS培养基中添加质量浓度0.1mg·L-1NAA、2.0mg·L-16-BA、0.5mg·L-1KT,称为MS-R培养基,用于外植体的离体再生;MS-R中添加不同浓度的乙酰丁香酮(AS)用于共培养,添加抗生素用于筛选培养。YEB培养基(含质量浓度50mg·L-1利福平和 100mg·L-1卡那霉素)用于培养农杆菌 LBA4404/pBI121;LB培养基(含氯霉素17mg·L-1和 100mg·L-1卡那霉素)用于培养农杆菌EHA105/pCAMBIA1305.2。
1.5 主要仪器 PCR扩增仪(美国 ABI公司,2720型),凝胶成像及分析系统(英国UVP公司)。
1.6 农杆菌的活化 挑取农杆菌单菌落,接种于3mL液体培养基中,28℃,200 r·min-1,振荡培养 16h 后,取1mL菌液,加入到30mL液体培养基(含100μmol·L-1乙酰丁香酮)中,振荡培养至A600约为0.6,将培养物以5000r·min-1离心5min,收集菌体用MS液体培养基重悬至不同菌液浓度用于转化。
1.7 外植体的转化
取无菌苗的叶片,切下直径为5mm的叶圆片为外植体,叶面朝上置于含植物激素的MS培养基上(NAA 0.1mg·L-1、6-BA 2.0mg·L-1、KT 0.5mg·L-1),避光预培养1~7d,分别浸没于菌液中侵染叶片10、15、20、25、30min,取出后置于无菌滤纸上吸去附着的菌液,置于培养基上,避光共培养2~7d,转入含抗生素的筛选培养基,进行光照培养。
1.8 GUS活性的组织化学鉴定
GUS组织化学染色法检测β-葡萄糖醛糖苷酶活性,参照《植物分子生物学实验指南》(Maliga et al.,2000)。
1.9 目的基因的鉴定
以植物DNA提取试剂盒提取抗性植株总DNA,以目的基因CN的上、下游引物进行PCR鉴定。引物序列如下:上游引物5'gcc aga tct cta gaa tga aat gga aag 3',下游引 物 5 'atg gtg acc gag ctc cta tta tct tcta 3 '。Southern blot采用Roche公司的“DIG High Prime DNA Labeling and Detection Starter KitⅡ”试剂盒,操作流程按使用说明书进行。
“吴耕要是知道我们过了六试,不知道会有多开心,既来之,则安之,我知道司徒一一的甲人有多可怕,但我偏不怕。”袁安微笑着说。
2 结果与分析
2.1 抗生素对鱼腥草离体再生的影响
为确定适当浓度的卡那霉素或潮霉素用于筛选转基因抗性植株,并确定用于抑制农杆菌的头孢霉素和羧苄青霉素对鱼腥草生长活性无明显影响的浓度范围,以鱼腥草叶片为外植体,接种于添加不同种类、浓度抗生素的MS-R培养基中,于4周统计分化出芽且芽生长状态良好的外植体数,计算出芽率(表1),结果表明,卡那霉素5mg·L-1时,10.7%的外植体有分化出芽,在10mg·L-1卡那霉素的作用下,无分化出芽,但8周时外植体活力尚好,因此筛选前期采用5mg·L-1浓度,8 周后采用 10mg·L-1浓度筛选 LBA4404/pBI121转化的抗性植株。潮霉素 2.5mg·L-1时,8.2%的外植体分化出芽,但8周时芽仍弱小,生长很缓慢;5mg·L-1浓度时培养至4周无分化芽,且已有50%叶片萎黄失活,因此采用2.5mg·L-1潮霉素筛选EHA105/pCAMBIA1305.2转化的抗性植株。
用于抑制和杀死农杆菌的头孢霉素对鱼腥草离体再生有较明显的影响,且在150mg·L-1~250mg·L-1浓度范围所产生的影响无明显差异,而羧苄青霉素在400mg·L-1时仍可获得较高的再生频率。
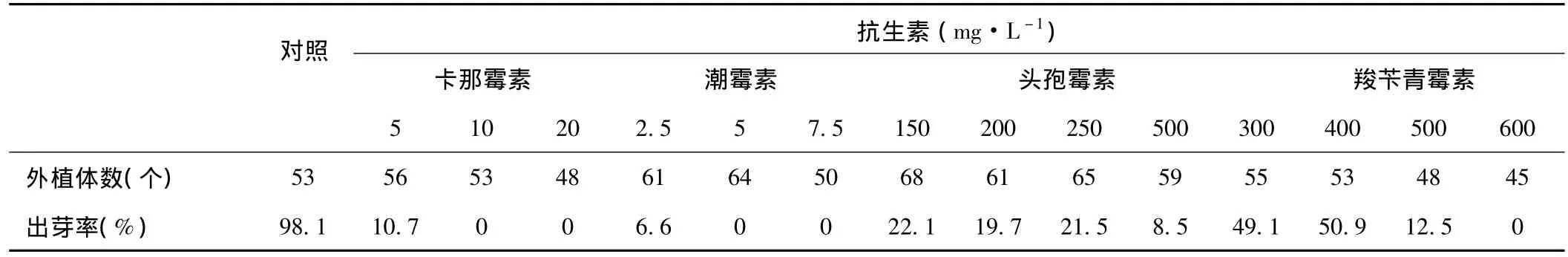
表1 不同抗生素浓度对外植体再生的影响
2.2 抑菌剂种类与浓度
通过抑菌圈实验比较头孢霉素和羧苄青霉素对农杆菌LBA4404和EHA105的抑菌作用(表2),发现头孢霉素的抑菌作用明显优于羧苄青霉素,在250mg·L-1浓度下抑菌作用明显,且该浓度下鱼腥草再生出芽率可达到20%以上,故选择250mg·L-1的头孢霉素抑制转化后的农杆菌。

表2 头孢霉素与羧苄青毒素对农杆菌的抑菌效果
2.3 菌液浓度与侵染时间对转化的影响
分别以A600为0.9、0.6、0.3的不同浓度农杆菌菌液浸泡侵染鱼腥草叶片 5、10、15、20min,其他条件为预培养2d、共培养2d、转至含抗生素的MS-R培养基中筛选培养,通过受侵染的鱼腥草愈伤组织的生长分化情况确定农杆菌侵染浓度和时间。当农杆菌EHA105/pCAMBIA1305.2菌液A600=0.9时,鱼腥草叶片在10d内全部枯萎,A600=0.6时,20d内全部枯萎,而当A600=0.3,侵染时间为15min时,受侵染叶片出现愈伤组织并分化出芽(表3),在农杆菌LBA4404/pBI121的转化实验中亦表现相同的趋势,因此确定该浓度和时间有利于外植体的转化。
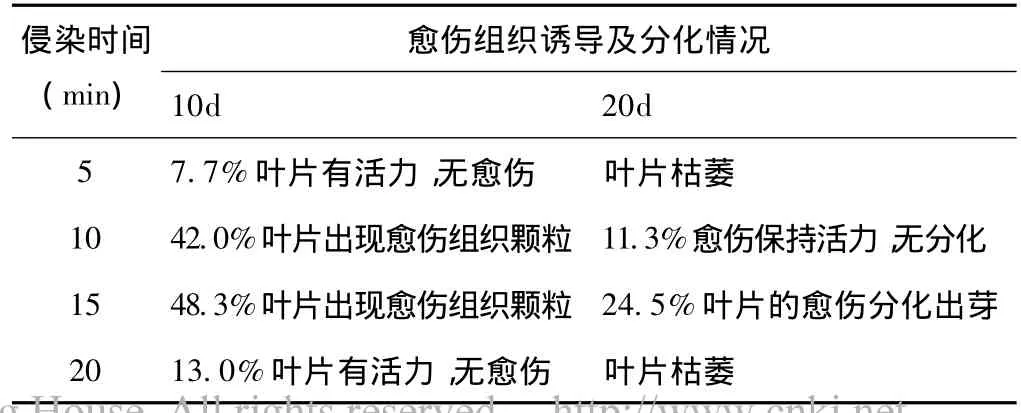
表3 侵染时间对愈伤组织诱导及分化的影响
2.4 预培养时间对转化的影响
将鱼腥草叶片在MS-R培养基中预培养不同天数,以 A600为0.3的活化菌液侵染15min,共培养2d后,对外植体进行GUS瞬时表达检测,发现农杆菌EHA105转化中,预培养4~5d的叶片GUS阳性率较高,继续延长预培养时间至6~7d时,GUS阳性率有所下降,故选用预培养4d进行转化;农杆菌LBA4404转化中,预培养6 d的叶片GUS阳性率较高,并且转化后再生出芽率也较高。
2.5 共培养时间对转化的影响
农杆菌EHA105转化中,不同共培养时间的GUS检测发现,共培养3~6d的叶片GUS阳性率均较高,且共培养3d的叶片在后续培养中活力较好,故选用共培养3d进行转化。在LBA4404转化中,共培养5~7d的叶片GUS阳性率较高,7d达到最高,因此共培养时间确定为7d。
2.6 AS对转化效率的影响
在共培养的培养基中分别加入 0、100、150、200μmol·L-1的乙酰丁香酮(AS),对转化体进行 GUS检测发现,未添加AS的EHA105/pCAMBIA1305.2和LBA4404/pBI121转化的GUS阳性率分别为25.0%和15.4%,添加 AS的转化体阳性率明显升高,在200μmol·L-1时最高,EHA105 达 78.6%,LBA4404达63.6%,且外植体上蓝斑数量与面积最大。故选择添加 AS 200μmol·L-1用于鱼腥草的转化。
2.7 温度、菌体重悬及洗涤外植体的影响
为比较温度对转化的影响,分别在17℃、20℃、23℃、26℃、29℃不同温度下进行农杆菌浸泡侵染外植体,通过GUS检测外植体阳性率的比较,发现EHA105转化鱼腥草在23℃、26℃时转化阳性率较高;LBA4404的转化中,20℃ ~26℃转化的GUS阳性率差别不明显,但都高于17℃,在筛选培养中发现26℃转化的鱼腥草外植体活力较好,故选择在26℃进行转化。并且在农杆菌侵染叶片的操作中,将活化的农杆菌离心,用MS液体培养基重悬,再进行侵染,转化外植体的GUS阳性率均高于未重悬的菌液。
为减少农杆菌对外植体活力的影响,在转到筛选培养基前,将叶片进行洗涤,并比较不同洗涤方式对外植体活力及分化的影响,确定将外植体置于MS液体(含头孢霉素250mg·L-1)中,40r·min-1振荡10min,洗涤2次;再用无抗生素的MS液洗10min,以去除抗生素,然后置于筛选培养基表面。经洗涤的鱼腥草叶片在后续的筛选培养中的活力明显优于未洗涤过的叶片,抗性芽发生率明显提高。
2.8 菌株/质粒组合对转化的影响
经过对菌液密度、侵染时间、预培养和共培养时间、添加乙酰丁香酮(AS)等转化条件的筛选,确定了EHA105/pCAMBIA1305.2和LBA4404/pBI121转化鱼腥草的适宜条件(见表4)。对GUS瞬时表达的分析发现,经EHA105侵染的外植体中GUS阳性率高于LBA4404,说明 EHA105/pCAMBIA1305.2菌株/质粒组合对鱼腥草的侵染能力较强。
但在随后的抗性筛选中,EHA105转化的外植体抗性愈伤发芽率低于LBA4404,其原因可能在于一方面头孢霉素对EHA105的抑菌效果不如LBA4404;另一方面GUS的瞬时表达可说明外源基因已转入鱼腥草细胞,但并不能确定是否整合进细胞染色体中,没有整合到染色体上的外源DNA在细胞生长过程中丢失,造成抗性丢失;此外,整合到染色体上的外源基因受到整合位点、拷贝数等因素的影响可能出现基因沉默现象,导致抗性基因表达水平低或不表达,影响抗性芽的获得。而鱼腥草细胞对潮霉素、卡那霉素耐受性的差异等因素也会影响发芽率。因而综合考虑上述因素,根据抗性芽百分率,结果显示LBA4404/pBI121菌株/质粒组合转化鱼腥草优于EHA105/pCAMBIA1305.2。
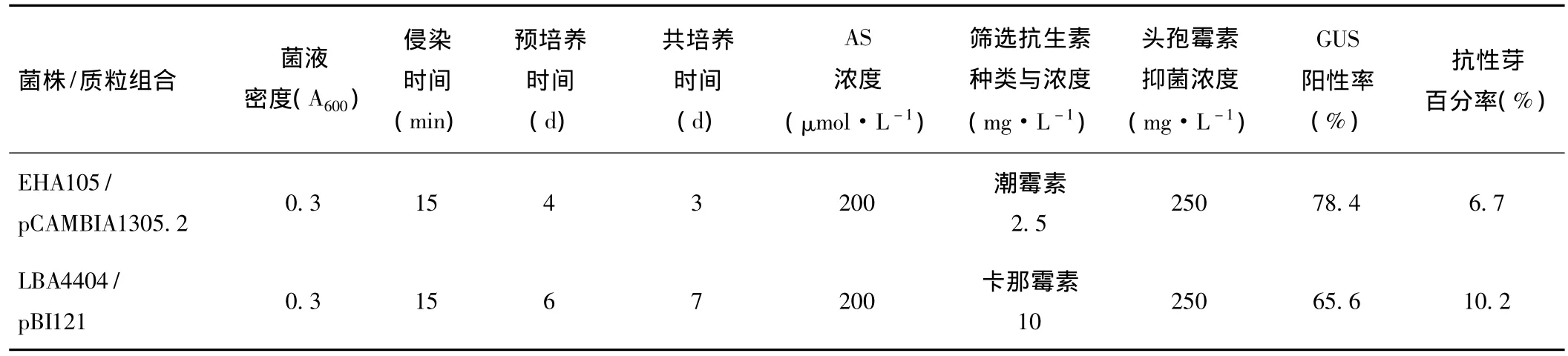
表4 农杆菌介导的鱼腥草遗传转化条件与植株再生
2.9 抗性植株的再生与鉴定 见图1、2
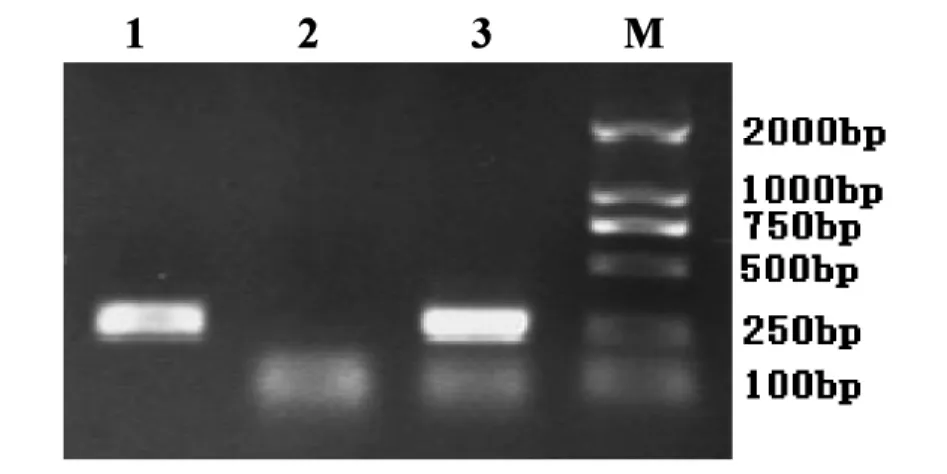
图1 基因组DNA中目的基因的鉴定

图2 PCR产物的Southern blot结果
经过对转化条件的优化,受侵染叶片能较好产生愈伤组织并分化。转入筛选培养基后约2周愈伤颗粒开始长出,6周开始分化出芽,8周统计抗性芽百分率(见表4),并转至MS基本培养基(含抗生素)进行生根培养。随后的观察发现大部分芽能保持绿色,但不能进一步生根和伸长生长,只有少数分化出的芽苗能保持生长。以稳定生长的转化植株总DNA进行目的基因的PCR,获得与预期大小一致的PCR产物(图1),对PCR产物进行Southern杂交分析,在相应位置出现杂交带(图2)。结果表明,目的基因已整合到鱼腥草基因组中。
3 讨论
根据具体植物材料和农杆菌菌株摸索转化条件、提高转化频率和转化植株再生率是获得转基因植株的关键,因而需要对转化的各个环节进行条件优化。
植物受伤细胞分泌的一些酚类化合物可诱导农杆菌的Vir区基因活化,进而介导T-DNA的转移。目前广泛使用的是乙酰丁香酮(AS),但在某些植株的转化上,如草莓等,乙酰丁香酮的使用无效甚至有害,在农杆菌介导的抗菌肽A基因转入沙田柚中发现酚类化合物对转化的影响差别较大[5]。鱼腥草的转化中添加AS有明显的促进作用,在200μmol·L-1时GUS阳性率最高,且外植体上蓝斑数量与面积最大。
外植体的预培养时间是其生理状态的重要影响因素,也是影响转化的关键。农杆菌介导的遗传转化的预培养时间多为2~3d,如佛手的遗传转化[6],而不经预培养或预培养1周以上的也有报道。本实验在EHA105转化中预培养4d,LBA4404转化中预培养7d的条件下GUS阳性率和再生出芽率均较高。
农杆菌的属性对转化的成功有决定性的影响,不同的农杆菌对受体组织的敏感性不同,在植物与农杆菌之间存在着适应性,因而不同的作物种类在基因转化过程中存在着最合适或最为敏感的农杆菌菌株[7]。超毒力菌株EHA105属于农杆碱型,侵染能力较强,农杆菌LBA4404属于章鱼碱型。在水稻的研究中,发现EHA105对受体组织的敏感性高于普通型宿主LBA4404[8]。而在小麦幼胚愈伤组织的遗传转化中,LBA4404/pBTAaB转化的抗性愈伤频率最高,其次是EHA105/p3301,AGL-1/p3301 的转化频率最低[9]。在大麦的遗传转化中,LBA4404/pYF133转化效率高于LBA4404/pUGB7,也说明菌株质粒组合影响转化效率[10]。
鱼腥草的转化中,虽然经超毒菌株EHA105侵染的外植体中 GUS表达阳性率高于 LBA4404,说明EHA105侵染能力较强,但外植体抗性愈伤发芽率及转基因植株获得率均低于LBA4404。原因可能在于EHA105/pCAMBIA1305.2与 LBA4404/pBI121菌株/质粒组合的基因型不同,存在对受体材料造成的损伤程度不同、抗性筛选中抗生素的种类不同、外源基因的整合情况等因素的差异,从而影响转化结果。研究表明,LBA4404/pBI121菌株/质粒组合转化鱼腥草优于EHA105/pCAMBIA1305.2。
本研究通过对鱼腥草遗传转化过程中几个主要影响因素的比较,确定在菌液浓度A600为0.3、26℃时浸泡15min条件下,对预培养的外植体进行侵染,经适当的共培养,并添加 AS 200μmol·L-1,有利于转化,经适当的洗涤去除农杆菌后转入筛选培养,获得了转基因植株,为培育鱼腥草基因工程新品种、开展种质资源的优化研究奠定了基础。
致谢:本研究得到了贺红、曹柳英、梁瑞燕、林小桦、张桂芳等的协助!
[1]何正飚.鱼腥草—药膳两用新作物[J].植物杂志,2001(1):21.
[2]张世宇,熊仁,陈云和,等.鱼腥草主要病虫害及无公害防治技术[J].云南农业科技,2006(2):51.
[3]吴远惠,赵宏班,纪华,等.三种鱼腥草病害的鉴定与防治建议[J].长江蔬菜,2007(2):18-19.
[4]王翠亭,卫志明.根癌农杆菌介导小麦幼胚遗传转化的影响因素[J].植物生理与分子生物学学报,2003,29(6):521-529.
[5]韩美丽,陆荣生,吴耀军,等.农杆菌介导的抗菌肽A基因转入沙田柚影响因素研究[J].广西植物,2006,26(5):479-482.
[6]周春丽,郭卫东,路梅,等.农杆菌介导佛手遗传转化主要影响因素的研究[J].热带亚热带植物学报,2006,14(5):374-381.
[7]张录霞,牛建新,马兵钢.根癌农杆菌介导转化番茄的影响因素[J].生物技术通报,2008(1):11-13.
[8]UzéM,Pot rykus I,Sautter C.Factors influencing T-DNA transfer from Agrobacterium to precultured immature wheat embryos(Triticum aestivum L.)[J].Cereal Res Com,2000,28(1~2):17-23.
[9]王永勤,肖兴国,张爱民.农杆菌介导的小麦遗传转化几个影响因素的研究[J].遗传学报,2002,29(3):260-265.
[10]Shrawat AK,Becker D,Lorz H.Agrobacterium tumefaciens-mediated genetic transformation of barley(Hordeum vulgare L.)[J].Plant Science,2007(172):281-290.
