磁共振扩散加权成像在前列腺癌检出和鉴别诊断中的价值
2010-06-02梁宇霆靳二虎邓立刚付静媛
梁宇霆,靳二虎,张 艺,邓立刚,付静媛
前列腺癌的发病率近年来在我国呈上升趋势。前列腺癌的临床诊断目前依靠前列腺特异性抗原(prostate specific antigen,PSA)筛查、经直肠前列腺触诊及前列腺穿刺活检[1]。影像检查中,超声(US)主要用于测量前列腺体积、测定膀胱残尿量及引导前列腺穿刺活检;普通CT和增强CT扫描,由于软组织密度分辨力差,在前列腺癌的诊断中作用有限;常规MRI主要用于对前列腺癌进行分期诊断,但不易发现前列腺移行带、中央带及尖部的癌灶。临床实践发现,功能磁共振成像技术,如扩散加权成像(diffusion weighted imaging,DWI)在肿瘤的检出和诊断中具有很大的潜能[1-3]。因此,本文探讨DWI在前列腺癌诊断和鉴别诊断中的价值。

图1 ADC值测量过程示意图。患者68岁,前列腺癌,T-PSA 11.50 ng/ml,肿瘤位于前列腺中部左侧外周带,Gleason评分3+4=7分。A. T2WI显示左侧外周带低信号结节(箭);B. 同层面DWI显示左侧外周带结节状高信号;C. 对照T2WI、DWI表现及病理结果,确认肿瘤区域,设ROI后测ADC值;D. 经工作站后处理,获得ADC图和兴趣区的ADC值
1 资料和方法
1.1 一般资料
收集我院2008年6月至2009年12月期间因排尿困难、PSA升高而进行前列腺MRI扫描的患者87例,所有患者MRI扫描后1个月内均经前列腺穿刺证实为前列腺癌或前列腺增生。其中41例为前列腺癌,46例为前列腺增生。前列腺癌中13例行根治性切除、28例行内分泌及放射等治疗;46例前列腺增生中,10例行经尿道前列腺电切,36例保守治疗。患者年龄58~87岁,中位年龄71岁,两组病例之间的年龄无显著性差异。
1.2 检查方法
MRI扫描采用GE 3.0 T超导成像系统。线圈为8US TORSOPA,对所有患者进行常规横断面和冠状面T2WI、横断面动态增强T1WI和DWI扫描。T2WI采用FSE序列,TE/TR 115/3500 ms,FOV 36 cm,层厚 4 mm,层间距 0.5 mm,矩阵288×256,NEX 4。DWI采用单次回波平面成像技术,扩散敏感系数(b)采用0和1000 s/mm2,TE/TR 59.5/3500 ms,FOV 36 cm,层厚与层间距同T2WI,矩阵128×128,NEX 8,总扫描时间1 min 52 s。动态增强采用LAVA序列进行三期扫描,分别在静脉内注射对比剂Gd-DTPA后于30 s行动脉期、75 s静脉期和4 min延迟期扫描,流率2.5 ml/s,剂量 0.1 mmol/kg体重,TE/TR 1.5/215 ms,层厚3 mm,矩阵512×129,NEX 1。
1.3 图像分析及后处理
由两位在体部MRI诊断领域有丰富经验的高年资医师对所有MRI影像进行分析。在前列腺癌组,对照病理结果分析T2WI和DWI表现。将DWI图像数据传入工作站,经后处理获得ADC图。根据病理及影像所示肿瘤位置,在DWI上设兴趣区(ROI)后测量ADC值(图1),同时在同层面无肿瘤浸润区域,设ROI测正常组织的ADC值。在前列腺增生组,分别在中央区(增生组织)和外周带设ROI并测量ADC值。
1.4 统计学处理
应用SPSS 13.0软件包对观察数据进行统计学处理,计量资料用均值±标准差表示。对所有数据进行方差分析,以P<0.05作为差异有统计学意义。
2 结果
本组41例前列腺癌患者中,肿瘤位于外周带及尖部28例(图2),位于中央区5例(图3),外周带和中央区均累及者8例。影像上测量的病灶直径为0.8~4.7 cm。可进行ADC值测量的最小肿瘤直径为0.8 cm,该组前列腺恶性组织和正常组织的平均ADC值分别为(0.97±0.25)×10-3mm2/s和(1.34±0.16)×10-3mm2/s。在前列腺增生组,中央区和外周带的平均ADC值分别为(1.37±0.24)×10-3mm2/s 和(1.43±0.31)×10-3mm2/s。方差分析显示,肿瘤组织的平均ADC值明显低于同组的正常组织(P<0.001);比较肿瘤组织与前列腺增生组的良性前列腺组织的平均ADC值,两者具有显著性差异(P<0.001);而前列腺增生组的中央区与外周带之间以及肿瘤组的正常组织与增生组之间的平均ADC值无显著性差异。
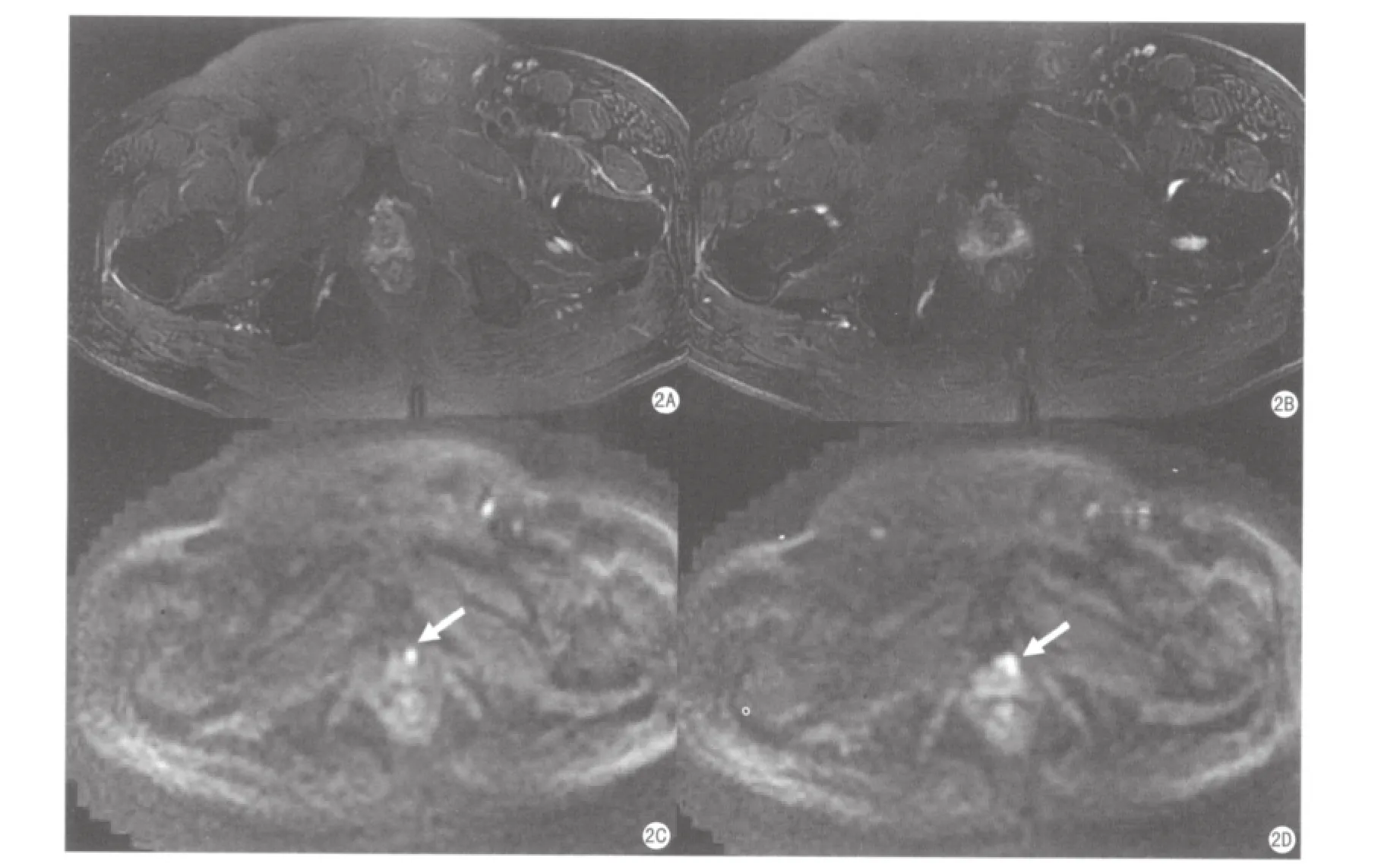
图2 尖部前列腺癌MRI表现。患者70岁,T-PSA 5.44 ng/ml。A、B为经前列腺尖部横断面FS-T2WI,病灶信号不明显;C、D为同层面DWI,前列腺尖部可见结节状高信号(箭)。根治性切除手术证实肿瘤位于前列腺尖部
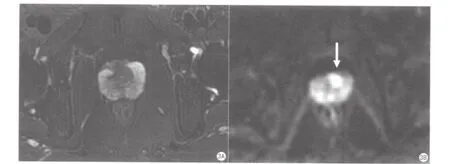
图3 中央区前列腺癌MRI表现。患者63岁,T-PSA 7.0 ng/ml。A. 轴面FS-T2WI显示病灶不明显;B.同层面DWI显示前列腺中央区结节状高信号(箭)
3 讨论
3.1 DWI在前列腺癌诊断中的应用基础
DWI是一种磁共振功能成像方法,反映的是水分子的扩散运动。水分子在体外保持随机布朗运动,运动不受限制,即自由扩散。而在生物组织内,它的运动受到细胞膜和大分子物质的影响及限制。生物组织内水分子的扩散包括水分子在细胞内、细胞外及血管内的扩散运动,其受限制的程度与组织内的细胞量和细胞膜的完整性成正比,即生物组织内细胞越密集、细胞膜越完整,水的扩散运动越受限制。细胞膜对水在细胞内、外的扩散起着屏障作用。相反,生物组织内细胞密度越低、细胞膜越不完整,水的扩散运动越不受限[2]。
采集DWI信号目前多在T2加权自旋回波序列上叠加两个对扩散敏感的梯度回波。两次梯度回波作用后,静止水分子的相位将完全重聚,产生的信号不受影响。而对处于扩散运动中的水分子,在第2次梯度回波后,水分子的相位将不能完全重聚,信号发生衰减[2,4]。鉴于此,水分子的扩散运动状态可以在DWI上通过测定信号衰减得以体现。扩散受限制的程度越高,越接近静止的水分子状态,由扩散引起的信号衰减越少,在DWI上信号越高。在MRI工作站上将DWI图像进行后处理后,得到ADC图。在ADC图上设定兴趣区,可以得到局部组织的表观扩散系数(ADC),并定量分析水分子的扩散运动。
病理检查发现前列腺癌区域的肿瘤细胞较正常细胞体积小、排列密集。这是DWI检出前列腺癌并与良性前列腺增生鉴别诊断的前提。本组对前列腺癌及增生进行常规T2WI和DWI研究的结果表明,前列腺癌组织在DWI上信号高于周围正常组织,ADC值测量则提示前列腺癌组织的ADC值明显低于周围的正常前列腺组织和良性前列腺增生组织,从定量的角度证明肿瘤组织与正常组织中水分子扩散状态不同。本组测到肿瘤组织ADC值的最小肿瘤直径是0.8 cm,说明小至0.8 cm的肿瘤灶就有可能在DWI显示,这对早期前列腺癌的诊断具有临床意义。
3.2 DWI对前列腺癌的诊断价值
常规T2WI对发生于外周带的前列腺癌有较大的诊断价值,但不易发现中央区的癌灶。这是因为外周带水分较多,在T2WI表现为高信号。当前列腺癌变时,肿瘤细胞密集排列,液体减少,信号减低,在T2WI易于显示。而中央区在T2WI表现为中等或稍低信号,与前列腺癌的信号不易区分。然而,一些外周带的前列腺癌,由于发病年龄偏大,或合并前列腺增生,使外周带腺体受压萎缩,加之老年人腺体分泌功能下降,生理情况下外周带的MR信号就有所降低[5]。此外,慢性前列腺炎或瘢痕组织也可引起外周带信号减低。这些因素使T2WI诊断和鉴别诊断外周带前列腺癌的作用受到限度。临床上,前列腺癌的诊断现状是:在PSA筛查基础上,对可疑病例进行超声引导下的前列腺穿刺活检。穿刺活检虽然可取得细胞学或组织学样本并确诊疾病,但它是一种有创的检查。其次,前列腺穿刺常见的操作方法是在前列腺上、中、下部位,依左、中、右顺序各取1~2针,漏检难以避免[1,6]。
与T2WI不同,DWI反映水分子的扩散运动。前列腺癌由于肿瘤细胞分裂快,细胞量增多,肿瘤细胞密集排列,这在T2WI和DWI引起不同的信号变化。在T2WI由于肿瘤细胞替代正常腺体组织,腺体分泌减少,信号减低;在DWI水分子在肿瘤细胞中扩散受限,由水分子扩散运动引起的信号衰减减少,故信号相对增高。可见,T2WI和DWI从不同侧面反应了同样的病理改变。
本组41例前列腺癌中,37例在DWI显示高信号,其中9例(5例局限于中央区、4例发生于前列腺尖部)在常规T2WI较难发现异常信号。这9例中有2例MRI报告可疑前列腺尖部癌灶,但因组织学穿刺活检时未进行针对性穿刺,仍在常规位置穿刺,结果未发现肿瘤细胞,也未对患者进行特别处理。2例患者分别于12和15个月后复查MRI,可疑部位肿瘤组织增大,其中1例患者出现骨转移。
发生于前列腺尖部及中央区等部位的前列腺癌,无论在常规T2WI,还是组织学活检,都是诊断的难点。前列腺尖部和中央区由于位置相对深,触诊不易触及;组织学活检由于是盲穿,如果肿瘤体积不大,遗漏不在少数。本研究表明,DWI可提高前列腺癌的检出率,特别是早期癌灶和外周带以外的前列腺癌。对于外周带前列腺癌,DWI与常规T2WI可以相互印证,提高诊断准确性。因此,DWI是常规T2WI的重要补充。
文献中关于DWI在前列腺癌诊断中的价值,意见比较统一,即DWI增加前列腺癌的检出率[6-11]。但对于外周带以外的前列腺癌,DWI的检出作用意见不一。有人认为,DWI结合T2WI未提高中央区前列腺癌的检出率[10]。也有人认为,DWI可提高前列腺癌(包括中央区癌灶)的检出率[11]。本组结果支持后一种观点。
目前,前列腺癌的确诊和进一步诊治是建立在组织学活检结果的基础上。前列腺穿刺活检多由泌尿外科医生进行。有必要加强影像诊断科与泌尿科医生的沟通,在常规穿刺时,有针对性地对MRI显示的可疑部位穿刺取材,有望提高前列腺癌的活检阳性率,从而使患者得到更早更及时的治疗,提高患者的生存质量。
[1]Shimizu T, Nishie A, Ro T, et al. Prostate cancer detection:the value of performing an MRI before a biopsy. Acta Radiol, 2009, 50(9): 1080-1088.
[2]Koh DM, Collins DJ. Diffusion-weighted MRI in the body: applications and challenges in the oncology. AJR,2007, 188(6): 1622-1635.
[3]Koh DM, Scurr E, Collins DJ, et al. Predicting Response of colorectal hepatic metastasis: value of pretreatment apparent diffusion coeff i cients. AJR, 2007, 188(4): 1001-1008.
[4]Stejskal EO, Tanner JE. Spin diffusion measurements:spin-echo in the presences of a time dependant field gradient. J Chem Phys, 1965, 42(1):288-292.
[5]梁宇霆,靳二虎,马大庆,等. 前列腺癌及增生的影像诊断:MRI影像与病理对照研究. 中华放射学杂志, 2000,34(6): 397-401.Liang YT, Jin EH, Ma DQ, et al. Prostatic carcinoma and benign prostatic hyperplaisa: MR imaging with histopathologic correlation. Chin J Radiol, 2000, 34(6):397-401.
[6]Woodfield CA, Tung GA, Grand DJ, et al. Diffusionweighted MRI of peripheral zone prostate cancer:comparison of tumor apparent diffusion coefficient with Gleason score and percentage of tumor on core biopsy.AJR, 2010, 194(4): 316-322.
[7]Kim CK, Park BK, Kim B. Diffusion-weighted MRI at 3 T for the evaluation of prostate cancer. AJR, 2010,194(6):1461-1469.
[8]Hosseinzadeh K, Schwarz SD. Endorectal diffusionweighted imaging in prostate cancer to differentiate malignant and benign peripheral zone tissue. J Magn Reson Imaging, 2004, 20(4): 654-661.
[9]Pickles MD, Gibbs P, Sreenivas M, et al. Diffusionweighted imaging of normal and malignant prostate tissue at 3.0 T. J Magn Reson.Imaging, 2006, 23(2): 130-134.
[10]Haider MA, van der Kwast TH, Tanguay J, et al.Combined T2-weighted and diffusion-weighted MRI for the localization of prostate cancer. AJR, 2007, 189(2):323-328.
[11]Kim CK, Park BK, Han JJ, et al. Diffusion-weighted imaging of the prostate at 3T for differentiation of malignant and benign tissue in transition and peripheral zones: preliminary results. J Comput Assist Tomogr,2007, 31(3): 449-454.
