铁蛋白与SPIO在磁共振细胞活体示踪中的增效作用
2010-06-02王建东胡秋菊朱飞鹏常双会周晓军卢光明
王建东,胡秋菊,朱飞鹏,常双会,张 帆,周晓军,卢光明*
干细胞、祖细胞等多种细胞治疗在临床的应用越来越广泛[1-6]。无创性活体示踪接种的治疗细胞,对接种细胞的存活、分化以及在损伤的组织器官定位进行长期监控,成为治疗成功的关键之一。磁共振成像技术(MRI)具有高度时间和空间分辨力,同时可以提供机体解剖和功能方面的信息,目前已经成为活体示踪细胞的重要手段。超顺磁性纳米铁颗粒(superparamagnetic iron oxide, SPIO)标记是磁共振活体示踪细胞的主要方法,被广泛应用于基础科研和临床前研究[7-12]。但SPIO标记的细胞随着细胞分裂和铁颗粒的代谢降解,磁共振信号逐渐减弱,直至消失,无法长期示踪治疗细胞。铁蛋白广泛存在于生物细胞内,参与机体铁代谢,具有储存铁的功能。近年来,有关铁蛋白基因作为磁共振报告基因的研究备受关注[13-16]。其原理是:人工将铁蛋白基因导入细胞使细胞高表达铁蛋白,高表达的铁蛋白将机体细胞外内源性铁捕获,在细胞内形成具有超顺磁性的结晶铁,在磁共振下产生对比。但是,铁蛋白产生的磁共振信号非常弱,很难应用于临床。本研究探讨铁蛋白与SPIO在细胞内的相互作用,以及在磁共振细胞活体示踪中的应用。
1 材料与方法
1.1 细胞培养
鼠胶质瘤C6细胞常规培养于F12 Kaighn's培养基中(Gibico, Invitrogen,美国),培养基添加1 mM L-谷氨酰胺,15%马血清(Hyclone, Thermo Scientific,美国),2.5%胎牛血清(Gibico), 100 U/ml青霉素和100 mg/ml链霉素。细胞培养条件为37℃,95%空气,5% CO2。
1.2 构建鼠铁蛋白重链全基因质粒
应用Trizol试剂(Invitrogen,美国)从小鼠肌肉组织提取总RNA。在Oligo(dT)引物作用下,利用逆转录试剂(Promega,美国)将mRNA逆转成cDNA。根据鼠铁蛋白重链基因序列(GenBank,序列号NM-010239)设计含有NotI 和BamHI限制性内切酶位点的聚合酶链式反应(PCR)引物,PCR扩增出鼠铁蛋白重链全基因片段(Fth)。应用NotI和BamHI(大连宝生物公司)对全基因片段和pcDNA3.1(Invitrogen)载体DNA进行消化,通过QIAquck PCR纯化试剂盒(QIAGEN,德国)对消化产物进行纯化。经T4连接酶(大连宝生物公司)将铁蛋白全基因插入载体形成铁蛋白重链全基因质粒(Fth-pcDNA3.1)。
1.3 Fth-pcDNA3.1转染C6细胞
转染前一天,将105C6细胞接种于500 μl不含抗生素的F12 Kaighn's培养基中,培养于24孔塑料培养板使细胞达到90%融合度。铁蛋白重链质粒FthpcDNA3.1与Lipofectamine 2000(Invitrogen)混合后,在室温孵育20 min加入细胞培养孔,轻轻混匀培养过夜。转染24 h后消化细胞进行1:10传代,加入G418(Gibico)进行筛选,G418终浓度为500 μg/ml。
1.4 细胞免疫化学染色
将转染铁蛋白基因质粒的C6细胞和对照C6细胞培养黏附于多聚赖氨酸包被的玻片上。用10%中性福尔马林固定细胞30 min,PBS缓冲液清洗。特异性兔抗鼠铁蛋白重链的多克隆抗体(Santa Cruz,美国)1:100稀释后加于细胞上,4℃条件下孵浴过夜。PBS缓冲液清洗,加第二抗体(Dako,丹麦)后,室温下孵浴30 min。用二氨基联苯显色,苏木精复染细胞核。
1.5 电感耦合等离子波谱仪(ICP)分析
培养细胞和组织细胞中铁原子浓度利用电感耦合等离子波谱仪(TJA IRIS Advantage/1000 Radial ICAP,Thermo Scientific,美国)分析。培养细胞用0.05%胰蛋白酶-EDTA(Gibico)消化后,加入PBS缓冲液清洗3次。离心后收集细胞。培养的细胞和组织中加入70%浓硝酸,90℃消化1 h,用纯水补足体积至5 ml。同时测定纯水空白管和含铁原子0.1、1、10和100 ppm的标准管,铁原子浓度通过标准曲线计算出。
1.6 活体磁共振扫描
转染铁蛋白重链质粒的C6细胞和对照C6细胞两组都标记SPIO。培养细胞中加入SPIO(Ocean Nanotech,美国)使其终浓度为60 μg/ml,轻轻混匀后置37℃的CO2培养箱中培养过夜。培养细胞用PBS缓冲液清洗3次,胰蛋白酶消化后,PBS缓冲液清洗,血球计数板计算细胞数目。将106细胞悬浮在30 μl PBS缓冲液中,置冰上备用。6~10周的裸鼠经异氟烷吸入麻醉后,在两后腿皮下分别接种细胞。
在细胞接种后不同时间点,进行GE 7 T磁共振扫描。扫描序列为快速旋转回波(fast spin echo, FSE)T2加权,具体参数为:TR=4000 ms,TE=40 ms,FOV=40 mm,Echo Train Length=8 ms。
1.7 统计学分析
使用SPSS 10.5软件对数据进行统计学处理,结果以均值±标准差表示,不同组之间的磁共振信号强度,细胞、组织铁原子浓度之间的差异通过t检验分析。P<0.05认为有统计学意义。
2 结果
2.1 高表达铁蛋白细胞在体外培养条件下对铁的摄取
鼠铁蛋白重链基因质粒转染C6细胞,通过G418进行筛选。应用特异性抗小鼠铁蛋白重链抗体进行细胞免疫化学染色,证实转染铁蛋白基因的C6细胞高表达铁蛋白重链(图1)。
转染铁蛋白质粒的C6细胞和对照C6细胞,使用常规F12 Kaighn's培养基培养,细胞的铁原子来源于15%的马血清和2.5%的胎牛血清。这两组细胞内铁原子的含量,通过ICP检测发现虽然转染铁蛋白基因的细胞铁原子浓度略高,但两组之间没有明显差异(n=3,P=0.068;图2A)。
当细胞培养基中加入0.2 mM 枸橼酸铵铁(ferric ammonium citrate, FAC)作为细胞外源性铁时,转染铁蛋白基因的C6细胞内铁原子浓度明显高于对照组C6细胞(n=3,P=0.001;图2A)。在培养基中加入不同浓度的FAC时(0.25、0.5、1.0和1.5 mM),转染铁蛋白基因的C6细胞内铁原子浓度与对照C6细胞相比,都明显升高(n=3,P=0.004、0.021、0.06和0.012;图2B)。

图1 细胞免疫组织化学染色和普鲁士蓝铁染色。a:对照C6细胞,b:转染铁蛋白重链基因C6细胞。利用特异性鼠铁蛋白重链多克隆抗体对细胞进行免疫组织化学染色,转染铁蛋白基因的C6细胞胞浆呈现棕黄色,为强阳性。对找组细胞呈淡黄色,为弱阳性。c:对照C6细胞标记SPIO。d:转染铁蛋白基因的C6细胞标记SPIO。普鲁士蓝染色显示在两组细胞内都有内吞的铁颗粒,细胞内的铁颗粒在两组细胞间没有明显差异Fig 1 . Immunohistochemical stain and Prussian blue iron stain in cells. Immunohistochemical stain was conducted in ferritin transfected and parental C6 cells with a specif i c polyclonal antibody against murine H-chain of ferritin. It showed that a week positive stain (brown particles)in cytoplasm of parental C6 cells (a)and strong positive stain in ferritin transfected C6 cells (b).There was no obvious difference in cellular SPIO label between parental C6 cells (c)and ferritin transfected C6 cells (d)after Prussian blue iron stain.
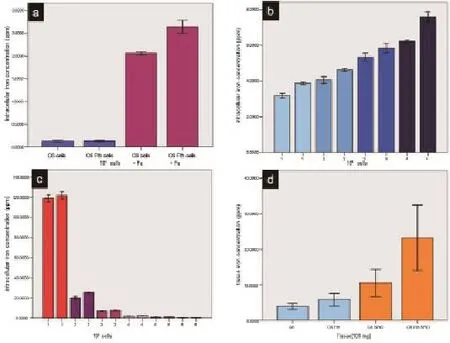
图2 细胞和肿瘤组织内铁浓度测定。a: C6和C6-Fth细胞在普通培养基和加入Fe离子培养条件下,细胞内铁浓度测定。b: C6和C6-Fth 加入不同浓度Fe离子后培养,细胞内铁浓度测定。相同颜色表示同样浓度。c: C6和C6-Fth细胞标记SPIO后连续6次传代,测定细胞铁浓度。d: C6和C6-Fth细胞以及标记SPIO后皮下接种裸鼠左右后腿,13天后取组织进行铁浓度测定Fig 2 . Intracellular iron concentration in C6 cells and xenografts measured by using ICP. (a)There was a minimal increasing of intracellular iron concentration in ferritin transfected C6 cells compared to parental C6 cells (n=3, P=0.684); the ferritin transfected C6 cells accumulated signif i cantly more iron compared to parental C6 cells after incubated with Fe supplement(n=3, P=0.015). (b)Incubating cells with Fe supplement at different concentrations, transfected C6 cells substantially accumulated more iron than parental C6 cells (n=3, P=0.004, 0.021, 0.06, and 0.012, respectively). (c)The transfected and parental C6 cells both labeled with SPIO were passaged successively. C6 cells overexprssed ferritin accumulated signif i cantly more iron than C6 control cells from second passage (n=3, P=0.03, 0.02, 0.004, 0.002, and 0.002 respectively). There was no signif i cant difference at fi rst passage (n=3, P=0.383). (d)No signif i cant difference of the iron concentration was detected between xenografts derived from transfected C6 and parental C6 cells (n=4, P=0.129), while significant difference was showed in xenografts both labeled with SPIO (n=5, P=0.034).
转染铁蛋白基因的C6细胞和对照C6细胞两者标记SPIO后,进行连续传代,并对每次传代细胞进行ICP测定细胞内铁原子浓度。在第一代时,两组细胞内铁原子浓度没有明显差异(n=3,P=0.383)。但从第二代开始,转染铁蛋白基因并标记SPIO的C6细胞,其铁原子浓度比没有转染铁蛋白基因但标记SPIO的C6细胞的铁原子浓度明显增加(n=3,P=0.03、0.02、0.004、0.002和0.002;图2C)。

图3 C6SPIO和C6-FthSPIO细胞接种后形成的肿瘤组织病理学检查和普鲁氏铁染色。 a:C6-Fth 细胞接种后组织学检查,HE染色显示肿瘤细胞。b: C6 细胞接种后组织学检查,HE染色显示肿瘤细胞。c:C6-Fth SPIO接种后组织铁染色,蓝色颗粒较多。d:C6-Fth SPIO接种后组织铁染色,蓝色颗粒较少。Fig 3 . Xenografts were histologically examined by HE stain (a. ferritin transfected C6 cells with SPIO labeling; b. parental C6 cells with SPIO labeling). Prussian blue iron stain shows that overexpressed ferritin proteins in C6 cells labeled with SPIO accumulate more iron (c)compared to parental C6 cells labeled with SPIO (d).
2.2 高表达铁蛋白细胞动物活体中对铁的摄取作用
转染铁蛋白基因的C6细胞和对照C6细胞,标记SPIO或者不标记SPIO,分别皮下接种两组裸鼠后腿两侧。为了探索高表达的铁蛋白在活体内对内源性铁和从SPIO降解出铁原子的捕获作用,在动物接种细胞后13天处死裸鼠,收集肿瘤组织,称重后进行ICP组织细胞铁原子含量分析。转染铁蛋白基因但没有进行SPIO标记的C6细胞来源的肿瘤组织,其细胞内铁原子含量比与对照C6细胞来源的肿瘤组织相比,虽然浓度略有增加,但没有明显差异(n=4,P=0.129;图2D)。转染铁蛋白基因同时标记SPIO的C6细胞来源的肿瘤组织,其细胞内铁原子的浓度,与标记SPIO的对照C6细胞来源的肿瘤组织相比,明显升高(n=5,P=0.034;图2D)。肿瘤组织同时进行病理学检查和普鲁士蓝铁染色。转染铁蛋白基因同时标记SPIO的C6细胞来源的肿瘤组织中铁颗粒比对照C6细胞标记SPIO来源的肿瘤多(图3)。
2.3 磁共振扫描接种动物
利用GE 7T小动物磁共振仪,采用T2加权序列在肿瘤接种后的第2、6和13天,对裸鼠进行扫描。分析磁共振信号强度,比较实验组和对照组的差异。转染铁蛋白基因而没有标记SPIO的C6细胞来源的肿瘤,与对照C6细胞来源的肿瘤相比,不同时间点磁共振信号强度差异不明显(n=4,第2天:P=0.379;第6天:P=0.105;第13天:P=0.056;图4)。而转染铁蛋白基因同时标记SPIO的C6细胞来源的肿瘤,与对照C6标记SPIO来源的肿瘤相比,不同时间点的磁共振信号强度存在明显差异(n=5,第2天:P=0.012;第6天:P=0.003;第13天:P=0.021;图4)。
3 讨论
由于磁共振具有较高的时间和空间分辨力、无创伤性、可以提供解剖结构信息等优点,它已经被用于干细胞研究的成像[7,10-12,17]。目前磁共振活体示踪主要是通过细胞内吞超顺磁性纳米铁颗粒(SPIO),利用T2或者T2*序列进行磁共振扫描时产生对比度。SPIO标记细胞后,随着细胞分裂,细胞内的浓度会逐渐降低。其原理:一是由于SPIO颗粒本身随着细胞分裂而分裂,物理性稀释;二是SPIO颗粒与溶酶体等酸性物质结合后,发生化学降解,释放出游离铁原子。在分裂较快的细胞,8次传代后,SPIO颗粒就在细胞内消失了。分裂较慢或不分裂的细胞,在细胞内也只能保留2个月左右。所以,用纳米铁颗粒进行细胞活体示踪的最大缺陷是无法长期跟踪接种的治疗细胞。铁蛋白作为细胞本身的一种物质,在机体铁代谢中主要作用为储存铁原子,是一种内源性磁共振报告基因[14-16,18-20]。铁蛋白摄取内源性铁形成超顺磁性纳米铁产生磁共振信号,由于机体内源性铁浓度较低,所以依靠铁蛋白形成的磁共振信号较弱。本研究中,我们首先人工导入铁蛋白重链基因,使C6细胞高表达铁蛋白,再用SPIO标记该细胞,观察高表达的铁蛋白是否能够将细胞内降解的SPIO铁原子作为额外铁源进行摄取,从而增强磁共振信号。
高表达铁蛋白重链基因的C6细胞在体外培养时,如果使用常规培养基,以胎牛血清和马血清中的铁为外源性铁源,培养一定时间后,细胞内的铁浓度和对照C6细胞相比没有明显增加。但如果在培养基中加入枸橼酸铵铁作为铁源,转染基因的C6细胞比对照组细胞摄取的铁原子明显增加,而且随着外源性铁浓度增加,细胞内的铁浓度也增加。这部分体外试验结果证实,我们构建的铁蛋白重链具有摄取和储存铁原子的作用,但如果细胞外铁浓度低,其摄取储存铁的作用无法充分显示。转染铁蛋白重链基因的C6细胞和对照C6细胞标记SPIO后进行连续传代,在第一次传代,两者的子细胞内铁浓度没有差异,这可能是由于两组细胞内的铁浓度非常高,铁蛋白摄取的铁与细胞内吞的铁浓度相差太大,无法显示。从第二代子细胞开始,两组细胞内铁浓度开始产生差异,说明随着细胞分裂,细胞内的SPIO迅速被稀释和降解,同时证实在培养条件下,铁蛋白具有回吸收和利用SPIO降解的铁功能。

图4 细胞接种不同时间点进行磁共振扫描。a:C6细胞和转染铁蛋白重链基因的C6细胞皮下接种裸鼠左右后腿后不同时间点磁共振扫描的T2*信号强度。左侧为C6-Fth细胞,右侧为C6细胞。b:与a组对应的磁共振图像。c: C6细胞和转染铁蛋白重链基因的C6细胞标记SPIO后。皮下接种裸鼠左右后腿后不同时间点磁共振扫描的T2*信号强度。左侧为C6-Fth细胞SPIO,右侧为C6细胞SPIO。d: 与c组对应的磁共振图像。Fig 4 . In vivo MRI. C6 cells overexpressing ferritin protein showed minimal reducing signal intensity compared to parental C6 cells at different time points (Figure a; n=4; P=0.379, 0.105 and 0.056 on day-2, 6 and 13, respectively). Overexpressed ferritin proteins in C6 cells labeled with SPIO signif i cantly reduced signal intensity in T2-weighted images for MRI (Figure c; P=0.012, 0.003 and 0.021 on day-2, 6 and 13, respectively). Data are presented as mean ± s.d. Figure b and d shows representative T2-weighted fast spin echo images of xenografts on day2, 6, and 13.
体内实验结果表明,当高表达铁蛋白重链的C6细胞接种后13天,其肿瘤细胞内的铁浓度与没有转染铁蛋白基因的C6相比,虽然略有增加,但不明显。该现象可以解释为:铁蛋白重链可以摄取一定的内源性铁,但由于这种铁浓度非常低,所以铁蛋白无法在细胞内通过摄取内源性铁而存储较多的铁。当转染铁蛋白重链基因同时标记SPIO后,C6细胞接种后13天形成的肿瘤细胞,其细胞内铁浓度比仅标记SPIO的C6细胞明显增加。我们的研究结果证实,高表达的铁蛋白可以将SPIO降解的铁作为额外的铁源摄取和储存在细胞内。细胞接种后不同时间点的磁共振扫描信号强度,与细胞内铁原子浓度结果相符。肿瘤细胞组织普鲁士蓝铁染色,进一步证实了这一结果。
本研究证实,铁蛋白可以与细胞标记的SPIO作用,延长SPIO活体示踪细胞的时间;同时降解的SPIO可以加强铁蛋白报告基因的信号强度。两者联合使用,可以增强对标记细胞的活体示踪时间和磁共振信号强度。本研究结果对于进行临床细胞治疗和基因治疗,对治疗细胞的定位、存活和生长情况实时监测具有一定的应用价值。本研究的局限性在于实验鼠样本较少,在待扩大样本进一步证实的该结论的可靠性。
[1]Savitz SI. Introduction to cellular therapy: the next frontier for stroke therapeutics. Stroke, 2009, 40(3 Suppl): S141-S142.
[2]Mansour S, Roy DC, Lemieux B, et al. Stem cell therapy for the broken heart: mini-organ transplantation.Transplant Proc, 2009, 41(8): 3353-3357.
[3]Kolli S, Ahmad S, Lako M, et al. Successful clinical implementation of corneal epithelial stem cell therapy for treatment of unilateral limbal stem cell deficiency. Stem Cells, 2010, 28(3): 597-610.
[4]Kitamura H, Okudela K, Yazawa T, et al. Cancer stem cell:implications in cancer biology and therapy with special reference to lung cancer. Lung Cancer, 2009, 66(3): 275-281.
[5]Gonez LJ, Knight KR. Cell therapy for diabetes: Stem cells, progenitors or beta-cell replication? Mol Cell Endocrinol, 2010, 323(1):55-61. [Epub 2009 Dec 21].
[6]Cartier N, Hacein-Bey-Abina S, Bartholomae CC, et al.Hematopoietic stem cell gene therapy with a lentiviral vector in X-linked adrenoleukodystrophy. Science, 2009,326(5954): 818-823.
[7]Yamada M, Gurney PT, Chung J, et al. Manganese-guided cellular MRI of human embryonic stem cell and human bone marrow stromal cell viability. Magn Reson Med,2009, 62(4): 1047-1054.
[8]Modo M, Beech JS, Meade TJ, et al. A chronic 1 year assessment of MRI contrast agent-labelled neural stem cell transplants in stroke. Neuroimage, 2009, 47(Suppl 2):T133-T142.
[9]Liu J, Cheng EC, Long Jr RC, et al. Noninvasive Monitoring of Embryonic Stem Cells in vivo with MRI Transgene Reporter. Tissue Eng Part C Methods, 2009,15(4): 739-747.
[10]Chapon C, Jackson JS, Aboagye EO, et al. An in vivo multimodal imaging study using MRI and PET of stem cell transplantation after myocardial infarction in rats.Mol Imaging Biol, 2009, 11(1): 31-38.
[11]Wu X, Hu J, Zhou L, et al. In vivo tracking of superparamagnetic iron oxide nanoparticle-labeled mesenchymal stem cell tropism to malignant gliomas using magnetic resonance imaging. Laboratory investigation. J Neurosurg, 2008, 108(2): 320-329.
[12]Kraitchman DL, Gilson WD, Lorenz CH. Stem cell therapy: MRI guidance and monitoring. J Magn Reson Imaging, 2008, 27(2): 299-310.
[13]Cohen B, Ziv K, Plaks V, et al. MRI detection of transcriptional regulation of gene expression in transgenic mice. Nat Med, 2007, 13(4): 498-503.
[14]Deans AE, Wadghiri YZ, Bernas LM, et al. Cellular MRI contrast via coexpression of transferrin receptor and ferritin. Magn Reson Med, 2006, 56(1): 51-59.
[15]Genove G, DeMarco U, Xu H, et al. A new transgene reporter for in vivo magnetic resonance imaging. Nat Med, 2005, 11(4): 450-454.
[16]Cohen B, Dafni H, Meir G, et al. Ferritin as an endogenous MRI reporter for noninvasive imaging of gene expression in C6 glioma tumors. Neoplasia, 2005,7(2): 109-117.
[17]Brekke C, Williams SC, Price J, et al. Cellular multiparametric MRI of neural stem cell therapy in a rat glioma model. Neuroimage, 2007, 37(3): 769-782.
[18]Pawelczyk E, Arbab AS, Pandit S, et al. Expression of transferrin receptor and ferritin following ferumoxidesprotamine sulfate labeling of cells: implications for cellular magnetic resonance imaging. NMR Biomed,2006, 19(5): 581-592.
[19]Arosio P, Levi S. Ferritin, iron homeostasis, and oxidative damage. Free Radic Biol Med, 2002, 33(4): 457-463.
[20]Aisen P, Enns C, Wessling-Resnick M. Chemistry and biology of eukaryotic iron metabolism. Int J Biochem Cell Biol, 2001, 33(10): 940-959.
