CT值变化率在胃肠道间质瘤靶向治疗影像学评效的应用研究
2010-05-31唐磊孙应实沈琳李健齐丽萍张晓鹏
唐磊 孙应实 沈琳 李健 曹 齐丽萍 崔 张晓鹏*
北京大学临床肿瘤学院,北京肿瘤医院暨北京市肿瘤防治研究所1、医学影像科;2、消化内科
恶性肿瘤发病机制及转化研究教育部重点实验室,100142,北京
胃肠道间质瘤(Gastrointestinal stromal tumor,GIST)是胃肠道最常见的非上皮源性肿瘤,选择性酪氨酸激酶抑制剂甲磺酸伊马替尼(imatinib mesylate, STI571)在多数复发或转移GIST患者中具有肯定的客观疗效[1]。GIST疗效评价曾一度沿用国际实体瘤评效标准——RECIST标准,但随着临床研究的深入,发现其应用于GIST评效存在问题[2]。鉴于此,Choi等[3,4]结合一组临床病例研究,于2007年制定了新的GIST疗效评价标准(以下简称Choi标准)。本研究小组前期通过北京肿瘤医院(BCH)一组26例晚期GIST患者伊马替尼治疗前后CT复查情况的比较,进一步对Choi标准进行了验证[5]。
研究同时发现Choi文章中存在的一个问题:受病例分布的制约,Choi研究中结合CT值降低率≥15%标准后评价为缓解的病例仅1例,无法通过统计学数据证实CT值变化率在其标准体系的地位和价值[3]。本研究拟利用BCH病例,通过统计学验证CT值变化率在新的评效标准中的意义;同时利用Choi标准对CT检查基线处于治疗后短期内的病例进行评价,尝试扩大Choi标准的临床适用范围。
1 材料和方法
回顾分析我院接受甲磺酸伊马替尼一线治疗同时具备CT中短期连续复查影像结果的晚期GIST患者资料。
1.1 CT检查 检查前12小时禁食禁水,常规仰卧位扫描,Siemens plus4螺旋CT及GE 64层MDCT,以3m l/s~4m l/s速度静脉注射非离子造影剂100m l,单排螺旋CT于门脉期扫描,64排螺旋CT于注药后20s、40s及60s分别扫描。单排螺旋CT成像参数:电压120kv~130kv,电流200m A~280m A,X线束厚5mm,床速5mm/s~10mm/s,螺距1-2,重建图像间隔4.0mm~4.9mm。64排螺旋CT成像参数:电压120kv,电流320mA-420m A,X线束厚40mm,探测器宽度0.625mm,床速36mm/s,螺距0.9,重建图像层厚5mm。保证同一病例前后两次检查均在相同机器上进行。
1.2 数据分析 全部数据测量在华海MEDV IEWER 3.0工作站完成
1.2.1 长径 于轴位图像测量肿瘤最长径线,按照RECIST及Choi标准要求(靶病灶≤5个/脏器,≤10个/例)累加并平均得到病例长径均值。两次检查长径退缩率=(疗前长径-疗后长径)/ 疗前长径。
1.2.2 CT值 增强静脉期图像,于肿瘤最大层面采用不规则曲线边缘勾勒法,包括入全部肿瘤部分,同上累加并平均得到病例CT均值。两次检查CT值降低率=(疗前CT值-疗后CT值)/ 疗前CT值。
1.2.3 疗效分组 按照Choi分组方法,治疗后病变有缓解组(good responses, GoodR)定义为CT测量肿瘤长径缩小≥10%和/或肿瘤密度(HU)减小≥15%,不满足上述条件者定义为无缓解组(poor responses, PoorR)。按照RECIST评效标准,完全缓解(CR)定义为肿瘤完全消失,部分缓解(PR)定义为肿瘤最大长径缩小≥30%,病变进展(PD)为肿瘤最大长径增大≥20%,病变稳定(SD)定义为PR和PD之间的情况。
1.2.4 肿瘤进展时间(Time to Tumor Progression,TTP) 出现新病灶,出现新的“囊中结节”“块中结节”或已有瘤内结节体积增大,或肿瘤长径均值增大≥20%而无密度减低,均定义为病变进展。TTP定义为从治疗开始到疾病进展的时间,或至随访终末期疾病未进展的持续时间,以月为单位。
1.3 统计分析 采用SPSS 11.5统计软件分析,不同评效标准分组病例的分布比较采用x2检验,中位肿瘤进展时间TTP比较采用Kaplan-Meier法。以P<0.05为差异有统计学意义。
2 结果
2.1 患者资料 2003年4月至2008年1月,我院共26例晚期GIST患者符合入组条件,其中原发灶位于小肠9例,胃8例,十二指肠4例,腹膜2例,直肠2例,肠系膜1例;26例患者中,肝脏转移病灶38个,肠系膜转移病灶19个,十二指肠及小肠病灶3个,胃病灶3个,直肠病灶2个,共计测量靶病灶65个。其中我院首次CT检查在服药后2个月内病例16例。RECIST标准评效CR 0例,PR 7例,SD 18例,PD 1例;其中6例评效SD的患者后期继续服用伊马替尼后出现PR。本组患者最长随访时间56个月,最短随访时间15个月,中位随访时间为23.5个月,目前10例患者已得出最终TTP;截止至2008年1月26例患者的中位TTP为17.5个月。
2.2 CT值变化率贡献性研究 根据Choi标准,本组14例病变治疗后长径退缩率≥10%;余12例中,5例出现长径结合CT值后评价为缓解(长径退缩率<10%而CT值降低率≥15%)的情况(表1)。仅根据长径退缩率≥10%分为GoodR和PoorR组,两组TTP差异无统计学意义(图1);纳入CT值降低率≥15%标准后,两组TTP出现差异(图2)。
2.3 基线CT检查在服药后短期内组评效情况 我院首次CT检查(基线CT)在服药后2个月内病例16例,RECIST标准评价均为无缓解病例;Choi标准评价缓解9例,无缓解7例,缓解率56%;两个标准评效病例分布差异有统计学意义(P=0.001)。应用Choi标准评效,TTP在缓解和无缓解组间差异有统计学意义(图3,P<0.05)。
3 讨论
靶向治疗是针对细胞受体、关键基因和调控分子等生物靶点进行干预,阻断肿瘤的增殖,达到阻止肿瘤的发生发展,促进肿瘤细胞凋亡的特异性治疗方式。伊马替尼是作用于酪氨酸激酶核苷酸结合位点的靶向治疗药物,在晚期GIST临床治疗中取得了肯定的客观疗效,被认为是靶向治疗的典范[3,4,6,7]。PET是目前公认可以早期评价GIST伊马替尼治疗疗效的影像学手段[8],然而价格昂贵和接近20%病灶不能显示的缺陷,成为制约PET评效应用的重要因素[3]。CT价格相对低廉且操作简便易行,可准确评价GIST治疗过程中体积变化,并能在一定程度上反映出血、坏死、囊变等疗效改变,对GIST疗效评价有较高的应用价值[3,4,9,10]。
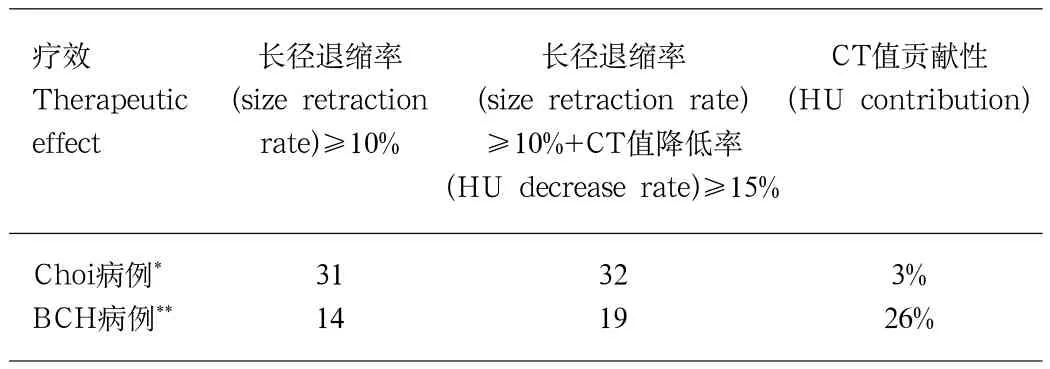
表1 肿瘤长径及CT值变化率对评效的贡献性(Choi病例与BCH病例比较)Tab le1 The contribution of size and HU change rates to therapeutic evaluation
目前各部位实体瘤的CT评效多参照RECIST标准。但是,GIST在进行伊马替尼靶向治疗时,有效病例往往早期体积变化较小,而内部组织成分变化大(坏死、囊变、出血),RECIST标准(长径缩小≥30%为治疗缓解)的适用性因而受到质疑[1-4]。对此,Choi等[3]结合一组临床病例结果,于2007年提出了新的GIST疗效评价标准。它结合肿瘤长径退缩率和强化CT值变化率两个指标,放宽了RECIST对于治疗缓解定义的限制,将长径缩小≥10%或CT值下降≥15%作为治疗缓解指标,通过40例验证其与TTP有较好的相关性;而同组病例采用RECIST标准评效时分组TTP无差异。

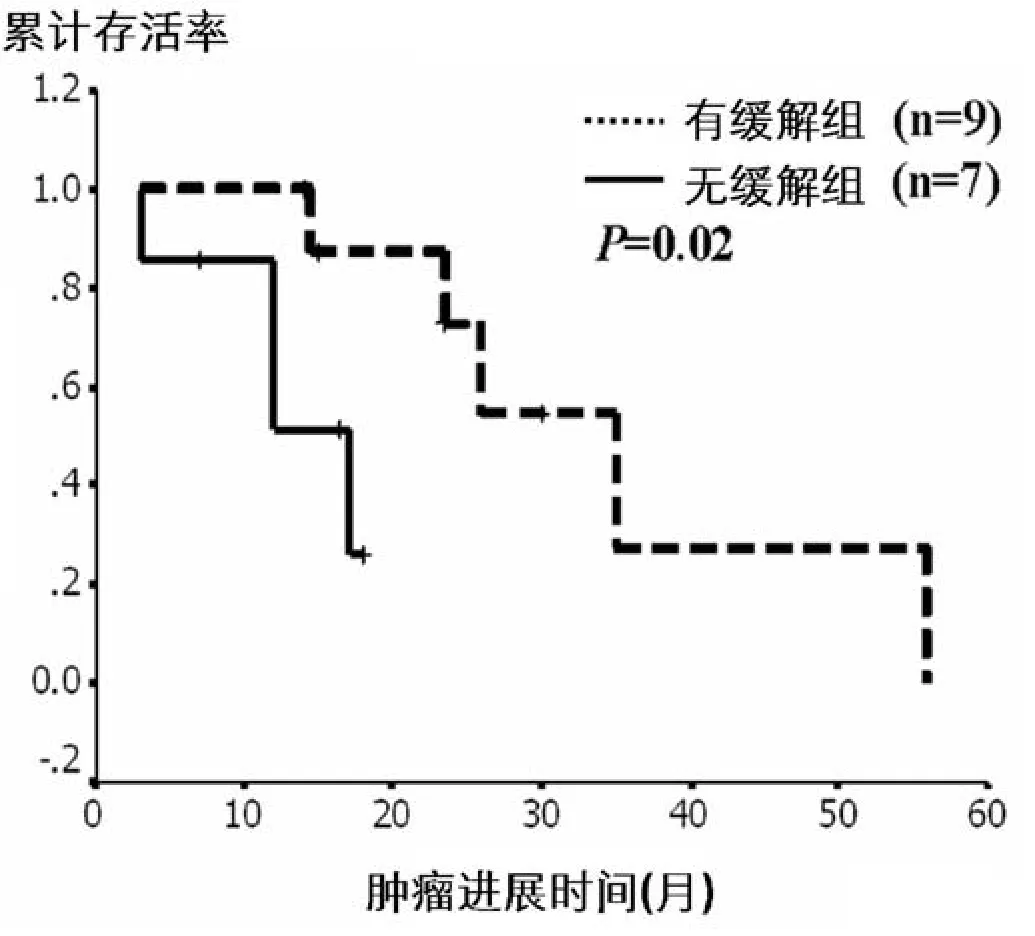
图1~3 Kap lan-M eier法对不同分组标准进展时间TTP差异性的比较。图1 仅按长径退缩率≥10%标准分组,缓解组和无缓解组间长期预后(TTP)无明显差异。图2 结合长径退缩率≥10%及CT值降低≥15%标准分组,缓解组和无缓解组间长期预后(TTP)存在统计学差异。图3 首次CT检查(基线检查)在服药后2个月内的病例,按Choi标准分组,缓解组和无缓解组间长期预后(TTP)存在统计学差异。Figure 1~3. TTP variances of different grouping criteria by Kap lan-M eier test. Figure 1. There w as no statistical significance betw een GoodR and PoorR groups according to the criteria of size retraction ≥10%. Figure 2.There w as statistical significance betw een GoodR and PoorR groups according to the combination criteria of size retraction ≥10% and HU reduction ≥15%. Figure 3. Cases with baseline CT exam inations at tw o months post treatment. There w as statistical significance betw een GoodR and PoorR groups.
本研究小组之前通过北京肿瘤医院(BCH)一组26例晚期GIST患者伊马替尼治疗前后CT复查情况的比较,证实了Choi标准在GIST早期疗效评价的应用价值优于RECIST标准[5]。利用Choi标准早期评效得到缓解组病例的比例(73%)明显高于RECIST标准(27%),应用RECIST标准评效时,GoodR组和PoorR组TTP差异无统计学意义;而应用Choi标准评效时,TTP在GoodR组和PoorR组间差异有统计学意义,与Choi研究结果近似。目前国内尚未见其他研究中心对该标准应用情况的报道。
进一步分析Choi研究[3]可以发现,其文章中并未通过统计学数据验证CT值在标准体系的地位和价值。Choi研究中,仅根据长径缩小≥10%即可判断94%的治疗缓解病例,而结合CT值降低≥15%标准后评价为缓解的病例仅1例,无法通过统计验证CT值在Choi标准的应用价值[3]。故其研究中CT值的意义仅可视为一个假定的推论。本组有5例治疗后长径缩小率不足10%,结合CT值降低≥15%后评价为GoodR的病例,结合CT值将GoodR的评价率提高了26%;进一步通过分组TTP比较,发现仅依靠长径退缩率≥10%分组得到TTP并无差异,而结合CT值降低率≥15%的标准后,GoodR组TTP长于PoorR组病例。从而以确凿的统计学数据验证了CT值在Choi标准中的价值。
本研究中较为典型证明CT值在GIST评效应用价值的病例:38岁女性,治疗后3个月复查,肿瘤体积增大11%,但增强CT值明显下降达16%,结合平扫发现为肿瘤内出血导致(图4~7)。若以RECIST评效,病变无缓解;而Choi标准结合CT值后评为病变缓解。该患者目前已28个月无进展,明显高于本组的中位TTP时间17.5个月。
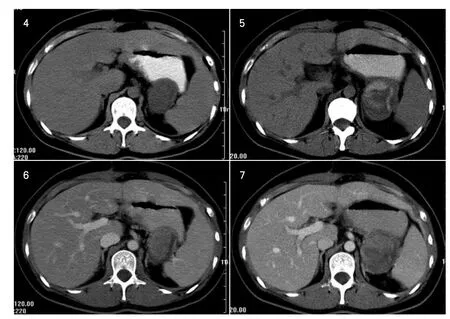
图4~7 胃GIST疗后肿瘤内出血,体积增大11%,强化CT值减小16%,Choi标准评价为缓解。图4 治疗前CT平扫,肿瘤密度均匀;图5 治疗后CT平扫,肿瘤内出血呈高密度,肿瘤体积增大;图6 同图4治疗前,CT增强扫描,肿瘤强化较均匀;图7. 同图5治疗后,CT增强扫描,肿瘤体积增大,肿瘤强化减低、不均。Figure 4~7. Hemorrhage disp layed in the GIST tum o r w h ich w as post trea tm en t. The size increased 11%, and HU decreased 16%, w hich w as evaluated as GoodR by Choi criteria. Figure 4 It displayed homogeneous density in the tumor nonenhanced CT pre-treatm ent. Figure 5 H igh density w as demonstrated in the tum or on non-enhanced CT caused by hem orrhage, and the tum or size w as increased. Figure 6. The same case as figure 4 show ed hom ogeneous enhancem ent. Figure 7.The same case as figure 5 show ed heterogeneous and decreased enhancement with an en larged tumor size.
本研究同时对短期治疗过程中复查病例Choi标准的应用情况进行了单独评价,尝试扩大Choi标准的临床应用范围。由于为回顾性分析资料,且Choi标准要求测量CT值,本组研究纳入了部分我院首次CT检查(基线CT)在服药后2个月内的病例,结果发现分组TTP差异亦存在统计学显著性,说明服药后短期内应用Choi标准判效同样可得到有意义的结果。在临床应用时,可适当放宽对监测时间点的限制,纳入部分治疗中病例,以扩大临床应用范围,为患者提供便利。
综上所述,联合CT值变化率与长径退缩率作为指标,可在早期有效评价GIST伊马替尼治疗疗效并客观反映中长期预后,使更多患者受益的同时得到更为客观的评效结果。Choi标准对CT检查基线处于治疗后短期内的病例同样有效,可扩大病例纳入范围,具有较强的临床实用价值。最后需要说明的是,本组研究病例相对较少,而其中尚未出现进展的病例数目较多,研究属于中期报告,更为确切的结果还需后续追访研究进一步证实。
Reference
1.Siehl J, Thiel E. C-kit, GIST, and imatinib.Recent Results.Cancer Res. 2007, 176: 145-151.
2.Menu Y. Evaluation of tumor response to treatment with targeted therapies: standard or targeted criteria? Bull Cancer, 2007, 94(7):231-239.
3.Choi H, Charnsangavej C, Faria SC, et al. Correlation of computed tomography and positron emission tomography in patients with metastatic gastrointestinal stromal tumor treated at a single institution with imatinib mesylate:p roposal of new com puted tomography response c riteria. J Clin Onco l, 2007,25(13):1753-1759.
4.Ben jam in RS, Choi H, Macapinlac HA, et al. W e should desist using RECIST,at least in GIST. J Clin Onco l,2007,25(13):1760-1764.
5.张晓鹏, 唐磊, 沈琳, 等. 伊马替尼治疗胃肠道间质瘤早期疗效评价研究. 中国实用外科杂志, 2008, 28(12): 1059-1062.
Xiao-peng ZHANG, Lei TANG, Lin SHEN, et al. Early evaluation of imatinib in treatment of gastrointestinal stromal tumor using CT imaging.Chin J Prac Surg. 2008, 28(12): 1059-1062.
6.Antonescu CR. Gastrointestinal stromal tumor(GIST) pathogenesis, fam ilial GIST, and animal models. Sem in Diagn Pathol, 2006,23(2): 63-69.
7.沈琳, 金懋林. 甲磺酸伊马替尼治疗复发或转移性胃肠道间质瘤. 中华肿瘤杂志, 2004,26(11): 697-699.
Lin SHEN,Mao-lin JIN. Imatinib mesylate alone for refractory advanced gastrointestinal strom a l tum o r. Chin J Onco l, 2004,26(11): 697-699.
8.Demetri GD, Benjam in RS, Blanke CD, et al. NCCN Task Force report: management of patients with gastrointestinal stromal tumor(GIST)--update of the NCCN clinical practice guidelines. J Natl Compr Canc Netw, 2007,5(Suppl 2): 1-29.
9.Burkill GJ, Badran M, Al-Muderis O, et al. Malignant gastrointestinal stromal tumor:distribution, imaging features, and pattern of metastatic spread. Radiology, 2003, 226(2):527-532.
10.张森, 万德森. 胃肠道间质瘤的诊治进展.中华胃肠外科杂志, 2003, 6(5): 347-349.
Shen ZHANG,De-sen WAN. The development of diagnosis and treatment of GIST. Chin J Gastrointest Surg. 2003, 6(5): 347-349.