胃肠道间质瘤的CT诊断及不同危险性征象分析
2010-05-31李健丁乔英贺敬红
李健丁 乔英 贺敬红
山西医科大学第一医院放射科,043300,太原
胃肠道间质瘤(gastrointestinal stromal tumors, GIST)是胃肠道最常见的间叶源性肿瘤,约占胃肠道肿瘤的0.1%~3%,所有软组织肉瘤的5%。由于光学显微镜下近乎相同的形态表现,GIST过去常被诊断为平滑肌瘤、平滑肌肉瘤或神经鞘膜瘤等。目前,其相关文献多见于病理学及影像学描述,对两者结合进行危险性分级的CT征象报道较少。本文将34例经手术病理证实的胃肠道间质瘤进行回顾性分析,以期进一步提高对该病的认识。
1 临床资料
1.1 一般资料 收集我院34例经手术病理证实的胃肠道间质瘤,男18例,女16例,年龄28岁~79岁,中位年龄53岁。病程1周至6年,临床表现腹部不适和/或腹痛15例,腹部肿块12例,消化道出血11例,贫血5例,不全肠梗阻症状2例。所有病例均经手术病理证实,并具有具有完整的CT资料。
1.2 影像学检查 所有病例均行CT平扫加三期增强扫描,采用SOM ATOM PLUS 4型或EMOTION型全身螺旋CT机,空腹8小时,于检查前1~2小时内分次口服温开水(29/34)或2%泛影葡胺(5/34)800m l~1200m l。扫描层厚5mm~8mm,螺距1.5~1。造影剂为非离子型U travist(300m g I/m l),注射量1.5m l/kg,速率3.0m l/s~3.5m l/s,三期延迟时间分别为25秒、60秒、120秒。
1.3 病理学诊断及危险性判断标准 所有患者通过手术取得病理标本,通过对标本的组织学形态判断及免疫组织化学染色做出最终病理诊断。以CD117或/和CD34阳性组织学呈梭形细胞型、类上皮细胞型或混合型者为诊断标准。以2002年Fletcher等报道的NIH(National Institute of Health,美国国立卫生研究院)会议的分类原则作为危险性级别的判定标准[1]:(1)极低危险:肿瘤直径≤2cm,核分裂相<5/50HPF;(2)低危险:2cm<肿瘤直径<5cm,核分裂相<5/50HPF;(3)中危险:肿瘤直径<5cm,5<核分裂相<10/50HPF或5cm<肿瘤直径<10cm、核分裂相<5/50HPF;(4)高危险:直径>5cm、核分裂相>5/50HPF,或肿瘤直径>10cm任何核分裂相,或核分裂相>10/50HPF任何大小的肿瘤。
1.4 影像资料分析 由2名副主任及以上职称医师各自独立阅片,①对照病理结果,回顾性总结病变的CT表现,包括部位、大小、形态、密度、增强表现等;②根据病理危险性分级将胃肠道间质瘤分为二组,即极低及低危险组和中高危险组,分析二组CT征象的差别。不同之处经讨论后确定一致。
1.5 统计学处理 采用统计学软件SPSS13.0,对胃肠道间质瘤极低及低危险组和中高危险组影像学观察指标比较采用Fisher精确概率法,以P<0.05为差异有统计学意义。
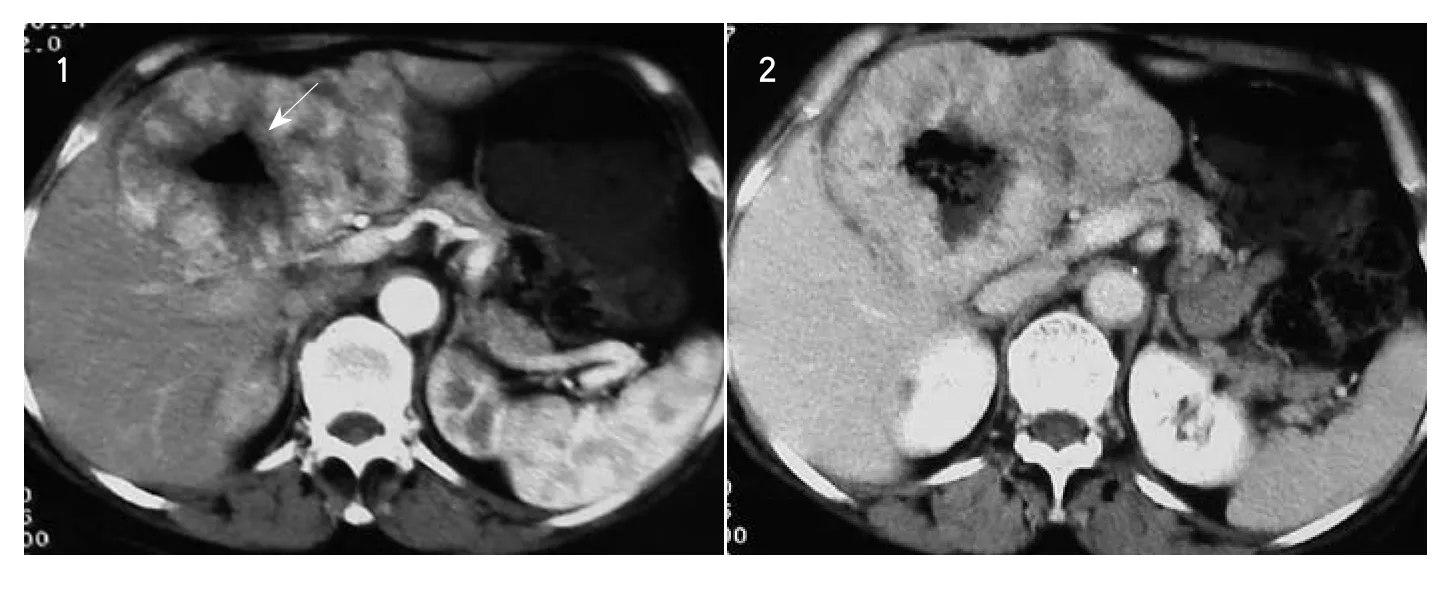
图1、2 病理为十二指肠高危恶性间质瘤。图1:动脉期实质部分边缘明显强化,见点、线状类血管影。病灶中心有空洞状影。与肝脏间见少量液体影。图2 与图1同一患者,静脉期实质内强化范围扩大,但强化程度下降程度较小。Fig、2: Pathology is Duodenum high risk Malignant strom al tumor. Fig1:The edge of substantial part has significant enhancement and point and linear vascular shadow in the arterial period. The center of lesion has cavitary. A small amount of liquid is seen betw een leision and liver. Fig 2:In the same patient,the enhanced scope of thelesion has expansion in the vein period, but the deg ree of enhancement decreased to a lesser ex tent.
2 结果
2.1 病变部位、大小、形态及边缘 肿块位于胃部21例,十二指肠2例,小肠7例,回盲部2例,直肠2例。最小径线2.0cm×3.0cm×3.0cm,最大径20cm×20cm×14cm,对照术后病理,肿块均明确显示。形态不规则较多(25/34),其中见较明显分叶状(13/25),其它为类圆形或椭圆形(9/34)。多为外向性生长(25/34),其中1例十二指肠起源肿块CT误判为胃窦部(图1、图2)。多数边界清楚(20/25)。

表1 34例不同危险性胃肠道GIST的CT征象比较
2.2 CT表现 平扫均表现为软组织密度肿块。多数密度不均(24/34),部分表现为中间或散在低密度(17/24),病理为坏死、囊变、黏液样变性或陈旧性出血;部分表现为肿块内空洞或长条状窦道样结构(7/24),含气液面或/和肠道内对比剂(图4)。3例见瘤体内新鲜出血高密度影(图3),1例肿块内见点状钙化。少数密度均匀(6/34)(图5)。多数边界清楚(20/25)。增强扫描少数轻中度均匀强化(10/34),CT值增加值为Δ15.5Hu~Δ24.0Hu;多数不均匀明显强化(24/34)(图5),实质部分CT值增加值为Δ40Hu~Δ58Hu。强化峰值多为静脉期(22/34),动静脉期持续强化、峰值变化较小(29/35)。动脉期外围出现点线状血管样强化(22/34)(图6)。

图3 肿块内可见出血(箭头所示)Fig 3. H em o r rh age can be seen with in the tumor(arrow).图4 肿块内可见气体影(箭头所示)F ig 4. T h e g as can b e seen with in the tum or(arrow).图5 肿块呈不均匀明显强化,内部可以看到异常血管影Fig 5. M ass show ed heterogeneous enhancem ent and the abnormal b lood vessels can be seen within the M ass.图6 病理为直肠低度恶性间质瘤。CT平扫示肿物外生性生长,呈均匀软组织密度Fig 6. Pathology is the low-grade rectal stromal tum ors. The leision show ed exogenous grow th and a homogeneous soft tissue density in CT scan.
2.3 不同危险性胃肠道间质瘤CT征象比较 根据病理结果,将34例胃肠道间质瘤分为极低及低危险组和中高危险组,二组CT征象比较见表1。二组中,肿块大小(以5cm为界)、密度是否均匀、形态是否规则、动脉期有无索条样强化有统计学意义(P<0.05),而强化程度无统计学意义(P>0.05)。
2.4 手术病理 肿块起源于胃部21例,十二指肠2例,小肠7例,回盲部2例,直肠2例。黏膜下型4例,肌壁间型16例,浆膜下型14例。肿瘤大多血供较丰富,境界清晰,8例有假包膜为压迫周围组织形成。肌壁间型和浆膜下型中10例向腔外生长的肿瘤与周围组织均有不同程度的粘连。5例发现局部淋巴结转移。病理大体切面灰白或暗红,质实,鱼肉状,多见灶性出血、坏死、囊变或空洞及窦道。镜下13例为梭形细胞型,11例为混合型,10例为上皮样细胞型。有不同程度的核分裂像及核异型。免疫组化示全部病例CD117阳性,CD34(+)及波形蛋Vim(+)分别为25例、9例。由一名病理科副主任医生复阅所有切片,并按照NIH 标准进行分类,高危17例,中危10例,低危6例,极低危为1例。
3 讨论
3.1 病理及临床特点 胃肠道间质瘤(GIST)是一类独立的来源于胃肠道原始间叶组织的非定向分化的肿瘤,免疫表型上表达K IT蛋白(CD ll7),遗传学上存在频发性c-kit基因突变,组织学上富含梭形和上皮样细胞[2]。GIST最常见的原发部位是胃和小肠,其中发生于胃60%~70%,小肠20%~30%,肛管、直肠和结肠7%,另有2%~3%发生于食管。大体病理可分为黏膜下型、肌壁间型和浆膜下型等。本组以肌壁间和浆膜下型多见(30/34),说明胃肠道间质瘤以外向性生长为主。镜下分为梭形细胞型、上皮细胞型和混合型,确诊依据免疫组织化学和电子显微镜检查,CD117或/和CD34阳性最具诊断价值,其它指标具鉴别诊断价值。本组全部病例CD117阳性,CD34有25例阳性。
3.2 临床特点 GIST多见于中年及老年,40岁以前少见,发病的中位年龄为50~60岁。症状与肿瘤大小、发生部位、肿物与肠壁的关系以及肿瘤的良恶性有关。临床表现缺乏特征性。肿瘤较小者(直径小于2cm)常无症状,往往在癌症普查和其它手术时无意中发现,最常见的临床症状是中上腹部不适和腹部肿块(50%~70%)以及便血(20%~50%),小肠GIST可表现为疼痛、便血或肠梗阻。本组男女性比例大致相等多,年龄多数在50岁以上。腹部包块虽无特异性,但有重要提示性,本组12例。消化道出血是其重要表现,由黏膜溃疡所致[3]。本组确切的消化道出血就有11例,其中1例因病灶较小和肠道准备不良,CT没有明确诊断,但因反复出血而行DSA检查发现病灶。肠梗阻很少见,推测原因可能与起源于黏膜下、主要外向性生长有关,本组2例肠梗阻为腔内型生长所致。
3.3 CT表现 综合文献报道,胃肠道间质瘤CT表现[4-6]为:(1)可呈多种形态,但大多境界清晰光整,即使是体积巨大,其对周围组织的浸润也相对轻微,仅表现为肿块边缘与邻近结构的分界趋于模糊。(2)肿块多富于血供,内部出血、坏死、囊变显著,增强扫描实质部分多有较明显强化。(3)多经血行转移,淋巴转移少见。本组资料显示胃肠道间质瘤最基本的CT特征是软组织肿块,多数较大,有外生性倾向。密度不均是其最常见的CT表现,根据与病理对照结果,密度不均可以是黏液样变性、坏死、囊变或陈旧性出血,但CT无法区分上述情况;也可以是肿瘤内部坏死后与肠腔相通,形成空洞或窦道,CT特征性地显示为含气、液体或肠道对比剂,较易判断。形态不规则甚至呈明显分叶或类圆形。由于膨胀性生长或假包膜形成,边缘多清楚。其它少见的表现有瘤内高密度的新鲜出血、钙化、少量腹水,本组中例数很少。CT对胃肠道间质瘤定位诊断较为准确,主要依据是肿瘤位于胃肠道的走行区,并与肠壁关系密切、互为一体。本组仅1例起源于十二指肠球部的间质瘤,误判位于胃窦部,分析原因为二者位置较近、肿瘤较大且外向生长有关。此例在术前行上消化道钡餐造影检查,明确了位置。由于血供丰富,胃肠道间质瘤增强扫描多明显强化,且持续时间较长,动静脉期峰值区别不大;强化方式有均匀、不均匀及索条状血管样,增强扫描时瘤内密度不均匀更为明显,本组肿瘤外围部分的血管样强化较多见。
3.4 不同危险性CT征象分析 准确判断GIST生物学行为对指导治疗、评估预后有重要作用,但也是目前的一大难题。病理学以前分为良性、恶性、潜在恶性(交界性),恶性指标有肿瘤的转移、浸润,潜在恶性指标有肿瘤大小、坏死、核异性型、细胞密集度等[7]。后研究发现良性肿瘤也可发生转移,目前多认为只要是间质瘤就为潜在恶性。故2001年美国国立卫生研究院(NIH)制定了基于肿瘤大小和核分裂像的生物学行为的四级诊断标准[1],是目前较公认的标准。本组胃肠道间质瘤分为极低及低危组和中高危险组,是基于以下情况:有研究者提倡依据类似特征将GIST分为高危组和低危组[8];二组类似于以前的良性、交界性组与恶性组,生物学差别较大;二组多数情况下有大小为5cm的明确界线。笔者认为,这样分组便于统计学分析,可以把主要的不同危险性区分开来,简单实用。
文献认为,在评价恶性程度的CT征象中,相对公认的指标有肿瘤的大小、强化方式,而肿瘤形态、强化程度的差异则有不同的研究结果。本组资料在极低及低危险组与中高危险组的对比中,肿瘤的大小、密度、形态、强化方式的差异有统计学意义,说明根据以上有意义的指标,可以对胃肠道间质瘤主要不同危险性程度(等同于良性、恶性)进行初步判断。中高危险组(等同于以前认为的恶性)胃肠道间质瘤,表现为肿瘤多直径大于5cm,密度不均匀,形态多不规则,见索条样或血管样强化,以周边为主。因侵犯和转移是肯定性的恶性或高危指标,本组未作对比。极低及低危险组(等同于以前认为的良性和/或交界性)胃肠道间质瘤,表现与上述相反,直径多小于5cm,密度均匀,类圆形,未见索条样或血管样强化。有研究表明[9],GIST直径越大,恶性倾向越明显,与GIST生长过程中c-kit和血小板源性生长因子受体(PDGFRA)基因突变增加有关。出血、坏死、囊变以及空洞、窦道所致的密度不均,不规则甚至分叶状生长,血管样强化,推测可能与肿瘤恶性程度高、细胞生长活跃、肿瘤血管较多有关。
3.5 鉴别诊断 GIST的CT表现主要需与胃癌、淋巴瘤、小肠腺癌、大肠癌、血管瘤、平滑肌瘤和神经鞘瘤鉴别。胃肠道癌病灶起源于粘膜层,胃肠壁局限性或弥漫性不规则增厚,可见腔内或腔外突出的肿块,伴轮廓内溃疡多见,溃疡多不规则,而与腔外肿块相通的深窦道少见,可伴有肠道梗阻。胃癌以胃壁异常增厚为主要表现;小肠腺癌主要发生在十二指肠及空肠,绝大多数向腔内生长,致肠壁增厚、肠腔狭窄,早期即发生肠梗阻;小肠恶性淋巴瘤范围较广,受侵肠壁呈环形增厚,CT示“夹心面包征”和“动脉瘤样肠腔扩张征”,具有特征性,肠系膜淋巴结肿大多见,临床便血少见,与GIST容易鉴别。肠壁血管瘤极少见,部分含静脉石及增强后渐进性强化是其特征。后两者CT不易区别,只能依靠病理免疫组化检查加以鉴别。
综上所述,胃肠道间质瘤CT表现有一定的特点,不同危险性肿瘤的某些CT征象有差异性,对于临床诊断和生物学行为的预测有重要价值;同时诊断时应密切结合消化道易出血、不易引起肠梗阻、常有腹部包块等临床特点。
Reference
1.Fletcher CD, Berman JJ, Corless C, et al.Diagnosis of gastrointestinal stromal tumors: a consensus approach. Hum Pathos, 2002, 33:459-465.
2.Hornick JL, Fletcher CD. Immunohistochemical staining for KIT (CD117) in soft tissue sarcomas is very limited in distribution. Am J Clin Pathol, 2002, 117: 188-193.
3.钟捷, 张晨莉, 马天乐, 等. 双气囊小肠镜与胶囊内镜诊断小肠出血病因比较.中华消化杂志, 2004, 24: 741-744.
4.李健丁, 靳宏星, 武志峰, 主编. 胃肠道间质瘤影像诊断. 人民卫生出版社, 北京,2009, 5(1): 63-68.
Jian-ding LI, Hong-xing JIN, Zhi-feng WU,editors. The imaging diagnosis of gastrointestinal stromal tumor.The People’s Medical Publishing House, Beijing, 2009, 5(1): 63-68.
5.Takao H, Yamahira K, Doi I, et al. Gast rointestinal St romal Tumor of t he Ret roperitoneum: CT and MR Findings. Eur Radiol, 2004, 14 (10): 1926-1929.
6.Tateishi U, Hasegawa T, Satake M, et al.Gastrointestinal stromal tumor correlation of computed tomography findings with tumor grade and mortality. J Comput Assist Tomogr,2003, 27(5): 792-798.
7.Lew in KJ. Gastro intestinal patho logy and its c linical implication. New York,Lgakushoin,1992: 284-341.
8.侯英勇, 朱增雄. 胃肠道间质瘤诊疗新进展.中国现代学术杂志, 2005, 9: 164.
9.M iettinen M, Sobin LH, Laso ta J.Gastrointestinal stromal tumors of the stomach:a clinicopathologic,immunohistoche mical,and molecular genetic study of 1765 cases with long-term follow-up. Am J Surg Pathol, 2005, 29(1): 52-68.
