胃癌CT测量一致性的研究
2010-05-31迟永堃唐磊陈颖李艳玲孙应实张晓鹏
迟永堃 唐磊 陈颖 李艳玲 孙应实 张晓鹏
北京大学临床肿瘤学院 北京肿瘤医院暨北京市肿瘤防治研究所 医学影像科,恶性肿瘤发病机制及转化研究教育部重点实验室,100142,北京
近年来,随着CT扫描技术的不断进步,增强CT已经广泛应用于胃癌的诊断、术前分期、辅助化疗疗效评价等各个方面,成为胃癌患者临床诊治过程中的重要检查手段。
对胃癌CT征象的观察与测量不但有助于诊断与鉴别诊断,而且对准确的临床分期、疗效评价及预后估计具有重要的意义。
胃肠道作为空腔脏器,胃癌癌肿的厚度、范围、浸润深度及强化方式等各影像学参数的测量一直以来存在诸多问题与争议。目前尚无较为准确的,能够为大多数学者公认的统一的测量标准。由于不同测量者之间主观判断不同造成的测量误差是最为突出而亟待解决的问题之一。
本文旨在评价不同阅片者观察同一胃癌癌肿时,观察与测量相关参数的一致性水平,并探讨造成不同阅片者间测量差异的原因。
1 材料与方法
1.1 一般资料 连续收集并回顾性分析2004年1月至2005年3月于北京肿瘤医院医学影像科行腹部增强CT检查的胃癌初诊病例资料。入组标准:(1)所有病人均行根治性手术治疗及淋巴结清扫术。(2)经术后病理证实为胃腺癌的诊断。(3)术前未接受新辅助放化疗等任何治疗。(4)术中及术后病理证实仅存在唯一的胃癌病灶,排除多中心起源的病例。(5)除胃癌病灶外,不存在胃良性溃疡、胃炎、淋巴瘤等其他任何胃部病变。
符合上述标准的入组病例共计50例,其中男性36例,女性14例。年龄22~79岁,平均年龄57.72岁。
胃癌癌肿部位:贲门癌2例,胃体癌13例,胃窦癌30例,累及两个及两个以上部位者5例。病理T分期:pT1期(即早期胃癌,癌肿仅累及粘膜及粘膜下层者)8例,pT2期(癌肿侵及固有肌层或浆膜下层)6例,pT3期(癌肿侵出浆膜层)33例,pT4期(癌肿穿透浆膜层并侵犯邻近脏器)3例。
术后大体病理测量的癌肿范围大小:长径最大值14.0cm,最小值0.1cm,平均值(4.63±3.04)cm;短径最大值10.0cm,最小值0.1cm,平均值(3.30±2.40)cm。另有2例弥漫浸润型胃癌,病理报告中未对癌肿范围进行测量。
1.2 CT扫描方法 所有入组病人的CT检查均采用单排螺旋CT机扫描(Plus 4;Siemens,Erlangen,Germany)。行仰卧位平扫及增强扫描。腹部CT检查前12小时内禁食禁水。如无禁忌证,扫描前5~10分钟肌肉注射盐酸山莨菪碱(654-2)20m g,口服产气剂3g~6g或水300m l~500m l。
常规取仰卧位扫描,首先进行平扫,然后进行增强扫描。采用非离子型碘造影剂100m l,浓度300mg I/m l,以(2~3)m l/s的速度静脉注射,注射后30s~40s开始扫描。两次扫描范围均自膈顶至腹主动脉分叉水平。采用一次屏气法螺旋扫描,电压120 kV~130kV,电流200m A~280m A,层厚5mm,1 转/秒,床速(5~10)mm/s,螺距1~2。重建图像间隔4.9mm。
1.3 图像复阅及分析 重建图像经PACS系统传输至华海MedViewer 3.0数字影像诊断工作站,利用其图像阅读功能,辅以窗宽窗位的调节及局部缩放,对所有入组病例胃癌癌肿的CT影像学征象进行观察;并利用长度、CT值等测量工具,进行相关参数的测量。
由两位放射诊断医师采用独立盲法进行图像复阅及参数测量。记录胃癌癌肿的厚度、浆膜浸润情况、最大层面癌肿范围、癌肿强化方式及门脉期CT值。
1.4 参数测量方法 对于胃癌的CT增强扫描,以门脉期胃壁及癌肿的强化最为明显,故主要用于识别胃癌癌肿的范围及侵犯深度。本研究所涉及的CT相关参数的判读与测量均参考门脉期增强图像。
1.4.1 癌肿厚度 连续观察癌肿所在的各个层面,选取其最大厚度所在层面,测量癌肿最厚处的厚度。如溃疡周围有环堤形成,则厚度测量时需包含环堤的高度。
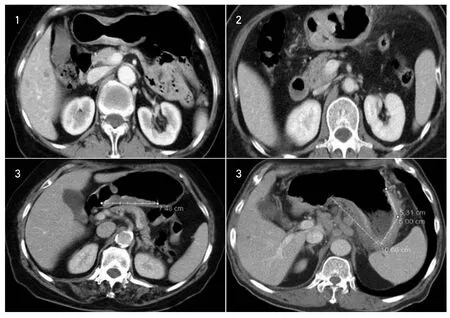
图1 CT判断无浆膜浸润Fig.1 Non-serosal invasion图2 CT判断有浆膜浸润Fig.2 Serosal invasion图3 癌肿范围的测量Fig.3 M easurement of length of the tumor
1.4.2 浆膜浸润情况 对胃壁侵犯深度的判断,本文参考Polkow sk[1]、Habermann[2]和Kim[3]的CT分期方法。T1:局限性胃壁增厚,伴或不伴内层强化,病灶下方有或没有低密度带(此低密度带相当于黏膜下层及肌层);T2:局限性胃壁增厚,强化的病灶突破低密度带或低密度带消失,胃壁浆膜层光滑,周围脂肪间隙清晰或可见絮状影;T3:病变所在胃壁浆膜层与邻近脏器间脂肪间隙模糊;T4:病灶所在胃壁浆膜面毛糙或呈结节状改变,或直接侵犯邻近的组织器官。本研究将癌肿浸润深度简化为对有无浆膜浸润的判断,CT判断无浆膜浸润包括上述的T1和T2,CT判断有浆膜浸润包括上述的T3和T4。(如图1,图2)。
1.4.3 癌肿范围 经连续观察胃癌癌肿所在的各层面后,选取其最大范围所在层面,测量癌肿的最大径线。当癌肿的径线无法以直线测出时,则采用分段测量的方法,将曲线分隔成若干直线线段后分别进行测量,再将测得的各数值相加。(如图3)
1.4.4 癌肿强化方式 参考平扫图像,由观察者主观判断癌肿在门脉期的强化方式。分为均匀强化与不均匀强化两种类型。
1.4.5 癌肿门脉期CT值 选取癌肿最大范围所在层面,将椭圆形ROI置于病灶内部,测量其内的平均CT值。
1.5 数据处理与统计学分析 两位阅片者之间的一致性分析采用Kappa检验。Kappa值大于0代表观察一致性大于机遇所致的一致性,0~0.20为一致性差(poor agreem ent),0.21~0.40为一致性尚好(fair agreem ent),0.41~0.60为中度一致性(moderate agreement),0.61~0.80为高度一致性(good agreement),0.81~1为一致性极高(excellent agreement)[4]。
对于癌肿厚度、范围及门脉期CT值三类连续变量,先对其进行分组,转换为等级资料后,再进行Kappa检验。连续变量同时采用Bland and Altman作图法分析、Spearman相关分析,并计算相关系数r值。按r值大小划分为五级:0.8~1.0为极强相关,0.6~0.8为强相关,0.4~0.6为中等程度相关,0.2~0.4为弱相关,0~0.2为极弱相关或无相关。
所有资料采用SPSS11.5统计软件和M edCalc软件(B land and Altman法)分析,以P<0.05为差异有统计学意义。
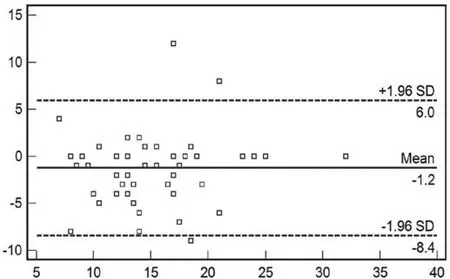
图4 两位阅片者对胃癌癌肿厚度测量均值的Bland and A ltman点图Fig.4 The average of tum or thick of tw o observers (Bland and A ltman)
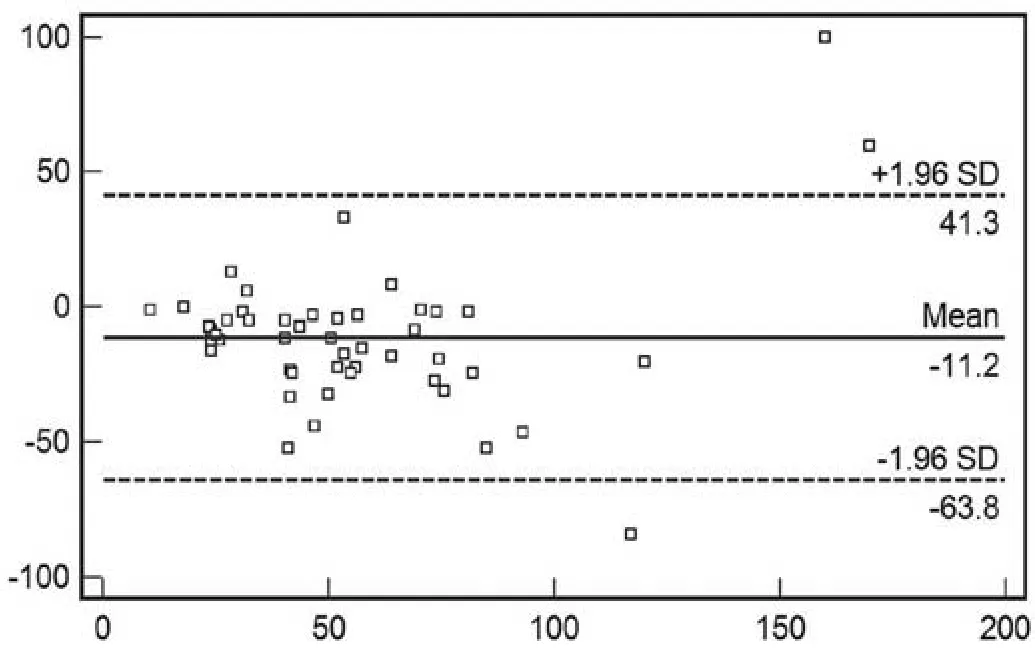
图5 两位阅片者对胃癌癌肿范围测量均值的Bland and A ltman点图Fig.5 The average of tumor length of tw o observers (Bland and A ltman)
2 结果
2.1 癌肿厚度 两位阅片者测得的胃癌癌肿厚度值分别为4mm~32mm(14.24±5.43)mm,5mm~32mm(15.48±5.12)mm。两者一致性检验的K appa值为0.497,为中度一致性(moderate agreement)。
根据B land and A ltman统计方法作图,有3个病例(3/50,6%)分布在95%可接受区间以外,另有2个病例(2/50,4%)分布于可接受区间边缘。癌肿厚度的平均差为-1.2mm,95%的一致性限度为(-8.4~6.0)mm。(如图4)
两位阅片者对癌肿厚度测量的散点图如图1~9所示。相关分析计算得到Spearman相关系数为0.736,为强相关。
2.2 浆膜浸润情况 两位阅片者判断胃癌是否存在浆膜浸润的情况如表1所示,50例入组病例中,判断一致的病例为44例(44/50,88%),不一致病例为6例(6/50,12%)。两者一致性检验的Kappa值为0.735,为高度一致性(good agreement)。
2.3 癌肿范围 两位阅片者测得的癌肿范围分别为10mm~210mm(50.66±38.08)mm,11mm~159mm(61.90±31.97)mm。
根据Bland and A ltman统计方法作图, 有3个病例(3/50,6%)分布在95%可接受区间以外。癌肿范围测量的平均差为-11.2mm,95%的一致性限度为-63.8mm~41.3mm。(如图5)

表1 两位阅片者对胃癌是否存在浆膜浸润的判断Tab.1 Intra-observer agreement of serosal invasion judgm ent on CT scans
为简化行×列表,将癌肿范围较大且差异明显的六个病例去掉后,进行Kappa分析。两者一致性检验的Kappa值仅为0.245,为一致性尚好(fair agreement)。
两位阅片者对癌肿厚度测量的散点图如图1-11所示。相关分析计算得到Spearman相关系数为0.785,为强相关。
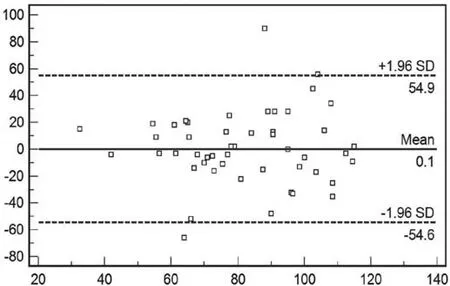
图6 两位阅片者对胃癌癌肿门脉期CT值测量均值的Bland and A ltman点图Fig.6 The average of CT values on portal period of tw o observers (Bland and A ltman)
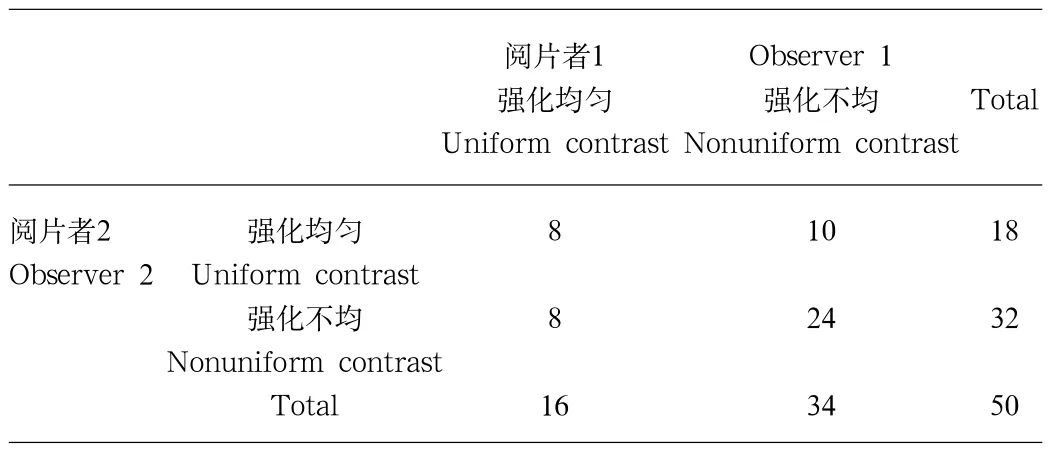
表2 两位阅片者判断胃癌强化方式情况Tab.2 Intra-observer agreement of contrast types on CT scans
2.4 癌肿强化方式 两位阅片者判断胃癌癌肿强化是否均匀的情况如表2所示,50例入组病例中,判断一致的病例为32例(32/50,64%),不一致病例为18例(18/50,36%)。两者一致性检验的Kappa值为0.199,为一致性差(poor agreement)。
2.5 癌肿门脉期CT值 两位阅片者测得癌肿门脉期CT值分别为31HU~133HU(81.96±24.77)HU,25 HU~126HU(81.84±23.12)HU。两者一致性检验的Kappa值仅为0.153,为一致性差(poor agreement)。
根据Bland and A ltman统计方法作图,有3个病例(3/50, 6%)分布在95%可接受区间以外,另有1个病例(1/50,2%)分布于可接受区间边缘。癌肿门脉期CT值的平均差为0.1HU,95%的一致性限度为-54.6HU~54.9HU。(如图6)
两位阅片者对癌肿厚度测量的散点图如图1~12所示。相关分析计算得到Spearman相关系数为0.388,仅为弱相关。
2.6 胃癌癌肿CT征象观察与测量的一致性比较 在胃癌癌肿CT测量的五个参数中,仅有判断是否存在浆膜浸润这一指标的一致性相对较高,两位阅片者的Kappa值为0.735,为高度一致性(good agreement)。癌肿厚度与范围Kappa分析为一致性尚好(fair agreement)。而癌肿强化均匀与否及门脉期CT值为一致性差(poor agreement)。
三个连续变量的相关分析结果显示,两位阅片者对癌肿厚度及范围测量结果为强相关(r>0.7)。而门脉期CT值的测量仅为弱相关(r=0.388)。
3 讨论
目前胃癌临床诊断的三大手段——胃双对比造影、内镜、活检均仅能对胃内情况进行判断,无法了解胃壁全层和壁外情况。而CT图像具有较高的组织对比度和空间分辨率,能够很好地显示胃癌癌肿的内部特征及与周围邻近组织器官的关系,因而被广泛应用于胃癌病人的术前评估[5]。胃癌治疗前癌肿侵犯深度与范围的判断是其术前分期的基础,亦是治疗方法选择、评价预后的重要依据。
胃癌癌肿的CT影像学征象已经被国内外大多数学者及放射科医师所熟悉。但由于胃肠道为空腔脏器,具有其独特之处,加之CT扫描的断层显示特点。这些都为胃癌癌肿的观察与测量增加了一定的难度。在临床化疗评效方面,胃癌癌肿本身一直被认为是不可测病灶而未能列入RECIST评效标准中。
不同阅片者观察测量的一致性分析一直是影像学关注的问题,也是某一影像征象或参数指标能够得以应用的基础。本研究以两位阅片者观察测量同一胃癌癌肿的数据为基础,利用Kappa检验、Bland and Altman法及Spearman相关系数评价两位阅片者间的一致性。
Kappa值是1960年由Cohen等提出的用以作为评价判断的一致性程度的指标。实践证明,它是一个描述诊断一致性较为理想的指标,因此在临床试验中得到广泛的应用。而诊断性试验的评价在医学研究中具有十分重要的意义,目前大多数文献都使用Kappa 统计量来检验其结果的一致性。
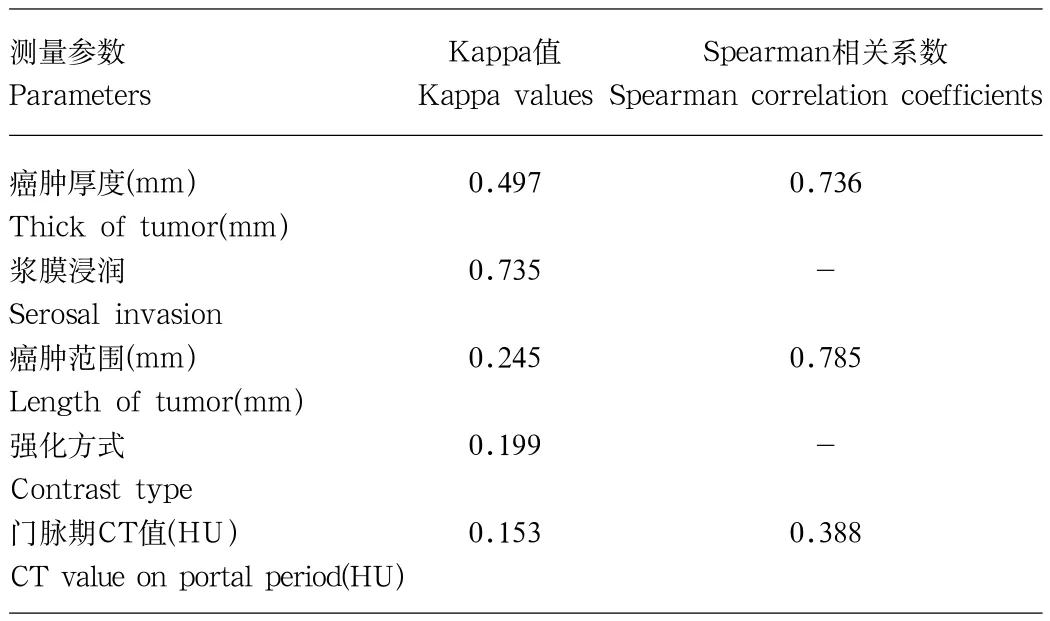
表3 两位阅片者对胃癌癌肿CT征象观察与测量的一致性比较Tab.3 Intra-observer agreement of gastric cancer measurements on CT scans
Bland and Altman 统计方法[6]是Bland与Altman研发的用于评价重复测量数据的统计方法,它主要通过重复数据的均值及差值来绘制点图并计算其95%可接受区间来评价测量数据间的一致性及内部差异性。其结果以点图方式表示具有更加直观的优势,且此方法对连续变量的处理较Kappa检验更为方便准确。故目前被国内外影像学者广泛应用于肿瘤影像测量一致性的评估。
3.1 癌肿厚度 进展期胃癌的增强CT主要表现为胃壁增厚、肿块和局部的异常强化。其中以胃壁的局限性异常增厚最为常见,也是进展期胃癌癌肿CT影像学表现的直接征象。在病理学上,癌肿的厚度可以从一定程度上反应肿瘤侵犯的范围及其生物学行为上的恶性程度。依据临床经验,经新辅助化疗的病例,胃癌癌肿厚度会有不同程度的减小,间接地反映了化疗引起的癌肿病理学上的变化。因此,准确测量胃癌癌肿的厚度对临床分期及疗效判断都很有意义。
但本研究结果显示,在腹部增强CT上测量胃癌癌肿的厚度,其两位阅片者间的Kappa值为0.497,为中度一致性。分析造成阅片者间测量差异的可能原因有:(1)胃是空腔器官,胃腔的充盈程度会直接影响到癌肿厚度在CT图像上的显示。尤其对于T1、T2期的病变,由于肌层可未完全受累,癌肿局部的形态、厚度受胃腔充盈及胃蠕动的影响更大。(2)对于T3、T4期的病人虽然局部癌肿形态相对变化较小,但由于浆膜面受到癌组织的浸润,相应胃壁模糊毛糙,甚至局部的胃周脂肪内可见结节样的突起。在测量时对癌肿厚度边界的把握就存在了一定的困难。(3)癌肿对应部位的胃周转移或增大的淋巴结如果与胃壁粘连在一起,则CT扫描不易区分,也会影响到对癌肿厚度的正确判断与测量。(4)同理,当胃癌侵犯局部脏器,分界不清时,也难以测得准确的癌肿厚度。(5)CT的部分容积效应也会导致对胃癌癌肿厚度的测量,适当采用更薄的层厚有可能减小这一影响。(6)部分病人过于消瘦,胃周脂肪间隙极薄,局部结构显示欠佳,会对癌肿厚度的判断造成困难。
以单排CT测量胃癌的一致性结果并不令人满意。而多排螺旋CT图像重建功能是否能够改善其测量一致性,需要进一步的研究探讨。
3.2 浆膜浸润 本研究结果显示,在胃癌癌肿CT测量的五个参数中,仅有判断是否存在浆膜浸润这一指标的一致性相对较高,两位阅片者的Kappa值为0.735,为高度一致性。
以往关于胃癌癌肿浸润深度的研究大都关注于以CT为手段预测胃癌的病理T分期。本研究借用CT对胃癌T分期的判断标准,将癌肿浸润深度简化为对有无浆膜浸润的判断,并以胃壁外层结节状或不规则增厚、胃周侵犯(周围脂肪间隙见点状、条状影)、邻近脏器侵犯作为存在浆膜浸润的判定标准。
许多学者认为,胃癌CT影像上的浆膜面是指组织学的浆膜及邻近浆膜的肌层组织,浆膜面模糊是判定其是否受侵的直接征象[7,8]。但在CT 判断癌肿是否侵犯浆膜时, 不应仅仅着眼于浆膜面本身的光滑与否,而应将浆膜面的表现与胃周脂肪层的改变结合起来进行综合判定,能进一步提高胃癌侵犯浆膜诊断的准确率[9,10]。本研究综合了上述两方面的影像征象对浆膜的浸润情况进行判断,所得结果说明此判定标准的组间一致性较好,临床应用的可重复性好。但本研究未将浆膜浸润情况与病理结果对照,所以该方法的准确度尚需进一步的研究结果证实。国内一项利用多层螺旋CT判断胃癌浆膜浸润与病理对照的研究结果显示[11]:浆膜面粗糙诊断浆膜面受侵的敏感性、特异性和准确度分别为95.24%、69.70%和79.63%;浆膜外脂肪间隙模糊的敏感性、特异性和准确度分别为71.43%、36.36%和50.00%;浆膜面外结节状突出的敏感性、特异性和准确度分别为23.81%、100.0%和70.37%。国内另一项研究结果得到多层螺旋CT 对胃癌浆膜侵犯、胃周脂肪间隙侵犯及脏器侵犯判断的准确率分别为89.6%、81.8%、93.1%[12]。据此可知,利用腹部增强CT判断浆膜面的受侵情况,较为可靠,可以作为临床评估胃癌局部浸润情况的一个影像学指标。
3.3 癌肿范围 据文献报道,癌肿的大小是影响胃癌患者预后的一个独立因素,且与胃癌的浸润深度密切相关[13-15]。如果能够通过增强CT等影像学手段了解胃癌癌肿的范围,对于预后评估将具有重要意义。但胃作为空腔脏器,加之胃癌癌肿主要表现为胃壁增厚而非实体肿块的生长特点都给影像学评估胃癌的侵犯范围增加了难度。本研究结果也说明对于胃癌癌肿范围测量的一致性不佳,Kappa值仅为0.245,由Bland and Altman点图可知,癌肿范围越大,测量的一致性越差。
对胃癌癌肿范围的判断,最重要的是在CT图像上确认其边界。病变边界的确定除了依靠形态上癌肿与正常胃壁的分界外,胃壁内肿瘤的异常浸润也是重要的参照内容,CT断层图像能够反映病变壁内浸润情况,其缺点在于癌肿边缘癌性浸润与炎性反应难于区分[16]。
胃癌病变与外界相通,癌肿及溃疡本身会受到食物的摩擦,肿瘤组织坏死后容易继发感染而导致局部胃壁炎性细胞的浸润及组织水肿,而肿瘤浸润与周围的炎症反应均表现为胃壁的增厚,其界线无法在增强CT上得以区分而影响了医师的诊断。
胃是一个空腔器官,如果胃腔不能很好地充盈而造成胃壁塌陷,此时就很难将正常的皱襞与增厚的病变区域区分开来。另外,由于CT断层扫描的特点,当胃壁与扫描面平行或呈斜面时,胃壁可出现增厚的假象,且在贲门胃底区和胃窦部尤为明显。这也给病变范围的确定带来了困难。
除癌肿境界判断困难外,在测量方面,尤其对于范围较大的癌肿,不同阅片者对最大层面的选择即存在差异。不同测量者运用分段测量方法的过程中拆分线段方式的不同也影响到了测量的一致性。若能解决诊断工作站曲线长度测量的问题,有可能减小或消除这部分差异,则需要设计出新的测量规范,以期提高一致性水平及准确度。
3.4 癌肿强化情况 依据临床经验及其他学者的文献报道,胃癌癌肿的强化方式与程度的不同,可以从一定程度上反映癌肿的血供情况及其生物学特征,如线状强化的癌肿整体血供不丰富,提示其侵袭力不是很强;而团块状迅速强化表明肿瘤血供丰富;不均匀强化的癌肿强化效应较团块状强化的肿瘤稍慢,部分癌肿延迟扫描有可能呈现团块状强化,推测其侵袭力介于上述两种强化类型之间。因此本研究探讨了胃癌癌肿强化指标的测量一致性水平。
胃癌癌肿强化是否均匀的判断及门脉期CT值的测量一致性均差,Kappa值分别为0.199、0.153。两位阅片者测量CT值的相关系数也仅为0.388,为弱相关。
正常胃壁增强后即表现为高-低-高密度的分层强化;加之胃壁周围结构复杂,缺乏良好的背景密度对比,都会影响阅片者的判断与测量感兴趣区的选取。对于较小的病变,部分容积效应的影响较为明显;而对癌肿范围较大的病例,其强化的均匀程度在各个部分不尽一致,造成阅片者主观判断时更觉模棱两可。胃癌癌肿的强化方式的判断仅凭阅片者的主观判断,并没有量化的诊断标准。门脉期CT值的测量除上述癌肿本身密度差异的影响之外,RO I大小及位置的选择是在不同测量者间引起测得数值差异较大的另一重要原因。
3.5 不足之处 本研究仅针对胃癌癌肿相关CT参数测量的组间一致性进行分析研究,未对同一观察者的测量可重复性进行探讨,未与病理结果进行对照考察各个指标判断与测量的准确性。另外关于癌肿部位、胃腔充盈程度对于CT征象观察及参数测量的影响;多排螺旋CT图像重建功能是否能够改善相关指标的测量一致性;都需要进行进一步的实验设计与研究。
Reference
1.Polkow ski M, Palucki J, W ronska E, et al. Endosonography versus helical computed tomography for locoregional staging of gast ric cancer. Endoscopy, 2004, 36(7): 617-623.
2.Habermann CR, Weiss F, Riecken R, et al.Preoperative staging of gastric adenocarcinoma:comparison of helical CT and endoscopic US.Radiology, 2004, 230(2): 465-471.
3.Kim A Y, Kim HJ, Ha HK. Gastric cancer by multidetector row CT: preoperative staging.Abdom Imaging, 2005, 30(4): 465-472.
4.Landis JR, Koch GG. The measurement of observer agreement for categorical data.Biometrics, 1977, 33(1): 159-174.
5.张晓鹏. 胃肠道CT诊断学. 沈阳, 辽宁科学技术出版社,2001.
Xiao-peng Zhang. CT Diagnostics of The Gastrointestinal Tract. Shen yang, Liaoning Science & Technology Publishing House, 2001.
6.Bland JM, Altman DG. Statistical methods for assessing agreement between two methods of clinical measurement. Lancet,1986, 1(8476):307-310.
7.李健丁, 孙华平, 张耀珍, 等. 多层螺旋CT在进展期胃癌中的应用价值. 中华普通外科杂志, 2002, 10(17): 630-631.
Jian-ding LI, Hua-ping SUN, Yao-zhen ZHANG, et al. Usefulness of multi-detector CT in advanced gastric cancer. Chnese Journal of General Surgery, 2002, 10(17): 630-631.
8.于韬, 罗娅红, 邱岩. 螺旋CT增强扫描对进展期胃癌的局部浸润和淋巴结转移的研究. 中国临床医学影像杂志, 2004, 10(15):573- 577.
Tao YU, Ya-hong LUO, Yan QIU. Study of local invasion and metastases of lymph nodes in advanced gastric carcinoma by contrast enhanced spiral CT. Journal of China Medical Imaging, 2004, 10(15): 573-577.
9.Shim izu K, Ito K, Matsunaga N, et al.Diagnosis of gastric cancer with MDCT using the w ater-filling method and multip lanar reconstruction: CT-histologic correlation. AJR Am J Roentgeno l, 2005, 185(5): 1152-1158.
10.Lim JS, Yun MJ, Kim MJ, et al. CT and PET in stomach cancer: preoperative staging and monitoring of response to therapy.Radiographics, 2006, 26(1): 143-156.
11.于韬, 罗娅红, 邱岩. 进展期胃癌浆膜面浸润的多层螺旋CT增强表现与病理对照研究.中国肿瘤, 2007, 16(12): 1040-1042.
Tao YU, Ya-hong LUO, Yan QIU. A Study of Multi-slice Spiral CT Constrast-enhanced Features Contrast to Patho logic Findings in Advanced Gastric Cancer with Serosal Invasion. Bulletin of Chinese Cancer, 2007,16(12): 1040-1042.
12.陈明旺, 谢琦, 江新青, 等. 胃癌的多层面螺旋CT增强表现及局部侵犯范围的判断.中国中西医结合影像学杂志, 2007, 5(3):187-190.
Ming-w ang CHEN, Qi XIE, Xin-qing JIANG,et al. Enhanced multi-slice CT findings and local invasion judgment of gastric carcinoma.Chinese Imaging Journal of Integrated Traditional and W estern Medicine, 2007,5(3): 187-190.
13.Giuliani A, Caporale A, Di Bari M, et al: Maximum gastric cancer diameter as a prognostic indicator: univariate and multivariate analysis. J Exp Clin Cancer Res, 2003, 22:531-538.
14.Kim DY, Joo JK, Ry u SY, et al.Clinicopathological characteristics of patients with proximal third gastric carcinoma. Acta Chir Belg, 2004, 104: 677-682.
15.Zhan YQ, Sun XW, Li W, et al. Multivariate prognostic analysis in gastric carcinoma patients after radical operation. Ai Zheng,2005, 24: 596-599.
16.郭华, 高剑波, 杨学华, 等. 螺旋CT对胃癌浸润及转移的诊断价值. 临床放射学杂志,2003, 22(8): 684-688.
Hua GUO, Jian-bo GAO, Xue-hua YANG,et al. Evaluation of Helical CT Scanning in Judging the Invasion and Metastasis of Gastric Carcinoma. Journal of Clinical Radiololgy,2003, 22(8): 684-688.
17.郭华, 高剑波, 杨学华, 等. 螺旋CT对胃癌浸润及转移的诊断价值. 临床放射学杂志,2003, 22(8): 684-688.
