尼卡巴嗪混悬液的研制及其对鸡球虫病的疗效*
2010-05-31刘小艳方炳虎杨利军袁照红
刘小艳,方炳虎,邱 电,朱 鑫,杨利军,袁照红
(1.广东大华农动物保健品股份有限公司,广东新兴 527400;2.华南农业大学兽医学院,广东广州 510642)
尼卡巴嗪混悬液的研制及其对鸡球虫病的疗效*
刘小艳1,方炳虎2*,邱 电1,朱 鑫1,杨利军1,袁照红1
(1.广东大华农动物保健品股份有限公司,广东新兴 527400;2.华南农业大学兽医学院,广东广州 510642)
以尼卡巴嗪为原料,纯化水为溶媒,利用胶体磨采用分散法成功研制出尼卡巴嗪混悬液,并对制剂进行了稳定性研究。所有参试样品的外观性状、沉降体积比、再分散性、相对含量等指标均无明显变化,表明该制剂稳定性良好。试验了尼卡巴嗪混悬液对鸡柔嫩艾美耳球虫病的疗效。结果表明,对经口一次人工感染1.0×105个/只柔嫩艾美耳球虫孢子化卵囊的雏鸡按100 kg饮水中分别添加100 g/L尼卡巴嗪混悬液25、50、100 mL的剂量混饮连续给药5 d,其保护率均达100%,抗球虫指数分别为189.7、189.9、184.2,属高效抗球虫药。
尼卡巴嗪;混悬液;研制;柔嫩艾美耳球虫;药效
鸡球虫病是目前危害养鸡业发展的主要疾病之一,是由艾美耳属球虫感染所致,临床表现为血痢、贫血等症状,发病率和死亡率可达80%以上,给养鸡业造成巨大的经济损失[1]。由于球虫疫苗的研究与实际应用尚存在不少问题有待解决,目前防治球虫病仍以药物为主。尼卡巴嗪为4,4′-二硝基均二苯脲(C13H10N4O5)和2-羟基-4,6-二甲基嘧啶(C6H8N2O)的复合物,为黄色或黄绿色粉末,不溶于水[2]。尼卡巴嗪对鸡的多种艾美耳球虫病,均有良好防治效果,其主要抑制第二个无性增殖期裂殖体的生长繁殖,其作用峰期是感染后第4天,球虫对本品不易产生耐药性,对其他抗球虫药耐药的球虫使用本品仍有效[2]。尼卡巴嗪因其自身的良好特点以及价格上的优势,国内外一直广为应用,在日本尼卡巴嗪使用量约占抗球虫剂的50%左右。现应用的剂型为预混剂,剂型单一。尼卡巴嗪混悬液是将难溶于水的尼卡巴嗪,分散在水介质中,并辅以助悬剂、润湿剂等所形成的不均匀分散系的供内服的混悬液体制剂。尼卡巴嗪研制成混悬液以后可以供水饮用,操作灵活,可减少劳动强度,特别是在鸡感染球虫后减料或是不吃料,饮水给药是较好的途径,临床疗效试验表明,本制剂可显著提高临床应用效果。本试验采用分散法研制尼卡巴嗪混悬液并进行临床试验,为了客观、科学地评价尼卡巴嗪混悬液对鸡球虫病的治疗效果,根据农业部《实验临床实验技术规范》(试行)要求进行了人工诱发鸡柔嫩艾美耳球虫病的药效研究。
1 材料与方法
1.1 材料
1.1.1 药品和试剂 尼卡巴嗪原料为浙江升华拜克生物股份有限公司生产,检验合格;尼卡巴嗪对照品购自中国兽医药品监察所(批号为H0331005),C13H10N4O5含量为 99.0%,C6H8N2O含量为99.9%;250 g/kg尼卡巴嗪预混剂为广东大华农动物保健品股份有限公司动物保健品厂生产;羧甲基纤维素钠为湖州展望药业有限公司生产;甘油为江苏淮安淮阴医药有限责任公司生产;纯化水自制;其他所用试剂均为分析纯。
1.1.2 主要仪器 德国赛多利斯CP225D-电子天平;温州七星乳品设备厂JM-LB80型胶体磨岛津UV-2450PC紫外可见分光光度计,LHH-150GSP型综合药品稳定性试验箱。
1.1.3 试验动物、饲料以及供试卵囊 从广东某大型孵化场购买1日龄新兴黄5号鸡苗,饲养于无球虫环境中,14日龄时镜检粪便中无球虫卵囊后分组进行试验;订购的饲料不含任何抗球虫药,饮用洁净的自来水;临床分离纯种柔嫩艾美耳球虫孢子化卵囊,由华南农业大学兽医学院寄生虫病教研室保存,用前复壮。
1.2 方法
1.2.1 尼卡巴嗪混悬液的制备 采用分散法[3-6]研制尼卡巴嗪混悬液。以纯化水为溶媒,添加合适的助悬剂、湿润剂、抗氧化剂、防腐剂等,利用胶体磨充分研磨配制成成品,并考察其外观性状、沉降体积比、易再分散性、pH、含量等项目,选择各指标最佳者进行稳定性试验研究。
1.2.2 尼卡巴嗪混悬液中尼卡巴嗪的含量检测方法
1.2.2.1 测定波长的选择 根据文献[7-8]质量标准中含量测定方法进行。
取本品(供试样品)适量(约相当于尼卡巴嗪0.1 g),置 100 mL容量瓶中,加二甲基甲酰胺80 mL,置超声波中超声15 min,冷却,用二甲基甲酰胺稀释至刻度,摇匀,滤过,弃去初滤液,精密量取续滤液5 mL,置500 mL量瓶中,加乙醇稀释至刻度,摇匀。精密量取10 mL,置25 mL容量瓶中,精密加10 mL/L乙醇制氢氧化钾溶液5 mL,用乙醇稀释至刻度,摇匀。用分光光度法测定,5 min内在360 nm~560 nm波长范围之间扫描,记录吸收曲线。另取尼卡巴嗪对照品、按生产处方配制的不含主药的空白对照样品,同法测定,并记录吸收曲线。
1.2.2.2 标准曲线的建立 尼卡巴嗪标准储备液:取105℃干燥至恒重的尼卡巴嗪对照品0.1 g,置100 mL量瓶中,用二甲基甲酰胺溶解并定容至刻度,即成1.0 mg/mL的尼卡巴嗪标准储备液。分别精密量取标准储备液适量,用乙醇稀释成2、6、10、14、18、22、26 μ g/mL 的系列标准溶液。分别精密量取10 mL,置25 mL容量瓶中,精密加入10 mL/L乙醇制氢氧化钾溶液5 mL,用乙醇稀释至刻度,摇匀。用分光光度法测定,在5 min内读取被测溶液在430 nm波长处的吸收度。
1.2.3 尼卡巴嗪混悬液稳定性试验方法 依据《中华人民共和国兽药典》2005年版一部附录中《兽药稳定性试验指导原则》进行加速试验[9]。供试品适量,棕色药用玻璃瓶密封包装,放置于 LHH-150GSP型综合药品稳定性试验箱(温度30℃±2 ℃,相对湿度60%±5%)6个月。于第1、2、3、6个月末分别取样一次,对样品的性状、沉降体积比、再分散性、含量等进行检测。
1.2.4 尼卡巴嗪混悬液对人工诱发鸡柔嫩艾美耳球虫病的疗效试验
1.2.4.1 分组与处理 将14日龄试验雏鸡逐只称重后,选择个体体重差异小的健康鸡,随机分成6组,其中中剂量的药物试验组为250只,其余各组50只[10]。第1、2组分别为不给药不攻虫对照组(即阴性对照组)和感染不给药对照组(即阳性对照组);第3、4、5组分别为试验药物由高到低剂量组,药物浓度为每100 kg水中添加100 g/L尼卡巴嗪混悬液分别为100、50、25 mL,感染后第 3天开始给药,连续饮水给药5 d;第6组为药物对照组,按每吨饲料添加250 g/kg尼卡巴嗪预混剂400 g拌料应用,感染后第3天开始,连续拌料给药5 d[2]。
1.2.4.2 攻虫与记录 除阴性对照组(即第1组)外,各试验组每只雏鸡在分组当天嗉囊灌服柔嫩艾美耳球虫孢子化卵囊1.0×105个。试验期间,每天观察记录鸡的精神、饮食欲、血便情况和死亡数等。感染后第5、6、7天早晨对各组进行血便记分。第8天各组分别逐只称重后剖杀全部鸡,观察盲肠病变,并进行盲肠内卵囊计数。
1.2.4.3 疗效评价指标
(1)症状观察。每天观察、记录鸡群的饮食欲、精神状态。
(2)增重情况。于试验开始及结束时分别测称每组中每只鸡的体重,并由此算出平均增重和相对增重率[11-13]。相对增重率=(试验组增重率/不感染不用药对照组增重率)×100%。
(3)粪便检查。每天观察、记录粪便的变化情况,并作血便记分。具体标准参照文献[13]的方法进行:0分为无血便;1分为血便比例少于25%;2分为25%~50%的粪便带血;3分为50%~75%的粪便带血;4分为多于75%的粪便带血。
(4)死亡情况。记录鸡死亡数,剖检观察确定死因,由此计算出存活率。
存活率=(试验组鸡总数-试验期间因球虫感染死亡鸡数量)/试验组鸡总数×100%。
(5)盲肠病变记分。参照病变记分法进行病变记分,并将病变记分换成病变值[11-12,14]。病变值=病变记分×10。于感染后第8天宰杀全部鸡,剖检观察盲肠病变(两侧盲肠病变不一致时以严重一侧为准),按4分制进行病变记分。
0分为无肉眼可见病变;1分为盲肠壁有少量散在出血点或出血斑,肠壁不增厚,有正常肠内容物;2分为出血点或出血斑数量增多,肠内容物明显带血,肠壁略增厚,有正常肠内容物;3分为盲肠腔内有大量血液或出现盲肠芯(血凝块或灰白色干酪样香蕉型块状物),盲肠壁极度增厚,盲肠腔没有或仅有少量的盲肠粪便;4分为因出血量多和干酪样盲肠芯大,盲肠极度扩张,盲肠腔内没有粪便或粪便已被包在肠芯中。剖检证实为球虫死亡鸡,记为4分。
(6)卵囊值。刮取盲肠内容物用100 g/L次氯酸钠消化15 min后,用血球记数并换算出每对盲肠中的卵囊数值[11-12,15]。每对盲肠中卵囊数值和卵囊值之间的换算关系见表1。
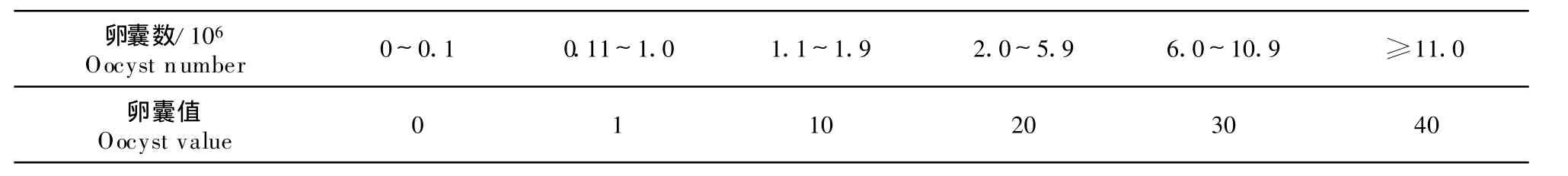
表1 卵囊数和卵囊值的转换Table 1 The conversion of oocyst number and oocy st value
(7)耗料情况。记录各组耗料量和总增重,由此算出料肉比。
(8)抗球虫指数。抗球虫指数(anticoccidial index,ACI)[11-12]:按照美国默克(Merck)公司的计算公式,即ACI=(相对增重率+存活率)×100-(病变值+卵囊值)
药物效果判定标准:抗球虫指数>180者为高效;160~180者为中效;<160者为低效;<120者为无效。
2 结果
2.1 尼卡巴嗪混悬液的研制
经过大量的处方筛选及稳定性试验,以羧甲基纤维素钠作为助悬剂,甘油作湿润剂,并添加适量的抗氧化剂等,以纯化水为分散媒介利用胶体磨采用分散法制备100 g/L的尼卡巴嗪混悬液,制得的成品稳定、均匀细腻、再分散性良好。
2.2 尼卡巴嗪混悬液中尼卡巴嗪的含量检测
2.2.1 检测波长的确立 按照分光光度法测定,在360 nm~560 nm波长范围之间扫描记录色谱图。
结果表明,按生产处方配制的不含主药的空白对照样品经与供试样品、对照品同样处理后在360 nm~560 nm波长范围扫描空白对照样品几乎无吸收,供试样品、对照样品在430 nm波长处有最大吸收峰,并结合参考文献资料,选定430 nm波长作为尼卡巴嗪的测定波长(图1)。
2.2.2 尼卡巴嗪含量测定的线性范围及回归方程
制备的尼卡巴嗪几个不同浓度梯度测定结果表明,以吸光度作为纵坐标(y),以浓度(x)为横坐标,得回归方程:y=0.087x+0.009,r=0.999 9,在0.8 μ g/mL ~10.4 μ g/mL 范围内 ,吸光度与浓度呈良好的线性关系。
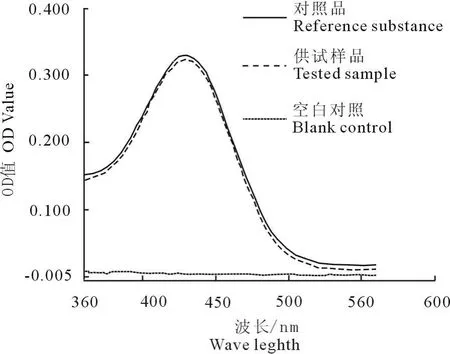
图1 尼卡巴嗪吸收曲线Fig.1 Absorption spectrum curve of nicarbazine
2.3 尼卡巴嗪混悬液的稳定性
加速试验结果表明,制得的100 g/L尼卡巴嗪混悬液颜色与颗粒等性状、沉降体积比、再分散性、相对标示含量等各项指标均无显著变化。制剂的性状、颗粒、颜色、再悬性、沉降体积比等指标未见变化,表明混悬稳定性良好[16]。以上表明本制剂在棕色药用玻璃瓶密封包装下比较稳定。
2.4 对人工诱发鸡柔嫩艾美耳球虫病的疗效试验
2.4.1 症状观察 攻虫感染后第4天,不给药对照组出现少量血便,鸡发病明显,表现精神沉郁,食欲减退,但没有鸡死亡。第5天开始时,攻虫不给药组血粪严重,试验鸡开始死亡;第6天时血便逐渐减少,未见死亡。攻虫不给药组共死亡14只鸡,剖检死鸡见盲肠明显肿大,内有大量血液。
对照药物尼卡巴嗪预混剂组没有出现死亡,但部分鸡精神状态差及饮食减少,有少量血粪。尼卡巴嗪混悬液低剂量组有若干鸡精神状态差及饮食减少,未出现血粪和鸡死亡。尼卡巴嗪混悬液中、高剂量组采食和饮水正常,精神状态良好。
2.4.2 药物疗效评价 结果表明,尼卡巴嗪混悬液中剂量治疗组未出现血便、存活率为100%,相对增重率为 97.9%。盲肠未见卵囊,其抗球虫指数(ACI)达189.9,明显优于对照的尼卡巴嗪预混剂组。尼卡巴嗪混悬液高剂量100 mg/L组的抗球虫效果与50 mg/L剂量组效果差异不显著(表2)。

表2 几组药物抗Eimeria tenella的效果Table 2 The efficacy of several groups of anticoccidial drugs against Eimeria tenella
从结果来看,尼卡巴嗪混悬液除低剂量组于感染后第5天出现少量的血便外,其中中剂量组和高剂量组均未出现血便,表明药物的使用对死亡、增重、病变及卵囊产生都有显著的改善。
3 讨论
3.1 关于制剂的研制
影响药物混悬性能的主要因素是药物粒径的大小和分散介质的性能,在混悬剂中添加适量的助悬剂,使药物容易分散和减缓颗粒沉降[17]。药物粒径越小,分散介质的黏度越大,药物沉降越缓慢[18]。本制剂中的助悬剂采用羧甲基纤维素钠为辅料,利用胶体磨研磨采用分散法制得的产品均匀细腻、沉降缓慢稳定好、易再分散,还有利于延缓药物的释放。
3.2 关于制剂中尼卡巴嗪的测定
本文建立了以选定430 nm波长作为尼卡巴嗪的分光光度法测定波长。在测定时,因尼卡巴嗪混悬液长期放置后,颗粒沉降,溶液即分层,故称量前必须充分摇匀,且溶液黏稠不便于直接量取,应经过测定相对密度后进行换算。
3.3 关于对人工诱发鸡柔嫩艾美耳球虫病的疗效试验
本试验中感染不给药组有28%的试验鸡因感染球虫死亡,试验期的相对增重率仅为75.3%。盲肠病变值为3.55,卵囊值为20,ACI为91.8。说明本试验攻虫剂量合适,适宜用做抗球虫药物的效果评价[19]。
本次试验结果表明,尼卡巴嗪混悬液的高、中、低剂量组的抗球虫指数均超过184以上,显示具有良好的抗球虫效果,其效果优于对照药物尼卡巴嗪预混剂(抗球虫指数为183.2),同时表明鸡在感染球虫后采食量下降,饮水给药是较好的途径。就各单项指标而言,各药物组都有轻微病变出现,但病变值均明显低于不给药对照组,平均增重和相对增重率也明显提高。除低剂量组盲肠检出少量卵囊,其他用药组的盲肠中均没有检出卵囊。
结果表明,尼卡巴嗪混悬液按50 mg/L~100 mg/L(以尼卡巴嗪计算)饮水给药适宜用于临床鸡球虫病的治疗。
[1]曾明华,张祝明,凌英济.尼卡巴嗪和氨丙啉单独及配合应用对鸡球虫病的疗效[J].中国兽医寄生虫病,2007,15(3):18-21.
[2]中国兽药典委员会编.兽药使用指南:化学药品卷[M].北京:中国农业出版社,2006:154-155.
[3]张洪波.多潘立酮混悬液含量稳定性研究[D].天津:天津大学化工学院,2004.
[4]方炳虎,时书宁.氟苯尼考混悬注射液的研制及含量测定[J].中国兽药杂志,2009,43(2):9-15.
[5]史同瑞,许腊梅,于万才,等.土霉素混悬剂的研制及药物质量指标测定[J].现代畜牧兽医,2005(10):9-11.
[6]党晓林.复方盐酸头孢噻呋混悬剂的研制及药物动力学研究[D].四川雅安:四川农业大学,2008.
[7]中华人民共和国农业部.兽药质量标准:2003年版[S].
[8]中华人民共和国农业部.进口兽药质量标准:1999年版[S].
[9]中国兽药典委员会.中华人民共和国兽药典:2005年版[S].
[10]农业部兽药评审委员会办公室.兽药试验技术规范汇编[Z].北京:农业部兽药评审委员会,2001.
[11]王芝英,陈佳林,朱迎春,等.几种药物的联合使用对堆型艾美耳球虫的疗效及耐药性试验[J].中国兽医寄生虫病,2007,15(2):1-4.
[12]李 驰,刘明春,李阳,等.四种抗球虫药物对鸡柔嫩艾美耳球虫(沈阳株)的敏感性试验[J].黑龙江畜牧兽医,2008(12):70-71.
[13]索 勋,蔡建平.禽球虫病[M].北京:中国农业出版社,2004:20-25.
[14]Johnsan J,Reid W H.Anticoccidial drugs:lesion scoring techniques in battery and floorpen experiments with chichens[J].Exp Parasitol,1970,28:30-36.
[15]角田清.鸡球虫病[M].上海:上海科学技术文献出版社,1986:87-93.
[16]Wilson C G,Washington N,Greaves J L,et al.Bimodal release of ibuprofen in a sustained-release:A scintig raphicand pharmacokinetic open study in healthy volunteers under different conditions of food intake[J].Int J Pharmaceutics,1989,50:155-161.
[17]Saano V,Paronen P,Peura P,et al.Pharmacokinetics of two 200mg ibuprofen film-coated tablets and an effervescent tablet[J].Drug Dev Ind Pharmacy,1992,18(4):491-497.
[18]Giannini E H,Brewer E J,Miller M L,et al.Ibuprofen suspension in the treatment of juvenile rheumatoid arthritis[J].J Pediat,1990,117(4):645-652.
[19]Holdsworth P A,Conway D P,McKenzie M E,et al.Word association forthe advancementofveterinary parasitology(WAAVP)guidelines fo revaluating the efficacy of anticoccidial drugs in chickens and turkey s[S].Vet Parasitol,2004,121(3-4):189-212.
Study on Preparation of Nicarbazine Suspension and Its Efficacy onEimeria tenella
LIU Xiao-yan1,FANG Bing-hu2,QIU Dian1,ZHU Xin1,YANG Li-jun1,YUAN Zhao-hong1
(1.Guandong Dahuahong Animal Health Products Co.,L td,Xinxing,Guangdong,527400,China;2.College of Veterinary Medcine,South China Agricultural University,Guangzhou,Guangdong,510642,China)
Nicarbazine suspension was developed successfully by using colloidmill to suspend the nicarbazine in purified water.The nicarbazine concent of preparation samples was determined by spectrophotometry.The preparation was carried on a stability experiment.At the end of the test,all programs,such as color,the ratio of settling volume,redispersibility,content,had no significant changes.The experimental results indicated that the suspension was stable.The anticoccidial efficacy of 100 g/L nicarbazine suspension was studied in chicks artificially infected withEimeria tenellaof 1.0×105orally per chick.Results demonstrated that 100 g/L nicarbazine suspension administrated at 25,50 and 100 mL/100 kg water in chicks for 5 days provided excellent protection againstE.tenella,with protective rate of 100%.The experiment indicated that nicarbazine suspension is a highly effective anticoccidal drug.Anticoccidal indexes of the drug at 25,50 and 100 mL/100 kg water were 189.7,189.9 and 184.2,respectively.
nicarbazine;suspension;preparation;Eimeria tenella;efficacy
S852.723;S859.79
A
1007-5038(2010)02-0065-05
2009-06-25
刘小艳(1975-),女,湖南衡阳人,硕士,主要从事兽药制剂与添加剂产品开发研究。*通讯作者
