混合型肾盂尿路上皮细胞癌伴鳞状上皮癌3例报道
2010-05-28潘东亮饶小松那彦群
潘东亮 饶小松 那彦群
北京大学首钢医院泌尿外科,*病理科,北京100144
混合型肾盂尿路上皮细胞癌伴鳞状上皮癌3例报道
潘东亮 饶小松*那彦群
北京大学首钢医院泌尿外科,*病理科,北京100144
肾盂; 癌; 尿路上皮; 鳞状
在肾盂输尿管肿瘤中,尿路上皮细胞癌占90%以上,鳞状上皮癌占0.7%~7%[1]。曾有结核肾中肾盂鳞状上皮癌与肾细胞癌并发的个例[2],但同时具有尿路上皮细胞癌和鳞状上皮癌两种成分的混合型肾盂癌则迄今未见报道,其发病原因不明确。本研究介绍3例混合型肾盂尿路上皮细胞癌伴鳞状上皮癌患者的诊治过程,并分析其临床特点。
1 资料和结果
1.1 临床资料 患者均为男性,2例来自北京、1例来自辽宁,分别于2009、2004和2007年因左侧腰痛血尿寒热、排尿费力和无痛性全程血尿就诊,均通过患肾切除后由我院病理科确诊。术后通过电话预约检查和治疗。
1.2 病例1 男性,56岁。因左侧腰痛3 d、血尿伴寒战高热2 h入院。患者于就诊前3 d前出现左侧腰部持续性钝痛,不伴尿急尿频尿痛,未处理。2 h前突发寒战、高热,自测体温39.2 ℃,随后出现无痛性全程血尿,伴小血块,有排尿费力和尿痛、尿频症状。既往30年前行阑尾炎手术;糖尿病史10余年,应用胰岛素治疗;半年前因脑梗死在我院神经内科治疗后痊愈,现在服用硝苯地平、肠溶阿司匹林等药物。其岳母和儿子曾患肺结核。查体:体温37.8 ℃。左侧肾区叩击痛阳性。肛诊前列腺Ⅱ大,质韧、平滑,无触痛。入院后急诊胸片未发现异常;尿常规显示白细胞3/HPF、红细胞满视野;血常规显示白细胞13.3×109/L,中性粒细胞89%。给予环丙沙星静滴,心电图、感染项目、大便常规正常,C-反应蛋白、CA199、CA242升高。尿抗酸杆菌和细胞学检查阴性。彩超显示左肾中极实质回声欠均匀,似见中等偏强回声区,范围约2.8 cm×2.5 cm,CDFI未见明确血流信号,左侧集合系统分离1.3 cm;右肾及输尿管无异常;膀胱右后壁见多发微小突起,CDFI未见明确血流信号。CT平扫显示左肾体积稍增大,左肾后唇边缘可见线性高密度影;增强扫描动脉期见中上极造影剂充盈明显延迟,平衡期中上极可见多个斑片状低强化区,边缘模糊,分泌期呈明显低密度影;左肾盂内见一软组织密度结节影,平扫CT值28 Hu,最大径约16 mm,增强扫描轻度强化;左侧肾盂及输尿管起始部管壁增厚,管腔狭窄,增强扫描呈中重度强化(图1A);右肾及输尿管、膀胱、前列腺、精囊无异常,印象为左侧肾盂软组织结节并肾实质异常灌注区:疑黄色肉芽肿性肾盂肾炎。肾动态显示左肾中部一个放射性减淡区,左肾GFR:21.01 mL/min,右肾GFR:35.13 mL/min。静脉肾盂造影:左肾盂输尿管未显影。膀胱镜检见膀胱右侧、前、后壁多发苔藓样隆起,表面呈灰色;膀胱肿物活检及膀胱壁随机活检;左侧输尿管内插入F4导管26 cm,无尿液引出,注入12.5%泛影葡胺后显示左肾下盏正常、中盏和上盏及部分肾盂未显影。膀胱活检组织病理为黏膜慢性炎症伴部分移行上皮轻度不典型增生。输尿管镜检未发现左侧输尿管异常,肾盂输尿管连接部狭窄致输尿管镜未能进入肾盂。科内讨论初步诊断左侧黄色肉芽肿性肾盂肾炎,给予抗炎治疗2周后复查尿常规正常,CT平扫显示左肾体积增大,肾周筋膜增厚,肾周脂肪密度增高,肾实质局部密度不均,肾盂内见一类圆形软组织密度影;增强后肾盂结节及肾实质低强化;与前CT片比较病变范围扩大(图1B);考虑肾盂癌侵犯肾实质及输尿管可能性大。行根治性左肾输尿管全长切除术,术中见左肾及肾周脂肪质硬,与周围组织粘连,分离易出血;肾门淋巴结未见肿大;术后剖开肾脏见暗红色肿物填塞肾盂(图1C);标本病理报告肾盂结节型浸润性移行上皮癌伴鳞状上皮癌(图1D)及大量坏死,癌侵及肾盂全层,穿透肾被膜达肾脂肪囊,侵至肾窦内脂肪组织,癌旁肾组织呈重度慢性炎改变,免疫组织化学染色:34βE12(+)、Ki-67(20%+)。术后第21天突发胸闷行胸片检查发现广泛肺转移,腹部CT显示广泛手术区及腹腔转移;第26天出现持续高热,第35天衰竭死亡。
1.3 病例2 男性,70岁。因反复排尿费力50余年入院。患者13岁时被狗咬伤阴茎后出现排尿费力,先后行2次尿道内切开术和多次尿道扩张后效果不稳定,现无尿痛尿急和发热症状。入院后排泄性尿路造影显示右侧肾盂充盈缺损,大小约3 cm×4 cm;双侧输尿管和左侧肾盂、膀胱无异常;尿道外口及距尿道外口13 cm处尿道狭窄。腹部CT平扫显示双肾体积和外形无异常,右侧肾盂内见一软组织密度结节影,平扫CT值32 Hu,最大径约35 mm,增强扫描轻度强化;肾周和腹主动脉、下腔静脉旁无肿大淋巴结;左肾输尿管膀胱无异常;前列腺体积增大,密度较均匀;精囊无异常。肾动态显示左肾GFR:26.32 mL/min,右肾GFR:20.11 mL/min。尿常规、尿细菌培养和尿细胞学检查阴性;血常规、血生化、胸片无异常。全麻下截石位行尿道外口扩张至F24后,再行经尿道内尿道狭窄部冷刀切开术,留置F24号尿管;改为左侧卧位,行右侧肾输尿管全长切除;术后剖开患肾,见肾盂内暗红色肿物,表面颗粒状突起。病理报告为右侧肾盂混合型鳞状上皮癌及移行上皮癌。术后1个月开始行术区放疗,术后2个月拔除尿管。术后9个月胸片显示双侧肺转移,术后15个月去世。
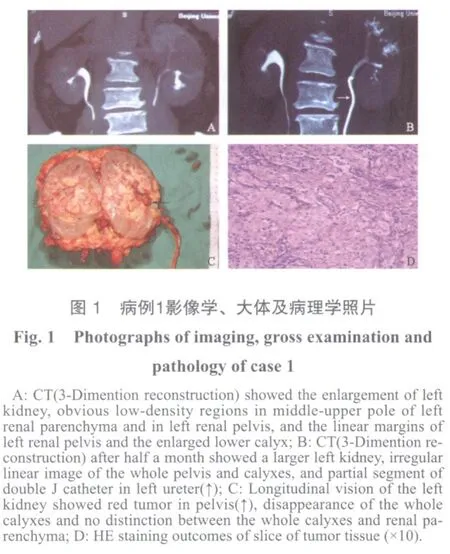
1.4 病例3 男性,59岁。因无痛性全程肉眼血尿5 d入院。尿中无血块,无尿急尿频尿痛和发热。入院后查体无阳性体征,尿常规显示红细胞满视野、白细胞2-3/HPF,尿细胞学检查阴性。彩超显示双肾形态无异常;左肾盂内低等偏中回声区,范围约4.3 cm×3.5 cm,CDFI见少许血流信号,局部与肾实质分界欠清;左侧肾上中盏扩张;右肾、双侧输尿管膀胱无异常;前列腺回声欠均匀,2.8 cm×3.6 cm×4.1 cm;印象:左肾盂占位。静脉肾盂造影显示左侧肾盂充盈缺损,边缘毛糙,大小约3.5 cm×4.0 cm;左肾上中盏杯口消失,显影延迟;左肾下盏、双侧输尿管和右侧肾盂、膀胱显影良好、无异常。腹部CT平扫显示双肾形态无异常,双肾周间隙清楚;左侧肾盂内见一软组织低密度结节影,平扫CT值21Hu,最大径约42 mm,增强扫描后边缘轻度强化;结节中部向外似侵及肾实质;三维重建后显示左肾上中盏扩张积水;腹主动脉、下腔静脉旁无肿大淋巴结;右侧肾、双侧输尿管和膀胱无异常;前列腺体积增大,密度较均匀;精囊无异常。肾动态显示左肾GFR:33.15 mL/min,右肾GFR:40.08 mL/min。血常规、血生化、胸片无异常。全麻下行左侧输尿管肾盂镜检发现左侧肾盂内暗灰色肿物、部分表面溃烂和血痂;退出输尿管镜后即行左侧肾盂输尿管全长切除,术中见左侧肾窦部粘连,未发现局部淋巴结肿大。标本病理为肾盂移行细胞癌伴鳞状细胞癌,癌细胞侵及肾中部实质,肾被膜、肾周脂肪和肾窦部无癌细胞浸润。术后第8周行左侧术区放疗,总量50 Gy;患者因惧怕化疗不良反应而拒绝全身化疗,接受膀胱内灌注盐酸吡柔比星30 mg/(次·周)×8次;每3个月复查1次。术后半年膀胱镜检发现膀胱内单发细蒂肿物,经尿道肿物电切后标本病理为高级别移行细胞癌,再次行膀胱内灌注盐酸吡柔比星一个疗程。继续复查至1年时,发现肺部广泛转移灶,随即应用MVAC方案全身化疗,化疗中每周复查胸片未见转移灶改善,于首次术后第14个月死亡。
2 讨 论
在组织学上,混合型肾盂尿路上皮细胞癌伴鳞状上皮癌需与肾盂尿路上皮细胞癌伴鳞状上皮分化鉴别,因为两者预后完全不同。如果尿路上皮细胞癌中的鳞状上皮是良性成分,则诊断为尿路上皮细胞癌伴鳞状上皮分化,鳞状上皮分化在尿路上皮细胞癌病例中较常见,可达50%[3],但在预后上无特殊意义[4]。如果鳞状上皮为恶性成分,诊断为尿路上皮细胞癌伴鳞状上皮癌。混合型肾盂癌中鳞状上皮癌成分的形态学和分化程度与单纯肾盂鳞状上皮癌无差异,均常为中或低分化,易侵润临近组织。
术前确诊依赖输尿管肾盂镜下组织活检。本组临床资料显示血尿仍是此类混合型肾盂癌的最常见症状和就诊原因;与单纯肾盂尿路上皮细胞癌相比,其影像学检查亦主要显示肾盂占位,但是此混合型肾盂癌与肾实质、肾周组织分界不清,难以与肾细胞癌侵犯肾盂、黄色肉芽肿性肾盂肾炎区别;所以术前选择输尿管肾盂镜活检是必要的,操作时宜以软性输尿管肾盂镜为主,因为此类肾盂癌易侵犯输尿管起始部,造成输尿管管壁变硬而使硬镜无法通过,病例1即是如此。不宜使用经皮细针穿刺活检术,因为例1显示术后同侧广泛腹膜后、皮下、切口种植,高度提示此类肾盂癌有随侵袭性操作而种植转移的倾向。
进展快、易微转移、综合治疗效果不佳、预后差是其临床特点。本组3例均于术前证实无转移灶,但是术后12个月内出现广泛转移,说明此类肾盂癌易出现微转移。本病例1因故时隔2周复查CT比较,发现患肾体积及肾盂病变比前CT片病变范围增大近1/3。另外3例患者均于术后短期内发现广泛转移而衰竭死亡的现象,提示其进展快和预后差。对于此类混合型肾盂癌,由于发病罕见,尚无明确的治疗方案可参考,暂且借鉴肾盂尿路上皮细胞癌和尿路鳞状上皮癌的治疗方法,即包括手术切除、放化疗在内的综合治疗,其中化疗可采取MVAC方案或吉西他滨+顺铂方案。然而本组资料显示除病例1未来得及放化疗外,病例2和3均行术后放疗,例3亦在发现肺转移后随即全身化疗,但是均在术后不久死亡,提示上述综合方案对此类混合型肾盂癌治疗效果不佳。增加新辅助化疗是否能改善预后,则需要病例积累和进一步观察。
综上所述,混合型肾盂尿路上皮细胞癌伴鳞状上皮癌进展快、易微转移、综合治疗效果不佳、预后差,术前确诊依赖输尿管肾盂镜下组织活检。
[1]Edward M, Messing MD. Urothelial tumors of the urinary tract[M]// Walsh PC, Retik AB, Vaughan ED, et al. Campbell’s Urology. 8th ed. Philadelphia, PA: WB Saunders Company,2002: 2732.
[2]Al-Assiri M, Al-Otaibi MF, Sircar K, et al. Renal pelvis squamous cell carcinoma in a tuberculous kidney[J]. Sci World J, 2004, 4(11): 965-968.
[3]Harnden P, Southgate J. Cytokeratin 14 as a marker of squamous differentiation in transitional cell carcinomas[J].J Clin Pathol, 1997, 50(12): 1032-1033.
[4]张长淮, 刘丽娜. 肾盂肿瘤[M]//夏同礼. 现代泌尿病理学. 北京: 人民卫生出版社, 2002: 182-184.
R737.11
A
1007-3639(2010)04-0316-03
那彦群 E-mail:nayanqun@cuan.cn
2010-01-06
2010-03-02)
