蛋白4.1家族在不同乳腺癌细胞株中的表达与定位
2010-05-28闫红霞时晓芳孔超郭欢高艳锋祁元明汲振余陈鲤翔安秀丽康巧珍
闫红霞 时晓芳 孔超 郭欢 高艳锋 祁元明汲振余 陈鲤翔 安秀丽 康巧珍
郑州大学生物工程系,河南 郑州 450001
蛋白4.1家族在不同乳腺癌细胞株中的表达与定位
闫红霞 时晓芳 孔超 郭欢 高艳锋 祁元明汲振余 陈鲤翔 安秀丽 康巧珍
郑州大学生物工程系,河南 郑州 450001
背景与目的:目前,已在多种人类肿瘤中发现蛋白4.1家族成员表达异常。本研究旨在通过检测蛋白4.1家族成员(4.1R/B/G/N)在3株转移能力不同的人乳腺癌细胞株MCF-7、T-47D和MDA-MB-231中的表达和定位,探讨蛋白4.1家族成员与乳腺癌细胞转移能力之间的关系。方法:采用Western blot检测蛋白4.1家族成员在MCF-7、T-47D和MDA-MB-231细胞中的表达;免疫荧光标记对蛋白4.1家族成员在3株细胞中的表达进行定位。结果:4.1R/B/G在3种细胞系中均有表达,在T-47D细胞中的表达量均明显高于在MCF-7细胞中的表达量(P<0.05);但在高转移性的MDA-MB-231细胞中它们的表达水平转而下降。4.1N在T-47D细胞中的表达量明显低于在MCF-7细胞中的表达量(P<0.01),而在MDA-MB-231细胞中的表达则几乎检测不到,提示4.1N表达下调或缺失与乳腺癌细胞转移能力密切相关。4.1R/B/G/N在MCF-7和T-47D细胞中均主要定位于细胞膜及胞间连接处,同时4.1B在细胞核中也有表达;而在高转移的MDA-MB-231细胞中蛋白4.1家族成员均定位于细胞质中,提示蛋白4.1家族成员亚细胞定位的改变可能是乳腺癌细胞转移过程中的重要事件。结论:4.1N表达缺失和蛋白4.1家族成员亚细胞定位的改变与乳腺癌细胞MDA-MB-231的高转移性密切相关。
蛋白4.1; MCF-7; T-47D; MDA-MB-231; 转移
2 结 果
2.1 Western blot检测蛋白4.1家族成员在乳腺癌细胞中的表达 检测结果提示,蛋白4.1R/B/G在3种乳腺癌细胞中均有表达。其中,4.1R在MCF-7细胞和T-47D细胞中存在2种形式,相对分子质量分别约为100×103和80×103,而在MDA-MB-231细胞中只有相对分子质量80×103蛋白表达;4.1B的相对分子质量约为60×103;4.1G除了在3株细胞中都有一条相对分子质量约为72×103的蛋白表达外,在低转移性的MCF-7细胞中还检测到了一条相对分子质量约为100×103的蛋白表达。蛋白4.1N在MCF-7和T-47D细胞中均有表达相对分子质量约为100×103,而在MDA-MB-231细胞中基本不表达(图1)。
灰度扫描结果显示,4.1R、4.1B和4.1G在T-47D细胞中的表达均显著高于在MCF-7细胞中的表达量(P<0.05),但在MDA-MB-231中的表达量下降。其中,4.1R在MDA-MB-231中的表达与MCF-7细胞相比,差异无统计学意义;4.1B和4.1G在MDA-MB-231中的表达则呈现出相反结果,分别高于和低于在MCF-7细胞中的表达(P<0.05)。4.1N在T-47D细胞中的表达急剧下降(P<0.01),而在MDA-MB-231细胞中的表达则几乎完全缺失(图2)。
2.2 免疫荧光法检测蛋白4.1在乳腺癌细胞中的表达定位
2.2.1 4.1R在转移能力不同的3种乳腺癌细胞中的表达定位 4.1R 在MCF-7细胞中主要表达在细胞膜上及细胞-细胞间连接处,细胞质不表达;在T-47D细胞中也定位于细胞膜上及细胞-细胞间连接处;而高转移性MDA-MB-231细胞中主要表达在细胞质中,细胞核中不表达(图3A)。


2.2.2 4.1B在转移能力不同的3种乳腺癌细胞中的表达定位 在MCF-7和T-47D细胞中,4.1B主要定位在细胞-细胞间连接处、细胞质膜上,甚至细胞核上、细胞质中也可见少量表达;在MDA-MB-231细胞中则主要表达在细胞质中,细胞核内不表达(图3B)。
2.2.3 4.1G在转移能力不同的3种乳腺癌细胞中的表达定位 4.1G在MCF-7细胞中主要表达在细胞质膜和细胞-细胞间连接处;在T-47D细胞中主要定位在细胞膜上,细胞质中也有少量表达;而在MDA-MB-231细胞中主要表达在细胞质,细胞核中不表达(图3C)。
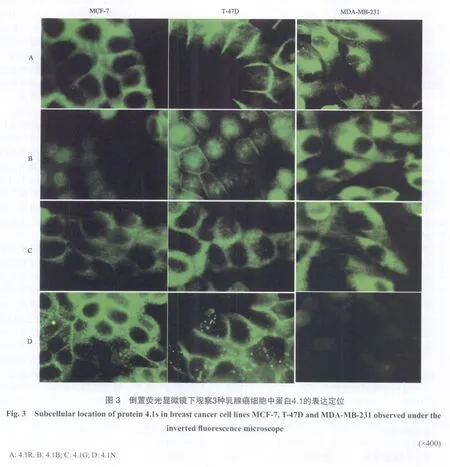
2.2.4 4.1N在转移能力不同的3种乳腺癌细胞中的表达定位 在MCF-7和T-47D细胞中4.1N主要定位于细胞膜附近,在高转移细胞MDAMB-231细胞中仅可在胞质部分观察到非常微弱的表达信号,这与Western blot的检测结果一致(图3D)。
3 讨 论
肿瘤转移是一个复杂的连续的多步骤过程,包括因肿瘤细胞间黏附能力的降低而从原发位置的脱落、癌细胞对细胞外基质和基膜的降解与破坏、细胞骨架重构引起的细胞运动与侵袭转移,最后在继发位点形成新的克隆。作为细胞骨架成分的蛋白4.1家族在保持细胞与细胞,细胞与基质间的相互作用以及细胞骨架的组织构成方面有重要作用,并且细胞黏附作用和相关信号的转导也受到连接细胞膜和细胞骨架的蛋白4.1的影响,提示蛋白4.1的表达和定位可能与肿瘤的转移具有相关性。
目前,已在脑膜瘤[11]、室管膜瘤[12]、食管小细胞癌[13]、非小细胞肺癌[14]、肺小细胞癌[15]和结直肠癌[16]等多种肿瘤组织中发现蛋白4.1表达水平的下调或缺失。而且,蛋白4.1家族成员之一4.1B已被证实为一种肿瘤抑制因子,其可与CD44结合,参与正常细胞的生长和增殖调控[9]。在乳腺癌细胞株MCF-7中,外源4.1B的表达已被证实可以增加细胞和细胞外基质的黏附性[10]。因此,探讨蛋白4.1的表达和定位与乳腺癌细胞转移能力的关系具有重要意义。
本研究中,4.1R/B/G在3种细胞系中均有表达,而且在T-47D细胞中的表达均显著高于在MCF-7细胞中的表达(P<0.05),但在MDAMB-231细胞中的表达转而下降。尤其值得注意的是4.1N表达水平的变化——随着肿瘤细胞转移能力增加4.1N表达水平显著降低,甚至在高转移的MDA-MB-231细胞中几乎检测不到4.1N蛋白的表达。本实验室前期研究表明,4.1N蛋白表达下调或缺失是结肠组织恶变的早期事件。而且,在结肠癌RKO细胞中过量表达外源性4.1N蛋白能抑制细胞增殖[17]。上述结果提示4.1N蛋白可能是乳腺癌转移的抑制因子。目前,本实验室拟进一步研究4.1N蛋白与乳腺癌细胞运动、增殖之间的关系,为探索乳腺癌发病、转移机制的研究提供依据。
特别值得重视的是,本研究中蛋白的亚细胞定位均表现出随乳腺癌细胞转移能力增强而从细胞膜转移到细胞质的现象,尤其是4.1R和4.1G蛋白在转移能力不同的乳腺癌细胞中亚细胞定位的不同,提示蛋白4.1的亚细胞定位可能与肿瘤细胞的转移能力相关。目前4.1G蛋白已被证实与肿瘤的发生和发展相关。Rajaram等[12]研究发现,4.1G蛋白在室管膜瘤中的表达缺失比例达到41%。另外,Terada等[18]研究报道,采用免疫细胞化学方法检测发现,鼠输精管中4.1G 定位于滋养层细胞,沿细胞膜分布,与钙黏素(cadherin)共定位,说明4.1G在细胞黏附中起作用,可介导滋养层细胞和精细胞间的黏附。本研究中4.1G蛋白在不同转移力乳腺癌细胞中表达位置的不同说明,4.1G的定位可能与乳腺癌细胞的黏附/转移能力相关。
4.1R是目前研究较多的蛋白4.1家族成员之一。Huang等[19]研究发现在72 例神经细胞瘤中有14例发生4.1R基因的突变,沉默或序列改变。Victoria等[11]证实,4.1R可以与介导细胞迁移和黏附的CD44分子相互作用。由于CD44分子和肿瘤抑制因子merlin的相互作用已被证实介导了来自细胞外基质的生长抑制信号的转导,研究者推测4.1R可能通过与肿瘤抑制因子merlin相似的方式来发挥抑制肿瘤细胞增殖的功能。另一研究发现,在4.1R的FERM结构域中存在2个肿瘤坏死因子受体p55结合位点,一个是由外显子10编码的有51个氨基酸的肽段,另一个是由外显子5编码的有35个氨基酸的肽段。而且,后者的缺失可使4.1R完全丧失膜定位能力[20]。因此,MDA-MB-231细胞中4.1R蛋白定位是在细胞质中,可能意味着其未能与介导异质性黏附的CD44分子、肿瘤坏死因子受体p55等相互作用,从而使细胞黏附能力降低、来自细胞外基质的信号的传导被阻断,成为导致 MDA-MB-231细胞高转移能力的关键原因。
可调控的可变剪接是蛋白4.1基因家族基因表达的一个基本特征,转录本的可变剪接可能产生多种4.1蛋白的异构形式[3]。本研究中在MCF-7细胞中检测到2条4.1G蛋白条带可能就是可变剪接产生的2种异构形式。因此,在高转移的MDA-MB-231细胞中较大4.1R蛋白和较大4.1G蛋白的缺失以及蛋白4.1定位的改变提示,蛋白4.1的转录调控机制和可变剪接调控机制可能发生了变化,与细胞膜定位相关的关键外显子可能被剪除并导致了蛋白4.1亚细胞定位的改变。此外,蛋白的翻译后修饰,如磷酸化,是影响蛋白4.1亚细胞定位的另一可能原因。因此,蛋白4.1细胞膜定位影响因素的分析、蛋白4.1膜定位与乳腺癌细胞转移能力关系的探讨将是本实验室下一步研究的重要内容。
综上所述,笔者认为4.1N表达缺失和蛋白4.1定位于细胞质与乳腺癌细胞MDA-MB-231的高转移能力密切相关。进一步深入研究4.1N表达水平的改变及蛋白4.1细胞定位的改变对乳腺癌细胞MDA-MB-231转移能力的影响及其作用机制将有助于阐明乳腺癌发生、转移相关的分子机制。
[1]Hoover KB, Bryant PJ. The genetics of the protein 4.1 family:organizers of the membrane and cytoskeleton[J]. Curr Opin Cell Biol, 2000, 12(2): 229-234.
[2]胡晓燕, 周严, 袁建刚, 等. 蛋白4.1基因家族的研究进展[J]. 生物化学与生物物理进展, 2001, 28(3): 290-294.
[3]Takakuwa Y. Protein 4.1, a multifunctional protein of the erythrocyte membrane skeleton: structure and functions in erythrocytes and nonerythroid cells[J]. Int J Hematol,2000, 72(3): 298-309.
[4]Tran YK, Bögler O, Gorse KM, et al. A novel member of the NF2/ERM/4.1 superfamily with growth suppressing properties in lung cancer [J]. Cancer Res, 1999, 59(1): 35-43.
[5]Gutmann DH, Donahoe J, Perry A , et al. Loss of DAL-1, a protein 4.1-related tumor suppressor, is an important early event in the pathogenesis of meningiomas [J]. Hum Mol Genet, 2000, 9(10): 1495-1500.
[6]Heller G, Geradts J, Ziegler B, et al. Down regulation of TSLC1 and DAL-1 expression occurs frequently in breast cancer [J]. Breast Cancer Res Treat, 2007, 103(3): 283-291.
[7]Wong SY, Haack H, Kissil JL, et al. Protein 4.1B suppresses prostate cancer progression and metastasis[J]. Proc Natl Acad Sci USA, 2007, 104(31): 12784-12789.
[8]Yamada D, Kikuchi S, Williams YN, et al. Promoter hypermethylation of the potential tumor suppressor DAL-1/4.1B gene in renal clear cell carcinoma [J]. Int J Cancer,2006, 118(4): 916-923.
[9]Cavanna T, Pokorná E, Veselý P, et al. Evidence for protein 4.1B acting as a metastasis suppressor [J]. J Cell Sci, 2007,120(Pt 4): 606-616.
[10]Charboneau AL, Singh V, Yu T, et a1. Suppression of growth and increased cellular attachment after expression of DAL-1 in MCF-7 breast cancer cells [J]. Int J Cancer, 2002,100(2):181-188.
[11]Victoria AR, Li W, Philippe G, et al. Identification of a third Protein 4.1 tumor suppressor, protein 4.1R, in meningioma pathogenesis [J]. Neurobiol Dis, 2003, 13(3): 191-202.
[12]Rajaram V, Gutmann DH, Prasad SK, et al. Alterations of protein 4.1 family members in ependymomas: a study of 84 cases [J]. Mod Pathol, 2005, 18(7): 991-997.
[13]高艳锋, 祁元明, 宋英, 等. 食管小细胞癌组织中4.1蛋白家族的表达及意义[J]. 山东医药, 2008, 48(15): 41-42.
[14]Kikuchi S, Yamada D, Fukami T, et a1. Promoter methylation of DAL-l/4.1B predicts poor prognosis in non-small cell lung cancer [J]. Clin Cancer Res, 2005, 11(8): 2954-2961.
[15]高艳锋, 翟明霞, 宋英, 等. 肺小细胞癌组织中4.1蛋白家族的表达[J]. 郑州大学学报, 2008, 43(4): 651-653.
[16]Ohno N, Terada N, Murata S, et al. Immunolocalization of protein 4.1B/DAL-1 during Neoplastic transformation of mouse and human intestinal epithelium [J]. Histochem Cell Biol, 2004, 122: 579-586.
[17]冯文坡, 陈鲤翔, 寇晓丹, 等. 细胞骨架4.1蛋白基因家族在结肠癌组织中的表达[J]. 世界华人消化杂志, 2007,15(22): 2436-2441.
[18]Terada N, Ohno N, Yamakawa H, et al. Immunohistochemical study of a membrane skeletal molecule, protein 4.1G, in mouse seminiferous tubules [J]. Histochem Cell Biol, 2005,124(34): 303-311.
[19]Huang S, Lichtenauer UD, Pack S, et al. Reassignment of the EPB4.1 gene to 1p36 and assessment of its involvement in neuroblastomas [J]. Eur J Clin Invest, 2001, 31(10): 907-914.
[20]Pil-Soo S, Jeong JJ, Zeng LX, et al. Alternatively spliced exon 5 of the FERM domain of protein 4.1R encodes a novel binding site for erythrocyte p55 and is critical for membrane targeting in epithelial cells [J]. Biochim Biophys Acta,2009, 1793(2):281-289.
Expression and subcellular location of protein 4.1 in breast cancer cells with different metastatic capability
YAN Hong-xia,SHI Xiao-fang,KONG Chao,GUO Huan,GAO Yan-feng,QI Yuan-ming,JI Zhen-yu,CHEN Li-xiang,AN Xiu-li,KANG Qiao-zhen(Department of Bioengineering, Zhengzhou University, Zhengzhou Henan 450001, China)
KANG Qiao-zhen E-mail:qzkang@zzu.edu.cn
Background and purpose:Currently, the abnormal expression of protein 4.1 family has been noticed in several human cancers. This study aimed to investigate the correlation between the protein 4.1 family and the different metastatic capabilities of breast cancer cell lines by detecting the expression and subcellular localization of protein 4.1 family members (4.1R/B/G/N).Methods:Western blot and immunof l uorescence were used to detect the expression and subcellular location of protein 4.1 family members (4.1R/B/G/N) in breast cancer cell lines MCF-7, T-47D and MDA-MB-231.Results:Protein 4.1 family members 4.1R/B/G were detectable in 3 kinds of breast cancer cells. Their level of expression increased significantly in T-47D (P<0.05) but declined in MDA-MB-231 with high metastasis. It is important to note that there was a very significant decline in the 4.1N expression levels in T-47D(P<0.01), so significant that it was undetected in MDA-MB-231. This fi nding suggests a correlation between the level of expression of 4.1N and the metastatic capability of breast cancer cells. In addition, proteins 4.1R/B/G/N were mainly targeted in the membrane and cell to cell junction in MCF-7 and T-47D cells, while at the same time, 4.1B is located at the nucleus. However, all of them were only visible in the cytoplasm in MDA-MB-231. Hence, the change of protein 4.1’s subcellular location may be an important event in breast cancer cell metastasis.Conclusion:The absence of 4.1N and the change of protein 4.1’s subcellular location are both closely related to the high metastatic capability of breast cancer cell line MDA-MB-231.
蛋白4.1家族的发现起始于4.1R,是从人红细胞中分离获得的一种膜骨架蛋白,随后又在哺乳动物细胞中发现了3种与4.1R有很高同源性的蛋白,分别是4.1G、4.1N和4.1B,它们的典型特征是都具有3个高度保守的结构域,FERM(4.1,Ezrin,Redixin,Moesin)、SABD(spectrin-actin binding domain)和CTD(C-terminus domain),并通过这些结构域与多种蛋白相互作用[1]。对蛋白4.1家族进行的早期研究证实,蛋白4.1在维持细胞形态中发挥重要作用,可以增强细胞骨架中spectrin与actin的相互作用,还可在spectrin-actin骨架与跨膜蛋白之间发挥连接作用[2]。随着蛋白4.1家族与众多跨膜蛋白之间的相互作用不断得到证实,越来越多的研究显示蛋白4.1家族可能参与了细胞的生长调控[3]。同时,许多临床报道表明蛋白4.1在多种肿瘤中表达缺失,如在肺癌、脑膜瘤、乳腺癌和前列腺癌等多种肿瘤中发现了4.1B的缺失[4-9],4.1R和4.1G也被证实参与脑部肿瘤的发生[10-11]。
本研究选取3株转移能力不同的乳腺癌细胞为实验材料。其中,MCF-7是一种雌激素受体阳性的、低侵袭低转移的乳腺癌细胞,T-47D是一种雌激素受体阳性的、具有中度转移能力的乳腺癌细胞,而MDA-MB-231则是一种雌激素受体阴性的、具有高侵袭性高转移性的乳腺癌细胞。通过检测蛋白4.1家族成员在这3种细胞系中的表达及定位,分析其与乳腺癌细胞转移能力的关系,为寻找新的与乳腺癌转移相关的基因和蛋白标志物、研究乳腺癌转移相关的分子机制奠定前期实验基础,为抑制乳腺癌转移提供新的治疗靶点。
1 材料和方法
1.1 细胞株及主要试剂 人乳腺癌细胞株MCF-7、T-47D和MDA-MB-231购自美国典型菌种保藏库(American Type Culture Collection,ATCC),并由本实验中心保藏。
兔抗人多克隆抗体(anti-4.1R19、anti-4.1BU2、anti-4.1GHP和 anti-4.1NHP)由美国纽约血液中心Dr. Xiuli An 惠赠;GAPDH抗体购自英国Abcam公司;辣根过氧化物酶标记的羊抗兔(二抗)为Jackson immuno Research公司产品;Alexa 488荧光标记驴抗兔二抗购自Invitrogen公司;蛋白质定量试剂盒(BCA Protein Assay Kit)购自北京奥博森公司;ECL发光试剂盒购自Thermo公司;显影液和定影液购自北京普莱茵公司;细胞培养液DMEM及其添加剂购自Gibco公司。
1.2 方法
1.2.1 细胞培养 人乳腺癌细胞株MCF-7、T-47D和MDA-MB-231培养于含有10%新生牛血清的DMEM培养液中(pH7.2~7.4),置于 37 ℃、CO2体积分数为5%的条件下培养,0.25%胰蛋白酶消化细胞传代,并取对数生长期的细胞进行实验。
1.2.2 Western blot检测蛋白4.1在乳腺癌细胞中的表达 分别收集对数生长期的3种细胞,用预冷的蛋白裂解液裂解细胞后,按说明书操作提取细胞总蛋白,行10%SDS-PAGE分离蛋白,电泳结束后即行后60 V硝酸纤维素膜转膜2 h,以含5 %脱脂奶粉的TBST溶液封闭转移膜2 h,加入用封闭液稀释的一抗4.1R/B/G/N(稀释浓度分别为1∶1 000、1∶1 500、1∶1 000和1∶500),置于摇床上,4 ℃反应过夜。充分洗膜后,加入辣根过氧化物酶标记的二抗(1∶5 000稀释)37 ℃反应1 h,充分洗膜,最后ECL显色,暗室内曝光显影。以GAPDH蛋白为内参同时检测。以上实验重复3次,并做灰度扫描,计算获得蛋白相对表达量。
1.2.3 免疫荧光检测 8孔细胞培养板中接种1×104~5×104个/孔细胞,待其生长至70%~80%融合度时取出,PBS洗涤细胞3次,1% PFA(免疫细胞固定液)固定细胞15 min,再用0.25% PFA、0.1%Triton-100配制的通透液处理细胞15 min,用含10%马血清(杭州四季青生物工程材料有限公司)的封闭液封闭细胞30 min,加入一抗4.1R/B/G/N(稀释浓度分别为,1∶2 000、1∶2 000、1∶1 000和1∶1 000)反应1 h,PBS洗涤细胞3次各10 min,最后加入荧光标记驴抗兔二抗(1∶700稀释)反应40 min,PBS再洗涤细胞3次各3 min,荧光显微镜下观察细胞并拍照成像。
1.3 统计处理 采用SPSS 13.0 统计软件进行
protein 4.1; MCF-7; T-47D; MDA-MB-231; metastasis统计学分析,计量资料用表示,组间比较用单因素分析,以P<0.05为差异有统计学意义。
R737.9
A
1007-3639(2010)05-0338-06
国家自然科学基金(项目编号:NO.30972707);国家大学生创新性实验计划项目(项目编号:091045922)。
康巧珍 E-mail:qzkang@zzu.edu.cn
2009-12-28
2010-02-09)
