PHⅡ-7对人乳腺癌多药耐药细胞MCF-7/ADR体外杀伤活性和逆转耐药作用
2010-05-28师锐赞张秀丽杨铭张砚君彭洪薇任思楣林阳刘荣李崴熊冬生
师锐赞 张秀丽 杨铭 张砚君 彭洪薇 任思楣林阳 刘荣 李崴 熊冬生
1.中国医学科学院血液学研究所药物室,天津 300020;2.山西医科大学药理学教研室,山西 太原 030001
PHⅡ-7对人乳腺癌多药耐药细胞MCF-7/ADR体外杀伤活性和逆转耐药作用
师锐赞1,2张秀丽1杨铭1张砚君1彭洪薇1任思楣1林阳1刘荣1李崴1熊冬生1
1.中国医学科学院血液学研究所药物室,天津 300020;2.山西医科大学药理学教研室,山西 太原 030001
背景与目的:多药耐药(multidrug resistance,MDR)是恶性乳腺癌化疗失败的主要原因,而ABC转运蛋白家族的P-glycoprotein(P-gp)高表达是MDR的主要机制之一。因此研制能抑制P-gp表达及其功能的新型抗癌药是目前研究的热点。本研究旨在研究PHⅡ-7对人乳腺癌多药耐药细胞MCF-7/ADR体外抗瘤活性及逆转耐药的作用。方法:采用MTT法检测PHⅡ-7、多柔比星(adriamycin,ADR)及二者联合应用对人乳腺癌细胞MCF-7和耐药细胞株MCF-7/ADR的IC50值;采用流式细胞仪测定PHⅡ-7对MCF-7及MCF-7/ADR细胞凋亡的诱导作用;采用逆转录PCR和实时荧光定量PCR方法检测PHⅡ-7对多药耐药基因1(multidrug resistance gene 1,mdr1)表达水平的影响;通过流式细胞仪观察PHⅡ-7处理前后,MCF-7/ADR细胞内Rhodamine123浓度的改变,分析PHⅡ-7对P-gp外排功能的影响。结果:PHⅡ-7对MCF-7和MCF-7/ADR细胞均有生长抑制作用,IC50值分别为(6.07±0.85)和(5.51±1.22)μmol/L;低浓度PHⅡ-7与ADR联合应用能增强其细胞毒作用,二者具有协同作用。PHⅡ-7可诱导MCF-7和MCF-7/ADR细胞凋亡;在诱导凋亡过程中,PHⅡ-7可降低MCF-7/ADR细胞内mdr1基因的表达,抑制P-gp外排功能。结论:PHⅡ-7可诱导MCF-7/ADR凋亡,并具有对MCF-7相同的体外杀伤活性。PHⅡ-7可通过抑制P-gp的表达和功能逆转MCF-7/ADR耐药性。
PHⅡ-7; 多药耐药; mdr1; P-gp; 逆转耐药
乳腺癌是危害妇女健康的主要恶性肿瘤之一,发病率居女性肿瘤第二位。化疗在乳腺癌的综合治疗中起着不可替代的作用,而多药耐药性(multidrug resistance,MDR)是导致乳腺癌化疗失败的重要原因[1]。在未经治疗的乳腺癌病例中,耐药比例可高达 50%,且该比例在治疗过程中还会不断升高,并可达75%。由于多药耐药导致化疗失败并由此引起的复发和转移,限制了肿瘤的有效治疗。克服MDR的方法之一是使用逆转剂。目前的逆转剂多在体外实验中有效,在人体上则因血药浓度尚未达到有效逆转浓度时已产生严重不良反应而无法应用于临床[2]。维拉帕米(verapamil)是应用最早的MDR逆转剂之一,但其不良反应严重限制了其临床应用,因此,寻找高效、低毒,作用靶点广,逆转作用显著的肿瘤多药耐药逆转剂刻不容缓。
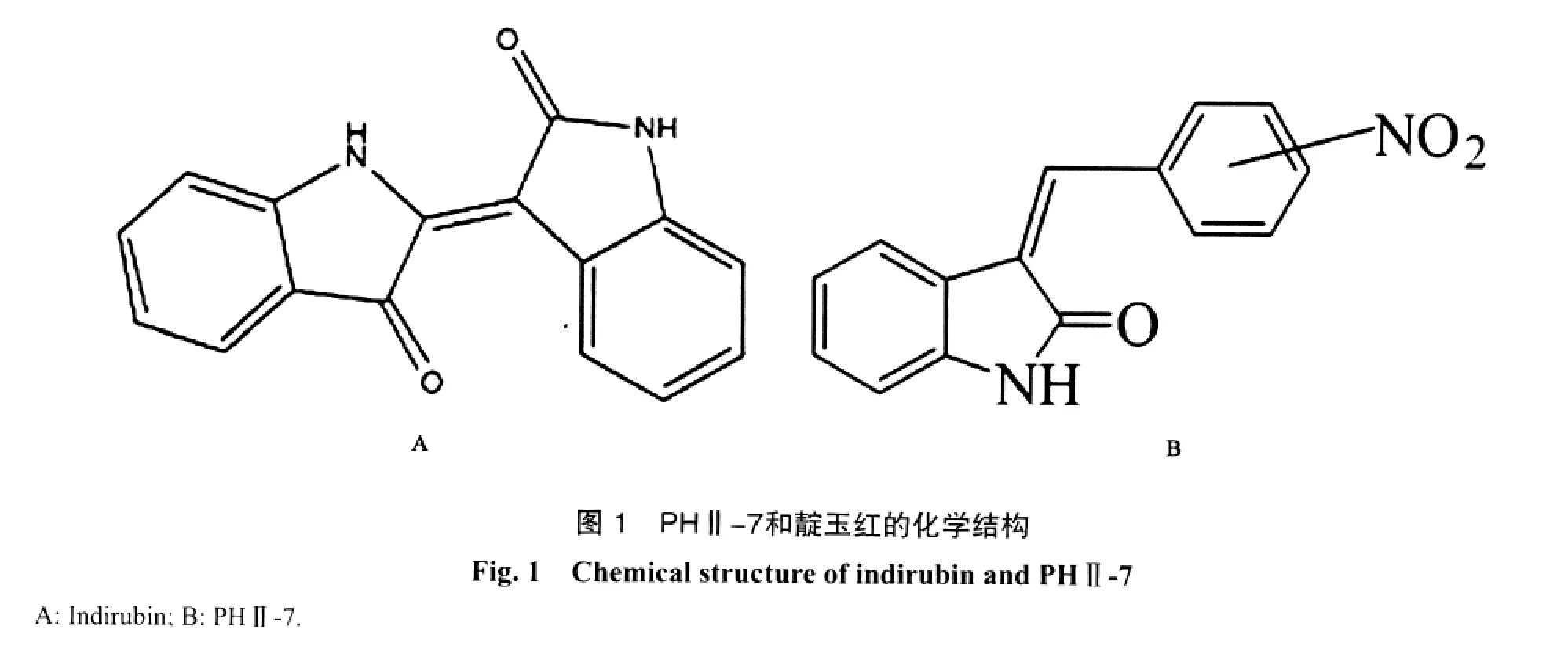
本研究所用PHⅡ-7是本研究室以靛玉红为模板而设计合成的具有较高抗肿瘤活性且不良反应较低的一种3-取代基氧化吲哚化合物(图1)。PHⅡ-7经体外研究证实除对人乳腺癌细胞具有较强杀伤作用外,对其多药耐药细胞MCF-7/ADR则具有耐药逆转的作用。应用现代分子生物学技术,对其杀伤及逆转作用进行了初步探讨。因此,本研究以维拉帕米作为阳性对照药物,衡量PHⅡ-7的逆转作用。
1 材料和方法
1.1 材料
1.1.1 药物和试剂 PHⅡ-7由本实验室合成,溶于DMSO中,配制成1 mg/mL贮存液,使用时用0.9%的NaCl溶液稀释至所需浓度。RPMI 1640购于Gibco BRL公司;新生牛血清由中国医学科学院血液学研究所保存;维拉帕米、MTT和多柔比星(adriamycin,ADR)购自Sigma公司;Annexin V/PI凋亡试剂盒购自BD公司;TRIzol试剂购自美国Invitrogen公司;实时荧光定量PCR所用 SYBR®Premix Ex TaqTM 购自TaKaRa公司。
1.1.2 细胞培养 人乳腺癌细胞(MCF-7)和多柔比星诱导的耐药细胞系(MCF-7/ADR)由本研究室培养传代,采用10%新生牛血清的RPMI 1640培养液,在37 ℃、CO2体积分数为5%的饱和湿度的培养箱中培养。MCF-7/ADR细胞高表达P-gp蛋白。为维持其耐药性,在细胞培养过程中,向MCF-7/ADR细胞的培养液中加入1 μg/mL的ADR,实验前2周撤药。
1.2 方法
1.2.1 MTT法测ADR、PHⅡ-7体外抗肿瘤活性 各取细胞密度为2.5×104个/mL的对数生长期MCF-7和MCF-7/ADR细胞,接种于96孔培养板中,每孔180 μL,24 h后加入20 μL不同浓度的ADR(0~350 μmol/L)和PHⅡ-7(0~15 μmol/L),对照孔加入20 μL 0.9%NaCl溶液。继续培养72 h,向每孔加入20 μL MTT,避光温育4 h后,弃上清液,每孔加入200 μL DMSO,振荡混匀后于酶标仪上波长546 nm处测吸光度。实验重复3次计算平均半数抑制浓度(50% concentration of inhibition,IC50值),并计算耐药倍数(resistant fold)。耐药倍数=IC50 MCF-7/ADR/IC50 MCF-7。
1.2.2 MTT法测ADR及与PHⅡ-7联合应用的体外抗肿瘤活性 取3.0×104个/mL的对数生长期MCF-7/ADR细胞,接种于96孔培养板中,每孔160 μL,加入20 μL不同浓度的ADR(0~350 μmol/L)和20 μL固定浓度的PHⅡ-7(0.5、1和2 μmol/L)或10 μmol/L维拉帕米,其余操作同上,实验重复3次计算平均IC50值,并计算耐药逆转倍数(fold-reversal of MDR)。耐药逆转倍数由逆转倍数由单独应用ADR时MCF-7/ADR细胞IC50值除以与PHⅡ-7(或维拉帕米)合用时MCF-7/ADR IC50值计算得到:耐药逆转倍数=IC50ADR/ IC50(ADR+PHⅡ-7或维拉帕米)。
1.2.3 细胞凋亡测定 对数生长期的MCF-7、MCF-7/ADR细胞,经2 μg/mL(7.5 μmol/L)PHⅡ-7处理12 h后,参照Annexin V /PI双染凋亡试剂盒操作说明书操作。0.25%胰酶消化制成单细胞悬液,用100 μL Binding buffer将待测细胞的密度调整为5 × 105~1 ×106个细胞悬液,加入5 μL Annexin V-FITC标记液和5 μL PI,轻轻混匀。避光室温染色15 min,400 μL Binding buffer重悬细胞,流式细胞仪(FACS calibur,BD)测定各组细胞发生凋亡的百分数。
1.2.4 逆转录PCR(reverse transcription PCR,RT-PCR)和实时荧光定量PCR(real time PCR)检测mdr1基因的表达水平
1.2.4.1 引物设计与合成 根据GenBank数据库提供的多药耐药基因1(multidrug resistance gene1,mdr1)基因序列信息,采用Premier5.0软件设计特异性引物,经BLAST分析,由Invitrogen公司合成。β-actin引物为:上游5’-CTACAA TGAGCTGCGTGTGGC-3’;下游5’-CAGGTCCAGACGCAGGATGGC-3’;片段长271 bp。mdr1引物为:上游5’-ATAATGCGACAGGAGATAGG-3’;下游5’-TTGCCATTGACT GAAAGAAC-3’,片段长度为133 bp。
1.2.4.2 RNA提取和cDNA合成 接种2.5×105个/mL的MCF-7/ADR细胞于6孔板中,每孔2 mL,用不同浓度的PHⅡ-7处理12 h后收集细胞,用TRIzol试剂提取细胞总RNA。获得的总RNA用20 μL DEPC水溶解。紫外吸收法测定总RNA在吸光度260 nm和280 nm处吸收值,以计算其浓度和纯度。取总RNA 2 μg,按Invitrogen公司MMLV First Strand cDNA Synthesis Kit说明书合成cDNA,-20 ℃保存备用。
1.2.4.3 反转录PCR检测mdr1基因的表达水平PCR扩增条件为94 ℃ 1 min,55 ℃ 1 min,72℃ 50 s, 共30个循环。PCR产物经1.5%琼脂糖凝胶电泳分离目的条带和内参,条带经紫外显色灰度扫描,半定量检测MCF-7/ADR细胞系中mdr1基因表达水平的改变。
1.2.4.4 实时定量PCR检测mdr1基因的表达水平 采用Bio-Rad IQTM5仪进行测定。内参照GAPDH和mdr1的PCR反应体系均为20 μL,上下游引物(10 μmol/L)各0.5 μL,cDNA(稀释5倍)1 μL,2×SYBR premixture 10 μL,用ddH2O补至20 μL。反应条件为95 ℃ 10 min,95 ℃变性15 s,55 ℃退火1 min,共40个循环。各组设2个平行孔,反应结束后,设定阈值,软件输出Ct值。根据比较Ct值法公式 2-△△Ct,其中△△Ct=实验组(Ct目的基因-Ct管家基因)-对照组(Ct目的基因-Ct管家基因),获得不同组间相关基因表达比值。
1.2.5 细胞内Rhodamine123累积实验 取对数生长期的MCF-7/ADR细胞,经(0.5、2 μmol/L)PHⅡ-7或阳性逆转剂维拉帕米(10 μmol/L)处理24 h后收获。在含有1 mg/mL Rhodamine123的培养液中37 ℃条件下振荡温育60 min,预冷PBS洗涤细胞2遍;流式细胞仪(FACS calibur,BD)测定细胞内平均荧光强度(mean fluorescenceintensity,MFI),Ex 488 nm,Em 530 nm,观察PHⅡ-7对细胞内Rhodamine123含量的影响。
1.3 统计处理 用SPSS11.0统计软件对数据作处理,数据以表示,均数间比较采用t检验,多均数比较采用单因素方差分析。P<0.05表示差异有统计学意义。
2 实验结果
2.1 PHⅡ-7体外抗肿瘤活性 MCF-7和MCF-7/ADR细胞经不同浓度ADR(0~350 μmol/L)、PHⅡ-7(0~15 μmol/L)或二者联合作用72 h后,采用MTT比色法观察细胞生长抑制作用。结果显示,ADR对MCF-7/ADR细胞的IC50值是MCF-7细胞的近40倍,而PHⅡ-7对MCF-7和MCF-7/ADR细胞均有生长抑制作用,IC50值接近,分别为(6.07±0.85)和(5.51±1.22)μmol/L(表1)。低浓度PHⅡ-7与ADR联合化疗具有协同杀伤作用,与维拉帕米的逆转倍数54.68相比,2 μmol/L PHⅡ-7的逆转倍数达250.55,可明显提高ADR对MCF-7/ADR细胞的生长抑制作用(表2)。

表 1 ADR与PHⅡ-7单独使用对MCF-7和MCF-7/ADR细胞增殖的抑制作用Tab. 1 Inhibitory effect of ADR and PHⅡ-7 on proliferation of MCF-7 and MCF-7/ADR cells
2.2 PHⅡ-7对细胞凋亡的影响 用药物处理前,MCF-7与MCF-7/ADR细胞仅有少量出现凋亡,经2 μg/mL(7.5 μmol/L)PHⅡ-7处理12 h后,FITC-Annexin V/PI染色检测结果显示早期凋亡细胞明显增高(图2)。结合MTT实验结果,证实PHⅡ-7明显抑制MCF-7、MCF-7/ADR细胞的增殖,促使细胞凋亡。
2.3 PHⅡ-7对MCF-7/ADR mdr1基因的影响
PHⅡ-7对MCF-7/ADR mdr1基因的抑制作用非常明显(图3)。经从实时定量PCR相对定量结果看,0.5、1、2和4 μmol/L PHⅡ-7对mdr1的降低率依次为84.38%、98.35%、98.93%和100.00%,具有明显的浓度依赖性。
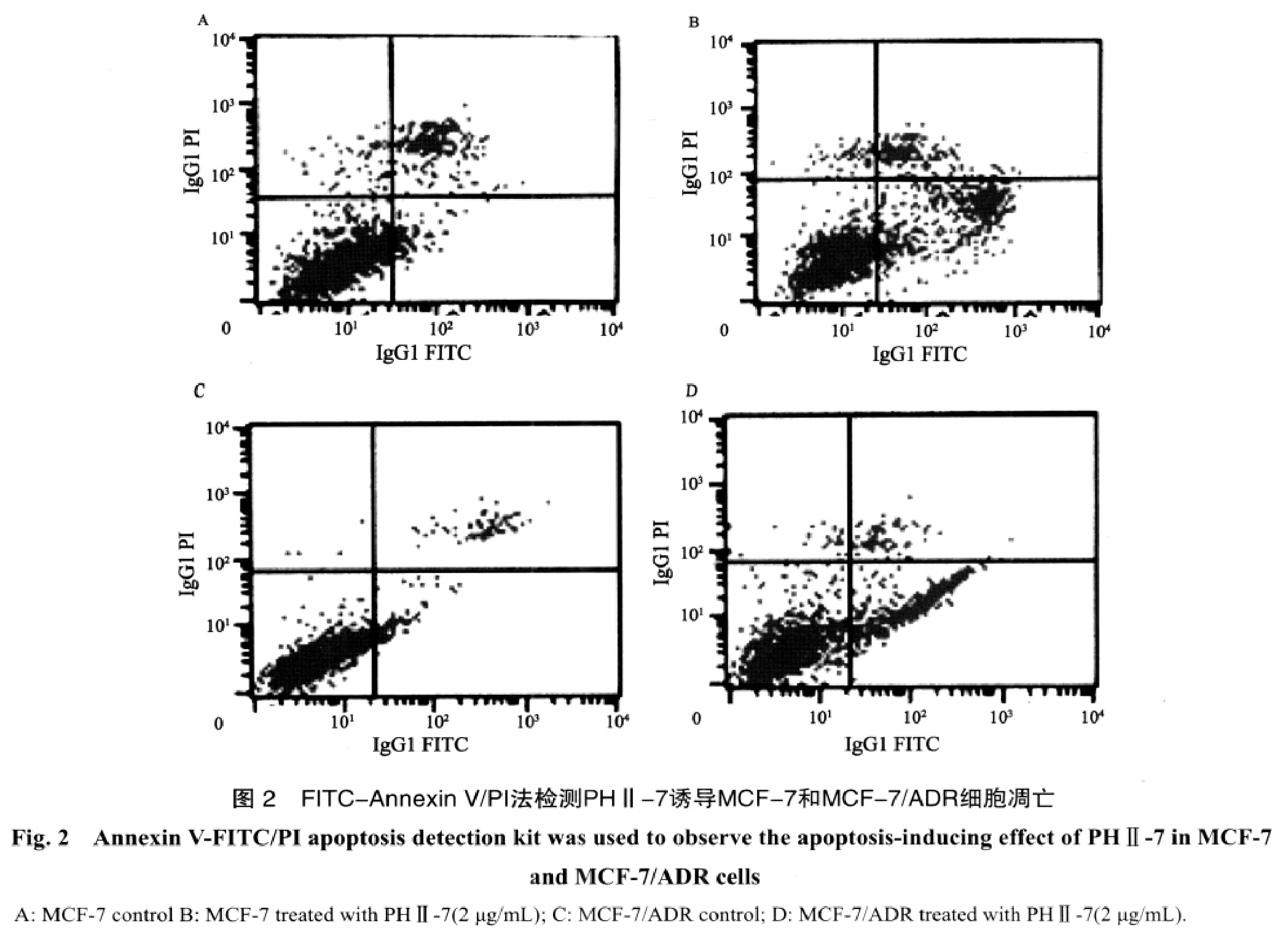

表 2 ADR与PHⅡ-7联合应用对MCF-7/ADR细胞增殖的抑制作用Tab. 2 Inhibitory effect of combined ADR with PHⅡ-7 on proliferation of MCF-7/ADR cells
2.4 PHⅡ-7对MCF-7/ADR细胞Rhodamine123蓄积功能的影响 与维拉帕米相似(图4A),经0.5和2 μmol/L PHⅡ-7处理后的MCF-7/ADR细胞, Rhodamine123荧光波峰右移,细胞内荧光明显增强(图4B);提示PHⅡ-7可抑制MCF-7/ADR细胞P-gp泵的外排功能,增加Rhodamine123在细胞内的蓄积。
3 讨 论
肿瘤细胞对某一化疗药物产生耐药后, 对其他化学结构及作用机制不同的化疗药物也可产生交叉耐药即为MDR。产生MDR的机制有多种,包括药物外排(P-gp、MRP、BCRP和LRP等)、酶介导的耐药机制(GST、Topo Ⅱ和PKC等)、细胞凋亡相关基因(Bcl-2过表达,p53基因突变等)、转录因子及其他因素。

由P-gp介导的药物外排是MDR产生的主要机制之一。P-gp属于ABC转运蛋白超家族,由多药耐药基因1(multidrug resistance gene1,mdr1)编码,是一种相对分子质量为170×103、具有能量依赖性“药泵”功能的跨膜糖蛋白,能将细胞内带阳性电荷的亲脂类化疗药物逆浓度泵至细胞外,使细胞内化疗药物达不到有效作用浓度而产生耐药性。这种由P-gp介导的多药耐药称为典型多药耐药(t-MDR)。因此研制能逆转mdr1/P-gp,并能通过多途径逆转多药耐药的新型抗癌药已成为当前肿瘤防治研究的热点。
靛玉红是中药当归龙荟丸的有效成分,除用于抗慢性粒细胞白血病外,近年研究发现对多种实体瘤也有杀伤作用[3-5]。但因其水溶性差并能引起胃肠道问题,限制了其临床应用。因此,开发疗效更强,不良反应更少的靛玉红衍生物成为研究热点。
基于靛玉红在化学结构属于氧化吲哚类这一事实,本研究设计合成了一系列氧化吲哚类衍生物:Ⅰ、Ⅱ和Ⅲ类。经构-效分析后最终筛选出抗癌作用最强毒性最低的化合物:PHⅡ-7。前期研究发现,PHⅡ-7可抑制多种人肿瘤细胞的生长,且对多药耐药肿瘤细胞同样有效[6]。本实验用乳腺癌多药耐药细胞株为研究对象,结果表明, PHⅡ-7单独应用可诱导乳腺癌细胞凋亡,当与多柔比星联合应用时,可大大提高MCF-7/ADR对其的敏感性。与阳性对照药维拉帕米相比,4 μmol/L PHⅡ-7具有非常强的逆转耐药功能,相当于维拉帕米的4.58倍。因多柔比星是P-gp的底物,因此,PHⅡ-7对多柔比星的增敏作用可能与P-gp有关。进一步的研究表明,经PHⅡ-7作用后,MCF-7/ADR细胞中mdr1 mRNA表达水平明显降低,P-gp外排泵功能抑制,细胞内Rhodamine123蓄积量明显增高,表明PHⅡ-7可逆转P-gp介导的多药耐药。
此外,研究表明,P-gp除其泵功能外,还可能直接或间接地参与细胞的分子代谢、增殖和分化等方面的调控,具有潜在的多种生理功能[7-8]。P-gp还可介导耐药细胞的凋亡抵抗。通过抑制激活Caspases来调节由多种因素诱发的细胞凋亡,特别是依赖激活Caspases的细胞凋亡途径[9-10]。这些发现为P-gp与凋亡在分子水平建立起了有机的联系。
本实验结果表明,PHⅡ-7可以显著抑制MCF-7/ADR细胞的增殖活性,并诱导其凋亡。而且与ADR联合作用,能明显增强ADR杀伤MCF-7/ADR细胞的能力,0.5、1和2 μmol/L的PHⅡ-7分别增加ADR杀MCF-7/ADR作用为21.48%、86.47%和99.60%。在诱导凋亡同时,PHⅡ-7可通过抑制P-gp表达和功能而逆转MCF-7/ADR耐药性。
综上所述,笔者认为,PHⅡ-7既可以诱导MCF-7/ADR细胞凋亡,又可降低mdr1基因表达,抑制P-gp外排泵功能,是一种通过多途径逆转多药耐药的新型抗癌药。
[1]Longley DB, Johnston PG. Molecular mechanisms of drug resistance[J]. J Pathol, 2005, 205(2): 275-92.
[2]Tan B, Piwnica-Worms D, Ratner L. Multidrug resistance transporters and modulation[J]. Curr Opin Oncol, 2000,12(5): 450-458.
[3]Damiens E, Baratte B, Marie D, et al. Anti-mitotic properties of indirubin-3’-monoxime, a CDK/GSK-3 inhibitor:induction of endoreplication following prophase arrest[J].Oncogene, 2001, 20(29): 3786-3797.
[4]Shi J, Shen HM. Critical role of Bid and Bax in indirubin-3'-monoxime-induced apoptosis in human cancer cells[J].Biochem Pharmacol, 2008, 75(9): 1729-1742.
[5]Marko D, Schätzle S, Friedel A, et al. Inhibition of cyclindependent kinase 1(CDK1) by indirubin derivatives in human tumour cells[J]. Br J Cancer, 2001, 84 (2): 283-289.
[6]谭耀红, 齐静, 刘卫军, 等. 抗耐药肿瘤新药PHⅡ-7作用机制的初步研究[J]. 中国医学科学院学报, 2002, 24 (2):134-139.
[7]Johnstone RW, Ruefli AA, Tainton KM, et al. A role for P-glycoprotein in regulating cell death[J]. Leuk Lymphoma, 2000, 38(1-2): 1-11.
[8]Pallis M, Turzanski J, Higashi Y, et al. P-glycoprotein in acute myeloid leukaemia: therapeutic implications of its association with both a multidrug-resistant and an apoptosis-resistant phenotype[J]. Leuk Lymphoma, 2002, 43(6): 1221-1228.
[9]Li YC, Fung KP, Kwok TT, et al. Mitochondria-targeting drug oligomycin blocked P-glycoprotein activity and triggered apoptosis in doxorubicin-resistant HepG2 cells[J].Chemotherapy, 2004, 50(2): 55-62.
[10]Levchenko A, Mehta BM, Niu X, et al. Intercellular transfer of P-glycoprotein mediates acquired multidrug resistance in tumor cells[J]. Pruc Natl Acad Sci USA, 2005, 102(6):1933-1938.
In vitrocytotoxity and reversal effects of PHⅡ-7 in human multidrug-resistant breast cancer MCF-7/ ADR cells
SHI Rui-zan, ZHANG Xiu-li, YANG Ming, ZHANG Yan-jun, PENG Hong-wei, REN Simei, LIN Yang, LIU Rong, LI Wei, XIONG Dong-sheng(State Key Laboratory of Experimental Hematology, Institute of Hematology and Hospital of Blood Diseases, Chinese Academy of Medical Sciences & Peking Union Medical College, Tianjin 300020, China)
XIONG Dong-sheng E-mail:dsxiong@hotmail.com
Background and purpose:Multidrug resistance (MDR) is one of the major causes of progressive breast cancer chemotherapy failure. One of the major mechanisms of MDR is the overexpression of P-glycoprotein(P-gp). Therefore, the identification of novel agents which can inhibit the drug transporter function of P-gp or its expression is of utmost interest in cancer research. The aim of this study was to explore the antitumor and reversal effect of PHⅡ-7, natural products from traditional Chinese medicine (TCM).Methods:The cytotoxicity of PHⅡ-7 alone and combined application of PHⅡ-7 and adriamycin (ADR) on breast cancer cells were determined using MTT assay. Annexin V–FITC/PI apoptosis detection kit was used to observe the apoptosis-inducing effect of PHⅡ-7 in MCF-7 and MCF-7/ADR cells. The effect of PHⅡ-7 on mdr1 mRNA was determined by reverse transcription PCR and real time PCR, fl ow cytometer was used to measure the intracellular ADR accumulation.Results:PHⅡ-7 alone inhibited cell growth of MCF-7 and MCF-7/ADR cells with the IC50(6.07±0.85), (5.51±1.22)μmol/L, respectively when combined with ADR, PHⅡ-7 enhanced the cytotoxicity of ADR toward MCF-7/ADR cells. In addition, PHⅡ-7 induced apoptosis both on MCF-7 and MCF-7/ADR cells; PHⅡ-7 reversed the drug resistance to ADR in MCF-7/ADR cells by inhibiting mdr1 mRNA transcription and increasing the intracellular ADR accumulation.Conclusion:PHⅡ-7 displayed significant anti-proliferative and apoptosis-inducing effect on sensitive and multidrug resistant breast cellsin vitro. PHⅡ-7 reversed effectively MDR by blocking the drugs to be pumped out by inhibiting P-gp expression and function pathway.
PHⅡ-7; multidrug resistance; mdr1; P-gp; reverse resistance
R737.9
A
1007-3639(2010)05-0321-06
国家自然科学基金资助项目(No:30873091)。
熊冬生 E-mail:dsxiong@hotmail.com
2010-01-06
2010-02-23)
