COX-2及VEGF蛋白在大鼠乳腺癌骨移植瘤中的表达及意义
2010-05-28王日雄施烯林学德林建华
王日雄 施烯 林学德 林建华
福建医科大学附属第一医院化疗科,△骨肿瘤科,福建 福州350004
COX-2及VEGF蛋白在大鼠乳腺癌骨移植瘤中的表达及意义
王日雄 施烯 林学德 林建华
福建医科大学附属第一医院化疗科,△骨肿瘤科,福建 福州350004
背景与目的:随着对生物学预后因子研究的不断深入,乳腺癌预后指标的联合检测和应用,能更有效、准确地估计患者的预后,并有助于指导乳腺癌的个体化治疗。本研旨在探讨究环氧化酶-2(cyclooxygenase-2,COX-2)及血管内皮生长因子(vascular endothelial growth factor,VEGF)蛋白对大鼠乳腺癌骨转移发生、发展的意义。方法:建立大鼠乳腺癌骨移植模型,观察正常组织及建模后肿瘤组织影像学、组织学变化,并检测COX-2、VEGF蛋白表达。结果:随着建模时间的延长,胫骨X线摄片及组织学显示肿瘤细胞向外侵蚀破坏骨皮质逐渐加强,COX-2、VEGF蛋白在肿瘤组织中表达的程度也逐渐增强,在正常组织及建模后第7、14和21天光密度值反映的表达量分别为916±258、1 694±497、4 304±890和7 111±1 069;930±268、1 944±396、3 226±819和4 746±1 032,两两比较差别均有显著的统计学意义(P<0.01)。结论:乳腺癌局部高表达COX-2蛋白可促进肿瘤细胞增殖,并通过上调VEGF蛋白水平,促进大鼠乳腺骨转移癌的发生和发展。
乳腺肿瘤; 骨转移; 环氧化酶-2; 血管内皮生长因子
环氧化酶-2(cyclooxygenase-2,COX-2)在多种肿瘤组织中表达增强,是肿瘤防治的新靶点,主要参与恶性肿瘤的发生发展的过程,其过度表达与肿瘤新生血管的形成有关[1-2]。另有许多因子参与肿瘤的血管生成,而其中最重要的是血管内皮生长因子(vascular endothelial growth factor,VEGF)。本研究通过对MRMT-1大鼠乳腺癌细胞建立的大鼠乳腺癌骨移植模型,对各时间段骨移植模型中COX-2、VEGF蛋白表达水平进行检测,探讨其在大鼠乳腺癌骨转移中发生、发展的意义。
1 材料和方法
1.1 主要试剂和材料 50只雌性SD大鼠,鼠龄2个月,体质量(200±10)g, 购自上海斯莱克实验动物有限责任公司;MRMT-1大鼠乳腺癌细胞购自中国科学院上海生命科学研究院;COX-2、VEGF抗体及鼠抗因子抗体购自Santa Cruz公司。
1.2 大鼠骨移植模型建立 按Medhurst等[3]报道的方法建立大鼠骨移植模型。50只雌性SD 大鼠,麻醉后,在胫骨上段皮肤切开 1 cm小口, 先用 10 mL注射器针头穿刺打孔,然后换上10 μL注射器进入骨髓腔,缓慢注入3 μL含3×103个MRMT-1大鼠乳腺癌细胞的细胞悬液,骨蜡封住针孔,皮肤缝合。所有动物都自由取食饮水。
1.3 标本检测 分别于造模后第7、14和21天X线拍摄胫骨近端,随后颈椎脱位处死大鼠,取近端胫骨,用4%甲醛溶液固定48 h,15%EDTA(pH=6.5)脱钙2周,乙醇梯度脱水,二甲苯透明,石蜡包埋切片。
1.4 免疫组织化学SP法检测COX-2和VEGF蛋白表达 4 μm 石蜡切片,二甲苯常规脱蜡,乙醇梯度水化,3%H2O2和枸椽酸高压修复抗原,非免疫性羊血清室温封闭30 min,弃上清液,滴加COX-2、VEGF,湿盒内 4 ℃冰箱反应过夜,PBS冲洗,滴加二抗,PBS冲洗,DAB 显色,苏木素对比复染,脱水,二甲苯透明处理,中性树胶封固,光学显微镜下观察并拍照。结果判断采用计算机光密度分析,每张切片随机取5个视野,用平均光密度值表示COX-2 和VEGF蛋白表达量。
1.5 统计处理 采用SPSS 10.0软件进行统计分析。两组间均数比较采用t检验,多组均数比较采用单因素方差分析,LDS检验,以P<0.05为差异有统计学意义,P<0.01为差异有显著的统计学意义。
2 结 果
2.1 骨转移大鼠模型的建立 接种雌性SD大鼠50只,48只发生骨转移,另外2只没有骨转移的大鼠未见其他部位转移,成瘤率96.0%,成瘤时间为细胞移植后第 7~16天,集中在12~14天,在实验期内,大鼠未出现死亡。
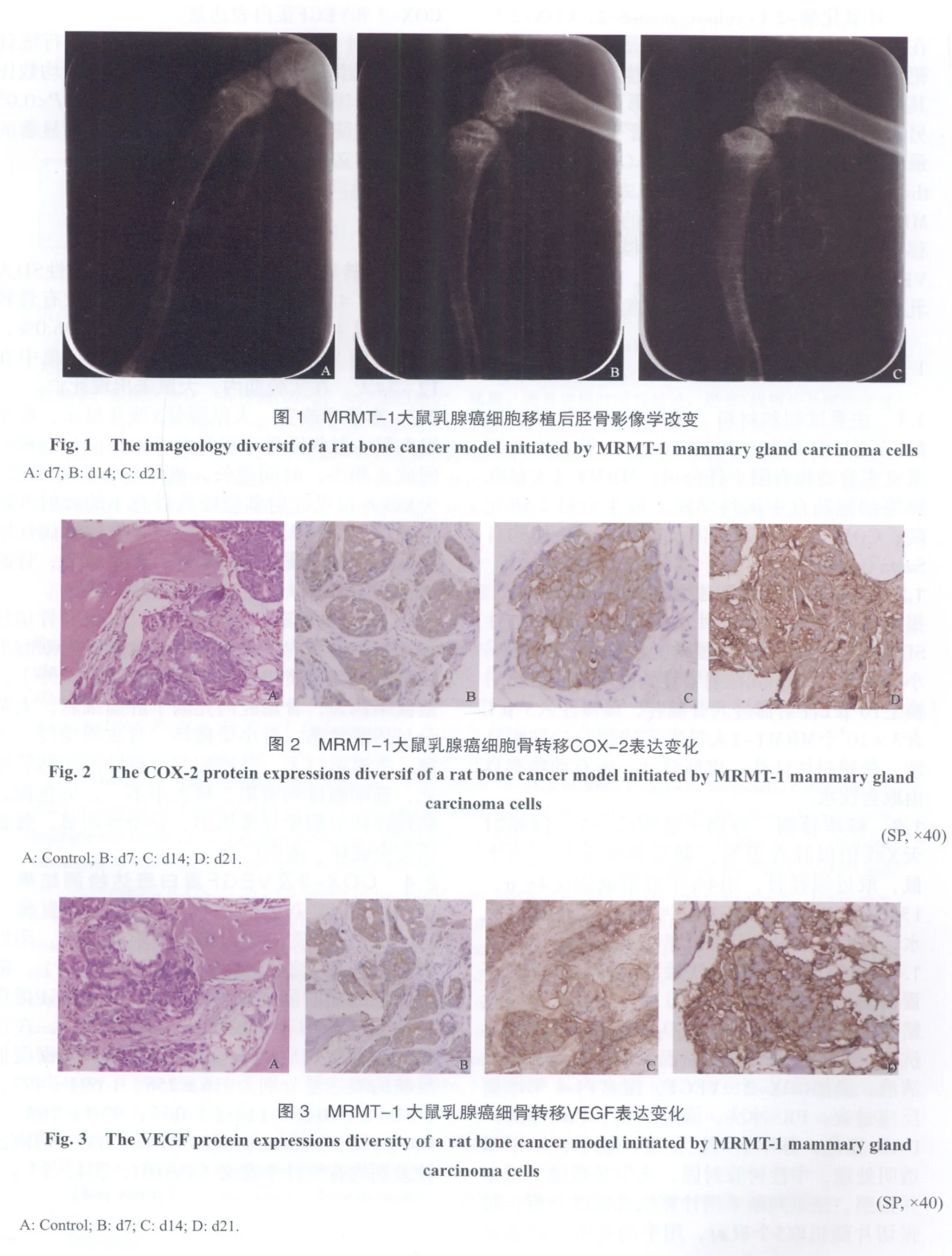
2.2 影像学改变 大鼠胫骨X线片显示,模型组大鼠注射侧胫骨出现骨破坏的程度与造模时间成正相关,时间越长,破坏越重。造模第7天X线片仅见注射部位松质骨有小的放射性缺损病灶;第14天,X线示松质骨放射性病灶增多,同时骨皮质有缺损病灶;到第21天,骨破坏进一步加重,骨皮质完全缺失(图1)。
2.3 组织学观察 造模第7天,大鼠胫骨切片显示,骨髓腔内及骨小梁间见大量肿瘤细胞生长活跃,骨皮质仍完整(除穿刺小缺口外)。造模第14天,骨髓腔内充满了肿瘤细胞,大部分呈活跃状态,骨小梁破坏,骨皮质受侵、变薄。造模第21天,骨髓腔完全被肿瘤细胞所填充,癌细胞排列密集,核大小不一,染色深,病理性核分裂象异常增多,异型性明显,骨皮质完全破坏、范围广泛。
2.4 COX-2及VEGF蛋白表达检测结果COX-2正常染色部位在细胞质和细胞膜,VEGF在细胞质、细胞膜和细胞外基质,阳性细胞为淡黄-棕黄色颗粒着色(图2,3)。随着大鼠成瘤时间的推移,COX-2、VEGF蛋白在肿瘤组织中表达的程度也逐渐增强,在正常组织及建模后第7、14和21天时,光密度值反映的表达量分别为916±258、1 694±497、4 304±890和7 111±1 069;930±268、1 944±396、3 226±819和4 746±1 032,两两比较差别均有统计学意义(P<0.01,图4,5)。

3 讨 论
乳腺癌的侵袭、转移是一个多因素调控和多步骤发展的极其复杂的过程。大量研究证明乳腺癌组织中COX-2高表达[4-5]。乳腺癌中COX-2过表达可通过促进新生血管生成、促进肿瘤细胞增殖、抑制凋亡、促进播散潜能等,从而促进恶性肿瘤发生发展[6]。Hu等[7]研究发现,COX-2过表达可以促进乳腺导管内原位癌发展成为侵袭性乳腺癌。Liu等[8]提供了确切的证据,COX-2过表达足可以诱导转基因小鼠乳腺癌的形成。本研究应用放射学和组织学的方法对肿瘤引起的骨破坏程度进行了评估和观察。结果发现,随着建模时间的延长,胫骨骨质破坏程度渐加重,骨转移癌进展,COX-2在肿瘤组织中表达的程度逐渐增强,在正常组织及建模后第7、14和21天,表达率两两比较差别均有统计学意义(P<0.01),说明COX-2可促进大鼠乳腺癌骨转移的发生、发展。
VEGF是近年来发现的与实体瘤生长和转移关系最为密切的血管形成调节因子,且与COX-2有共表达的现象[9]。研究证实VEGF可作为一种可扩散的血管内皮细胞特异性有丝分裂原,由肿瘤细胞产生,并以旁分泌形式刺激乳腺癌血管生成,间接促进乳腺癌的发生发展。体外实验证明乳腺癌中COX-2过表达可促进肿瘤细胞增殖、抑制凋亡,并通过上调VEGF水平促进新生血管生成,从而促进恶性肿瘤发生发展[10]。本研究结果发现随着骨转移癌的发生、发展,COX-2表达水平增高,VEGF表达也随着增高,说明COX-2可上调VEGF水平,从而促进新生血管生成,促进骨转移癌进展。
本研究结果证明,乳腺癌局部高表达COX-2可促进肿瘤细胞增殖,并通过上调VEGF水平,促进肿瘤血管生成,并促进大鼠乳腺骨转移癌发生、发展。
[1]Fujiwaki R, Iida K, Kanasaki H, et al. Cyclooxygenase-2 expression in endometrial cancer: correlation with microvessel count and expression of vascular endothelial growth factor and thymidine phosphorylase[J]. Hum Pathol, 2002, 33(2):213-219.
[2]Costa C, Soares R, Reis-Filho JS, et al. Cyclooxygenase-2 expression is associated with angiogenesis and lymph node metastasis in human breast cancer[J]. J Clin Pathol, 2002,55(6): 429-434.
[3]Medhurst SJ, Walker K, Bowes M, et al. A rat model of bone cancer pain[J]. Pain, 2002, 96(1-2): 129.
[4]项红兵, 肖建斌, 招伟贤, 等. 大鼠乳腺癌细胞移植复制胫骨癌痛模型[J].中华实验外科杂志, 2006, 23(8): 1015-1016.
[5]Saito O, Aoe T, Yamamoto T, et al. Analgesic effects of nonsteroidal antiinflammatory drugs, acetaminophen, and morphine in a mouse model of bone cancer pain[J]. J Anesth, 2005, 19(3): 218-224.
[6]Howe LR, Subbaramaiah K, Brown AM, et al.Cyclooxygenase-2: A target for the prevention and treatment of breast cancer[J]. Endocr Relat Cancer, 2001, 8(2): 97.
[7]Hu M, Peluffo G, Polyak K, et al. Role of COX-2 in epithelialstromal cell interactions and progression of ductal carcinoma in situ of the breast[J]. Proc Natl Acad Sci USA, 2009,106: 3372-3377.
[8]Liu CH, Chang SH, Narko K, et al. Overexpression of cyclooxygenase-2 is sufficient to induce tumorigenesis in transgenic mice[J]. J Biol Chem, 2001, 267(21): 18563-18569.
[9]Tawfik OW, Kramer B, Shideler B, et al. Prognostic significance of CD44, platelet-derived growth factor receptor a1pha, and cyclooxygenase-2 expression in renal cell carcinoma[J]. Arch Pathol Lab Med, 2007, 131(2): 261-267.
[10]Basu GD, Pathangey LB, Tinder TL, et al. Mechanisms underlying the growth inhibitory effects of the cyclooxygenase-2 inhibitor celecoxib in human breast cancer cells[J].Breast Cancer Res, 2005, 7: 4222-4225.
Expressions of COX-2 and VEGF on a rat model of bone cancer initiated by MRMT-1 mammary gland carcinoma cells and its significance
WANG Ri-xiong,SHI Xi,LIN Xue-de,LIN Jian-hua(Department of Medical Oncology And Department of Bone Oncology, The First Affiliated Hospital of Fujian Medical University, Fuzhou Fujian 350004, China)
LIN Jian-hua E-mail:riongwang@163.com
Background and purpose:With further research of some prognostic biofactors, especially the study of combined detection and application of several biofactors and its combination with the clinic, the prognosis estimation in breast cancer has been made more efficient and accurate. This information is also helpful to individualized treatments in breast cancer. This study examines the expressions of the vascular endothelial growth factor (VEGF) and cyclooxygenase-2 (COX-2) on a rat model of metastatic bone mammary gland cancer and evaluates the significance of this tumor invasion and metastasis.Methods:The rat model of metastatic bone cancer was initiated by intra–tibial inoculations of the MRMT-1 rat’s mammary gland carcinoma cells in Sprague-Dawley rats. After establishing the model, segments of metastatic bone cancer were extracted to detect COX-2 and VEGF protein expression through the immunohistochemical SP method and the bone structural damage, respectively, and were monitored by radiological analysis and histology.Results:Seven, fourteen and twenty one days after establishing the model, X-ray and histology showed that tumor destroyed the bone more severely. The expressions of COX-2 and VEGF protein were 916±258,1 694±497, 4 304±890, 7 111±1 069, 930±268, 1 944±396, 3 226±819 and 4 746±1 032 (P<0.05) respectively in the normal tissue 7, 14 and 21 days after establishing the model.Conclusion:A high expression of COX-2 in metastatic bone mammary gland cancer stimulates the proliferation of mammary gland cancer cells. COX-2 advances the level of VEGF to make the tumor angiogenesis and progression.
breast cancer; bone metastatic; cyclooxygenase-2; vascular endothelial growth factor
R737.9
A
1007-3639(2010)05-0348-05
福建省卫生厅青年科研基金资助项目(项目编号:2006-2-11)。
林建华 E-mail:jianhual@126.com
2010-03-04
2010-04-26)
