多沙唑嗪光学异构体对高血脂家兔血脂水平的影响*
2010-05-24曹雪滨王荣英任雷鸣
曹雪滨,杨 梅,王荣英,任雷鸣
(1.河北医科大学药学院药理学研究室,石家庄 050017;2.中国人民解放军第二五二医院心内科,河北 保定 071000;3.河北医科大学第二附属医院急诊科,石家庄 050000)
多沙唑嗪(doxazosin,DOX)作为一种选择性α1受体阻断剂,不良反应少,安全性高,在国外已广泛用于治疗高血压和良性前列腺增生症,临床使用其消旋体(甲磺酸消旋多沙唑嗪((±)doxazosin,(±)DOX))。动物实验及临床研究均证明(±)DOX可拮抗去甲肾上腺素(noradrenaline,NA)对血管平滑肌的收缩作用。但是,曾有报道指出(±)DOX可能诱发头晕、血压过低和昏厥等不良反应。为了减轻(±)DOX的不良反应,科研人员对其光学异构体进行了研究。在DOX的分子中存在一个手性中心和一对光学异构体(甲磺酸左旋多沙唑嗪((-)doxazosin,(-)DOX)、甲磺酸右旋多沙唑嗪((+)doxazosin,(+)DOX))。有研究发现在兔胸主动脉和颈总动脉等血管,(-)DOX拮抗NA诱发血管收缩的pA2值显著小于(+)DOX,而两者对动物膀胱排尿压的作用相同,提示(-)DOX可能成为心血管副作用较小的治疗BPH/LUTS药物[1]。目前,国内外相关研究已经证实(±)DOX对患者的血脂产生有利影响[2]。但是,有关(±)DOX光学异构体对血脂的影响,国内外尚未见报道。本实验研究拟观察(±)DOX及其光学异构体对高血脂家兔血脂水平及动物死亡率的影响。进一步为(±)DOX光学异构体的开发利用奠定理论基础。
1 材料与方法
1.1 仪器、饲料、药品与动物
普通级雄性新西兰大耳白兔,体重1.5~2.5 kg,河北省实验动物中心提供。饲养于中国人民解放军第二五二医院动物实验中心(环境设施符合中华人民共和国卫生部实验动物二级标准)。高脂饲料组成:每100g普通兔饲料中含7.5 g蛋黄粉、1 g胆固醇和8 g猪油。日立7600-020全自动生物化学分析仪,日本日立公司制造;电子天平(JM10001),余姚纪铭称重校验设备有限公司;电子分析天平(FA2004),上海良平仪器仪表有限公司;LDZ5-2型离心机,北京医用离心机厂;可调定量移液器(5~50μl,50~ 100μl),瑞士产 ;TC 、TG 、HDL-C 、LDL-C 试剂盒:北京北化精细化学公司临床试剂分厂生产。(-)DOX、(+)DOX和(±)DOX,由华北制药集团新药研发公司提供。
1.2 药液配制
分别精确称取一定量的(-)DOX、(+)DOX和(±)DOX干燥粉末,加适量无菌双蒸水配制成1 mg/ml溶液。为了确保药物完全溶解,以上三种药物以无菌双蒸水定容后均超声20min;溶液储存于棕色瓶中,置阴暗、干燥处保存备用。每3-4日配制1次。
1.3 动物分组
选取健康雄性新西兰大耳白兔80只,随机选取10只饲以普通饲料,另外70只饲以高脂饲料(每日每只家兔给予100g高脂饲料,补足普通饲料)。高脂饲料喂养前,耳缘静脉取空腹血测血脂水平。高脂饲料喂养4周时,高脂饲料组家兔死亡22只。第4周末,由耳缘静脉取空腹血测血脂水平。48只高脂饲料组家兔中,血清TC低于10mmol/L的实验动物8只;其余40只家兔的血清TC水平超过 10mmol/L,可用于实验[3]。按照血清TC水平的高低,将40只家兔随机分为4组(n=10):高脂模型组、高脂模型+(-)DOX组、高脂模型+(+)DOX组以及高脂模型+(±)DOX组。普通饮食组10只动物存活良好,全部纳入实验。
1.4 动物饲养、给药及体重测定
于高脂饲料喂养第5周开始,高脂模型+(-)DOX组、高脂模型+(+)DOX组以及高脂模型+(±)DOX组均腹腔注射给予相应的药物(1.0mg/kg),每日上午给药 1次,给药容积1 ml/kg,每周给药7d,连续9周。普通饮食组和高脂模型组腹腔注射等容积无菌双蒸水代替药物。实验期间动物单笼喂养,自由饮水。每周称动物体重1次,根据新的体重调整给药剂量。分别于实验开始时(0周,高脂饲料喂养前)以及实验开始(高脂饲料喂养)后的第4周、7周、10周和13周末,由家兔耳缘静脉取空腹血用于血脂测定。实验结束时,动物禁食(不禁水)24h,以戊巴比妥钠(25 mg/kg)麻醉家兔后,颈动脉放血处死动物。
1.5 实验动物血脂测定
兔血样标本直接采集于促凝生化管中,常温静置3 h,置4℃冰箱保存24h后,离心15 min,分离血清。使用日立7600-020全自动生物化学分析仪检测血脂。总胆固醇(TC,mmol/L)、甘油三脂(TG,mmol/L)、高密度脂蛋白胆固醇(HDL-C,mmol/L)以及低密度脂蛋白胆固醇(LDL-C,mmol/L)的测定均采用酶法。
1.6 统计学处理
2 结果
2.1 (-)DOX、(+)DOX和(±)DOX对兔体重的影响
饲以高脂饮食前(0周)和给予(±)DOX及其光学异构体之前(4周),各组之间相比,家兔体重无显著差别(表 1)。连续给药3周、6周和9周时,各组之间相比,动物体重亦无显著差别(表1)。
与饲以高脂饮食前相比时,普通饮食组在第4~13周、高脂模型组第7~13周、高脂模型+(+)DOX组第4~13周、高脂模型+(±)DOX组第10~13周,家兔体重显著增长(P<0.05和 P<0.01);但是高脂模型+(-)DOX组动物体重无显著增长(表1)。
Tab.1 Effects of doxazosin andits enantiomerson body weight of the rabbits fed by an atherogenic diet for 13weeks(kg,,n=6~ 10)
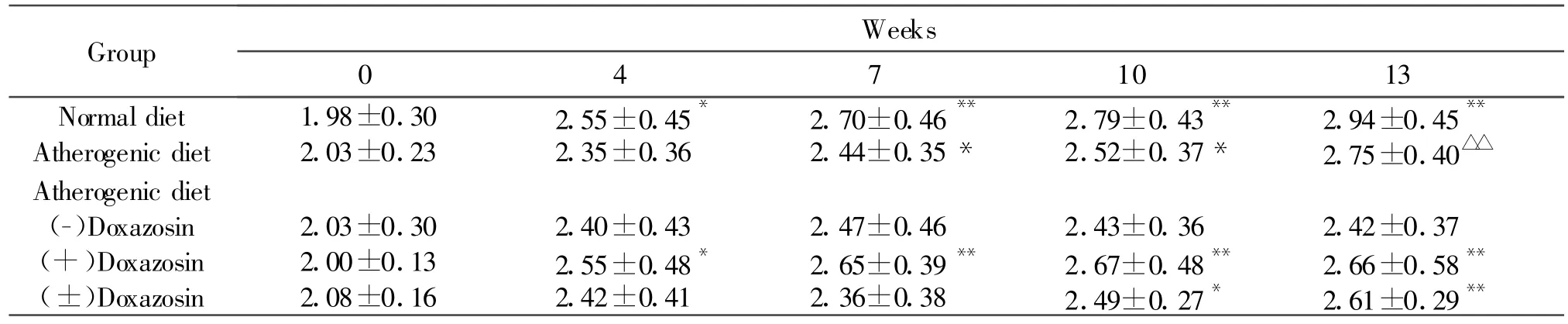
Tab.1 Effects of doxazosin andits enantiomerson body weight of the rabbits fed by an atherogenic diet for 13weeks(kg,,n=6~ 10)
Each rabbit at the beginning of experiments was fed a normal diet.Drug administrations began from the fifth week*P<0.05,**P<0.01 vs 0week
Group Weeks 04710 13 Normal diet 1.98±0.30 2.55±0.45* 2.70±0.46** 2.79±0.43** 2.94±0.45**Atherogenic diet 2.03±0.23 2.35±0.36 2.44±0.35* 2.52±0.37* 2.75±0.40△△Atherogenic diet(-)Doxazosin 2.03±0.30 2.40±0.43 2.47±0.46 2.43±0.36 2.42±0.37(+)Doxazosin 2.00±0.13 2.55±0.48* 2.65±0.39** 2.67±0.48** 2.66±0.58**(±)Doxazosin 2.08±0.16 2.42±0.41 2.36±0.38 2.49±0.27* 2.61±0.29**
2.2 (-)DOX、(+)DOX和(±)DOX对兔死亡率的影响
在13周实验过程中,普通饮食组家兔死亡1只,死亡率为10%;高脂模型组死亡4只,死亡率为40%;各给药组的死亡率在10%~30%范围内。尽管各给药组的动物死亡率与高脂模型组相比无统计学差异(P>0.05,表2),但是其各组的死亡率均低于高脂模型组,特别是高脂模型+(±)DOX组的死亡率与普通饮食组相同。

Tab.2 Effects of doxazosin and its enantiomers on survival rates of the rabbits fed by an atherogenic diet for 13weeks(n=10)
2.3 (-)DOX、(+)DOX和(±)DOX对兔血清脂质水平的影响
2.3.1 血清TC的变化 饲以高脂饮食前,各组之间相比,家兔血清总胆固醇(total cholesterol,TC)无明显差别(P>0.05,表3)。与普通饮食组相比,给予(±)DOX及其光学异构体之前以及连续给药3周、6周和9周时,各给药组血清TC含量明显升高(P<0.01,表3)。高脂模型+(-)DOX组、高脂模型+(+)DOX组以及高脂模型+(±)DOX组兔血清TC含量与高脂模型组相比,无显著差别(表3)。
与给予(±)DOX及其光学异构体之前相比,高脂模型组在第10~13周、高脂模型+(-)DOX组在第7~13周,家兔血清TC进一步显著升高(P<0.01,表3);但是高脂模型+(+)DOX组与高脂模型+(±)DOX组动物血清TC未进一步升高(表3)。
连续给药3周、6周和9周时,各给药组之间血清TC含量无显著差别(表3)。
Tab.3 Effects of doxazosin and its enantiomers on serum total cholesterol levels in the rabbits fed by an atherogenic diet for 13 weeks(mmol/L,,n=6~ 10)

Tab.3 Effects of doxazosin and its enantiomers on serum total cholesterol levels in the rabbits fed by an atherogenic diet for 13 weeks(mmol/L,,n=6~ 10)
Each rabbit at the beginning(0week)of experimentswas fed by a normal diet.Drug administrations began from the fifth week**P<0.01 vs atherogenic diet group;##P<0.01 vs the values before drug administration(4 weeks)
Group Weeks 04710 13 Normal diet 1.41±0.27 1.53±0.38** 1.44±0.66** 0.98±0.60** 1.13±0.47**Atherogenic diet 1.73±0.57 28.63±7.65 35.26±7.88 41.16±4.11## 40.83±3.90##Atherogenic diet(-)Doxazosin 1.40±0.36 29.08±9.09 41.10±5.07## 40.16±4.38## 40.29±5.35##(+)Doxazosin 1.51±0.53 30.58±7.57 36.55±6.00 37.16±4.74 37.45±8.80(±)Doxazosin 1.24±0.45 29.36±7.94 35.58±11.58 38.41±6.84 37.59±6.09
2.3.2 血清TG的变化 饲以高脂饮食前,各组之间相比,家兔血清甘油三脂(triglyceride,TG)无明显差别(P>0.05,表4)。与普通饮食组相比,给予(±)DOX及其光学异构体之前以及连续给药3周、6周和9周时,各给药组血清TG含量明显升高(P<0.01,表4)。各给药组兔血清TG含量与高脂模型组相比,无显著差别(P>0.05,表4)。
与给予(±)DOX及其光学异构体之前相比,普通饮食组家兔在第7~13周血清TG显著降低(P<0.05和 P<0.01,表4);但是,其他各组兔血清TG含量无显著变化(P>0.05,表4)。
连续给药3周、6周和9周时,各给药组之间血清TG含量无显著差别(P>0.05,表4)。
Tab.4 Effects of doxazosin and its enantiomers on serum triglyceride levels in the rabbits fed by an atherogenic diet for 13 weeks(mmol/L,,n=6~ 10)

Tab.4 Effects of doxazosin and its enantiomers on serum triglyceride levels in the rabbits fed by an atherogenic diet for 13 weeks(mmol/L,,n=6~ 10)
Each rabbit at the beginning(0week)of experimentswas fed by a normal diet.Drug administrations began from the fifth week*P<0.05,**P<0.01 vs atherogenic diet group;#P<0.05,##P<0.01 vs the values before drug administration(4 weeks)
Group Weeks 04710 13 Normal diet 1.86±0.81 1.25±0.29* 0.78±0.51**# 0.55±0.28**## 0.75±0.32**##Atherogenic diet 1.76±0.81 3.87±2.49 3.87±1.08 4.67±2.97 5.71±2.50Atherogenic diet(-)Doxazosin 1.70±0.99 5.24±3.87 5.27±2.06 5.79±3.75 5.16±2.86(+)Doxazosin 1.34±0.42 3.52±1.76 3.60±1.07 4.20±1.52 4.39±2.87(±)Doxazosin 1.87±0.56 4.10±2.43 3.60±2.06 3.95±1.42 4.88±1.91
2.3.3 血清HDL-C的变化 饲以高脂饮食前以及给予(±)DOX和两个光学异构体后,家兔血清高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)含量变化的组间比较结果与家兔血清TG变化的趋势相同。
与给予(±)DOX及其光学异构体之前相比,除(±)DOX连续给药第6周末的血清HDL-C呈显著下降外(P<0.05,表5),其他各组动物的血清HDLC变化趋势与血清TG的变化相同。
连续给药3周、6周和9周时,各给药组之间血清HDL-C含量无显著差别(P>0.05,表5)。
Tab.5 Effects of doxazosin and its enantiomers on serum HDL cholesterol levels in the rabbits fed by an atherogenic diet for 13 weeks(mmol/L,,n=6~ 10)
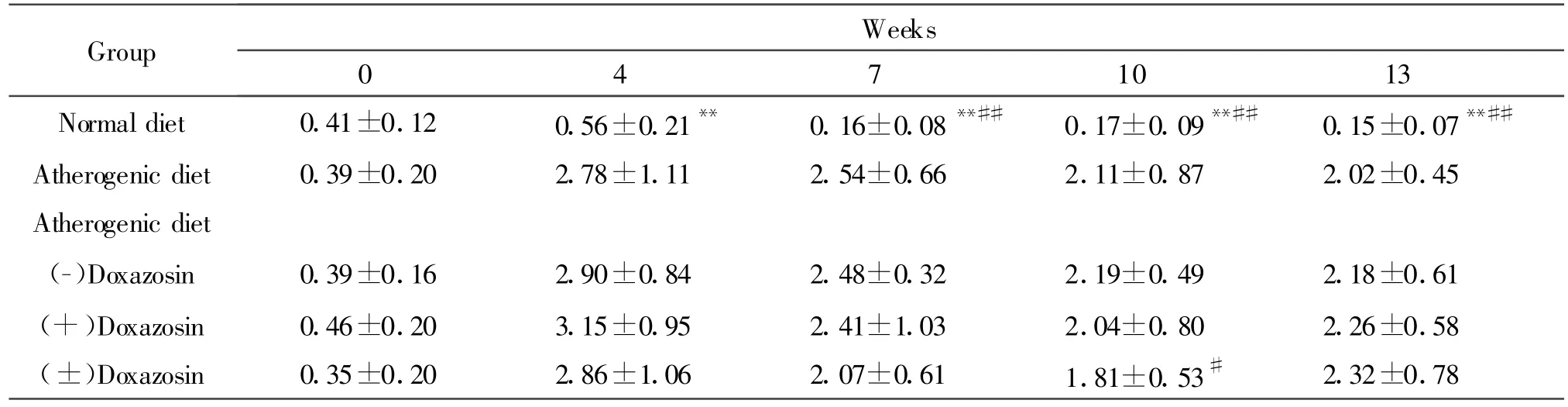
Tab.5 Effects of doxazosin and its enantiomers on serum HDL cholesterol levels in the rabbits fed by an atherogenic diet for 13 weeks(mmol/L,,n=6~ 10)
Each rabbit at the beginning(0week)of experimentswas fed by a normal diet.Drug administrations began from the fifth week**P<0.01 vs atherogenic diet group;#P<0.05,##P<0.01 vs the values before drug administration(4weeks)
Group Weeks 04710 13 Normal diet 0.41±0.12 0.56±0.21** 0.16±0.08**## 0.17±0.09**## 0.15±0.07**##Atherogenic diet 0.39±0.20 2.78±1.11 2.54±0.66 2.11±0.87 2.02±0.45 Atherogenic diet(-)Doxazosin 0.39±0.16 2.90±0.84 2.48±0.32 2.19±0.49 2.18±0.61(+)Doxazosin 0.46±0.20 3.15±0.95 2.41±1.03 2.04±0.80 2.26±0.58(±)Doxazosin 0.35±0.20 2.86±1.06 2.07±0.61 1.81±0.53# 2.32±0.78
2.3.4 血清LDL-C的变化 饲以高脂饮食前以及给予(±)DOX和两个光学异构体后,动物血清低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)含量变化的组间比较结果与血清TG变化的趋势相同。
与给予(±)DOX及其光学异构体之前相比,普通饮食组家兔在第7~13周血清LDL-C水平显著降低(P<0.01,表6);高脂模型组在第7~13周、高脂模型+(±)DOX组在第10周血清LDL-C显著升高(P<0.05和 P<0.01,表 6);但是,高脂模型+(-)DOX组以及高脂模型+(+)DOX组动物血清LDL-C含量无显著改变(P>0.05,表6)。
连续给药3周、6周和9周时,各给药组之间血清LDL-C含量无显著差别(P>0.05,表6)。
Tab.6 Effects of doxazosin and its enantiomers on serum LDL cholesterol levels in the rabbits fed by an atherogenic diet for 13 weeks(mmol/L,,n=6~ 10)

Tab.6 Effects of doxazosin and its enantiomers on serum LDL cholesterol levels in the rabbits fed by an atherogenic diet for 13 weeks(mmol/L,,n=6~ 10)
Each rabbit at the beginning(0week)of experimentswas fed by a normal diet.Drug administrations began from the fifth week**P<0.01 vs atherogenic diet group;#P<0.05,##P<0.01 vs the values before drug administration(4weeks)
Group Weeks 04710 13 Normal diet 0.52±0.21 0.74±0.34** 0.23±0.16**## 0.24±0.12**## 0.23±0.14**##Atherogenic diet 0.74±0.38 16.21±9.59 24.64±8.55# 25.39±4.19# 28.46±3.81##Atherogenic diet(-)Doxazosin 0.46±0.23 19.74±8.01 21.14±2.89 26.62±4.08 25.50±8.31(+)Doxazosin 0.71±0.38 19.71±8.35 20.81±4.65 24.08±6.49 23.88±5.87(±)Doxazosin 0.67±0.29 17.66±8.84 18.45±8.21 26.93±6.38# 25.50±6.70
3 讨论
目前,国内外相关研究已经证实(±)DOX可以对血脂产生有利影响[2]。(±)DOX能够有效降低血压,同时对血脂和血糖代谢也产生良好影响。对于合并脂质代谢障碍的高血压病患者,具有降低血压和改善血脂水平的双重效应。Hoogerbrugge等[4]报道,高血压伴高TC血症患者连续服用(±)DOX 3年,患者血清TG和LDL-C水平分别显著下降了13.7%和 30.1%,HDL-C水平则提高了25.7%;但是,双氢克尿噻组患者的血脂水平无显著性改变。最近,一项入组万余名患者的大规模心脏事件临床试验研究结果显示,(±)DOX作为三线抗高血压药物安全有效,同时具有轻度的降低血清TC、LDL-C和TG水平的作用[5]。
国外学者探索了(±)DOX改善血脂水平的作用机制。LDL的分解主要在肝外实质细胞中进行,细胞表面有LDL受体,LDL通过它的载脂蛋白 B(apolipoprotein B,Apo B)精氨酸残基与此受体结合。人体内每天降解的LDL为总量的45%,其中约有三分之二是通过LDL受体途径代谢。研究证实,在体外培养的皮肤成纤维细胞实验中,(±)DOX在10μmol/L具有增强LDL受体活性的作用[6]。在高胆固醇饲养的雄性仓鼠试验中,(±)DOX给药1周后,血浆胆固醇和肝脏胆固醇含量分别减少了12%和30%;同时发现,肝脏De novo胆固醇合成路径的胆固醇合成减少了39%;作者认为,(±)DOX可能通过抑制肝脏胆固醇合成而降低血浆胆固醇水平[7]。脂蛋白脂酶(lipoprotein lipase,LPL)是水解乳糜微粒(chylomicra,CM)和VLDL-C的关键酶,载脂蛋白CII(apolipoprotein CII,Apo CII)是LPL的辅酶;CM获得Apo C后可使LPL激活。有文献报道(±)DOX尚具有激活LPL的作用[8]。
(±)DOX对高血脂模型动物的研究报道较少。Wilson等[2]在高脂饲养的仓鼠动脉粥样硬化模型,用掺食法给予(±)DOX每日20mg/kg连续给药6个月。模型组仓鼠的血浆TC、TG、LDL-C和HDL-C水平显著升高;(±)DOX治疗组的血浆TC、TG和LDL-C水平显著降低,并能显著抑制主动脉脂质条纹的形成。国内曹俊杰等[9]采用高胆固醇饲养的兔高血脂模型,研究了连续28 d口服给予(±)DOX 4 mg/d的治疗作用,(±)DOX使兔血清TC水平明显降低,HDL-C水平明显升高。然而,Swindell等[10]连续9周口服给予(±)DOX 5 mg/d,对高血脂模型兔的血脂水平无任何影响。
本实验中,我们亦观察到与Swindell等[10]相似的研究结果。与高脂饮食对照组相比,(±)DOX连续腹腔注射给药3周、6周和9周对高血脂家兔的血清TC、TG、HDL-C和LDL-C水平无显著影响;(-)DOX和(+)DOX的作用与(±)DOX相同。但是,当以给药前(高脂饲养第4周末)的高血脂参数作为对照组时,模型组家兔随高脂饲养的时间延长,血清TC和LDL-C水平进一步显著升高;而(-)DOX、(+)DOX和(±)DOX处理组动物的血清LDL-C水平未显著升高,(+)DOX和(±)DOX处理组动物的血清TC水平亦未显著升高。研究结果提示,(-)DOX、(+)DOX和(±)DOX对高血脂家兔血清TC和LDLC紊乱具有轻度的改善作用。同时,我们的实验结果也表明,对于DOX改善人类血脂紊乱的研究而言,饵食性高血脂家兔可能不是理想的实验模型。实验中还发现,高脂模型组动物的死亡率较高,饲以高脂饮食13周时的死亡率可达40%,远远高于普通饮食组家兔(10%)。(±)DOX给药组家兔的存活率与普通饮食组相同,(-)DOX亦可提高高脂饮食家兔的生存率。此外,尽管(+)DOX改善家兔血脂紊乱的作用略优于(-)DOX,但是(+)DOX对高脂饮食诱发家兔死亡似乎没有明显的保护效果。实验中,我们注意到普通饮食组家兔在3个月的饲养过程中,体重显著增长;同时,血清 TC、TG、HDL-C 和LDL-C水平随着饲养时间延长出现轻度但显著的降低。为了控制检测质量,我们在每批样品的测定过程中遵循单盲和随机化原则;每次测定过程中均随行建立标准曲线。正常家兔血清TC、TG、HDL-C和LDL-C水平随着饲养时间延长出现轻度下降的现象尚未见报道,其生理学意义有待探讨。
本研究结果提示,(-)DOX和(±)DOX可提高高脂饮食家兔的生存率,并对高血脂家兔的血清LDL-C紊乱具有轻度的改善作用。然而,(-)DOX和(±)DOX轻度改善家兔血脂紊乱的作用可能不是其提高高脂饮食家兔生存率的主要作用机制。
[1]Niu C Q,Zhao D,Jia X M,et al.α1-Adrenoceptor antagonist profile of doxazosin and its enantiomers in isolated rabbit blood vessels[J].Chin J Pharmacol Toxicol,2003,17(5):354-359.
[2]Wilson T A,Foxall T L,Nicolosi R J.Doxazosin,an alpha-1 antagonist,prevents further progression of the advanced atherosclerotic lesion in hypercholesterolemic hamsters[J].Metabolism ,2003,52(10):1240-1245.
[3]Clifton P M,Kestin M,Abbey M,et al.Relationship between sensitivity to dietary fat and dietary cholesterol[J].Arterioscler Thromb Vasc Biol,1990,10(3):394-401.
[4]Hoogerbrugge N,de Groot E,de Heide L H,et al.Doxazosin andhydrochlorothiazide equally affect arterialwall thickness in hypertensive males with hypercholesterolaemia(the DAPHNE study).Doxazosin Atherosclerosis Progression Study inHypertensives in the Netherlands[J].NethJ Med,2002,60(9):354-361.
[5]Chapman N ,Chang C L,Dahlöf B,et al.Effect of doxazosin gastrointestinal therapeutic system as third-line antihypertensive therapy on blood pressure and lipids in the angloscandinavian cardiac outcomes trial[J].Circulation,2008,118(1):42-48.
[6]LerenT P.Doxazosin increases low density lipoprotein receptor activity[J].Acta Pharmacol Toxicol(Copenh),1985,56(3):269-272.
[7]Jansen H,Lammers R,Baggen M G,et al.Inhibition of hepatic cholesterol synthesis by the alpha 1-adrenoceptor blocker doxazosin in the hypercholesterolemic golden hamster[J].Life Sci,1989,44(15):1013-1017.
[8]Pool J L.Effects of doxazosin on serum lipids:a review of the clinical dataand molecular basis for altered lipid metabolism[J].Am HeartJ,1991,121(1 Pt 2):251-259.
[9]曹俊杰,阚长利,卢竞前,等.多沙唑嗪控释片对血脂影响的实验研究[J].中国临床药理学杂志,2006,22(4):298.
[10]Swindell A C,Krupp M N,Twomey T M,et al.Effects of doxazosin on atherosclerosis in cholesterol-fed rabbits[J].Atherosclerosis,1993,99(2):195-206.
