SCH66336对胃癌细胞增殖和凋亡的影响及作用机制
2010-05-23刘安玲
刘安玲,郑 航
(1南方医科大学基因工程研究学院,广州510515;2南方医科大学附属南方医院)
最近研究发现,法尼基转移酶抑制剂(FTIs)可通过抑制促癌蛋白Ras的活性及细胞内其他靶分子,在多种肿瘤的治疗中有效[1]。但其对胃癌细胞的影响鲜见报道。2008年10月~2009年10月,我们观察了FTIs SCH66336(以下简称SCH)对胃癌细胞SGC-7901与MGC-803增殖、凋亡的影响,现探讨其作用机制。
1 材料与方法
1.1 材料 SCH购自Schering Plough Inc.(Kenilworth,NJ,U.S.A),以 DMSO 溶解。DMEM 培养基(含超级新生小牛血清)购自Gibco公司。Phospho-S6(S235/236)、活化的 Caspase-3、细胞周期素D1(cyclin D1)抗体购自Cell Signaling Technology;四氮唑蓝(MTT)是AMRESO产品;其余试剂均为国产分析纯。人胃癌细胞株SGC-7901与MGC-803购自上海细胞库。CO2培养箱;流式细胞仪。
1.2 实验方法
1.2.1 细胞培养及干预 用DMEM培养液于37℃、5%CO2条件下培养,每3 d传代1次。
1.2.2 SCH干预及细胞增殖抑制率检测 取对数生长期SGC-7901及MGC-803细胞,调整密度为2×105/ml,接种于96孔板中,12 h后分为两组,实验组加入SCH使终摩尔浓度分别为0.1、0.3、1.0、3.0 μM,阴性对照组加入等体积含DMSO的培养基,每组设3个复孔,分别培养36、72 h。按 MTT法测得A值,重复6次。计算肿瘤细胞生长抑制率(IR),IR=[(A对照组-A实验组)/A对照组]×100%。
1.2.3 SCH干预及细胞周期与凋亡率检测 将SGC-7901与MGC-803细胞接种于6孔板内。测定细胞周期时,按1.2.4处理方法加入SCH,48 h后收获细胞;测定细胞凋亡时,细胞置于DMEM培养基中,SCH处理24 h后收获细胞。染色后流式细胞术分析细胞周期,计算凋亡率。
1.2.5 SCH干预及S6磷酸化(S235/236)、cyclin D1与Caspase-3表达测定 参照文献[2],胃癌SGC-7901、MGC-803细胞接种于6孔板内,分别加入终浓度为 0.1、0.3、1.0、3.0 μM 的 SCH 处理细胞 24 h后,Western blot法检测 S235/236、Caspase-3、cyclin D1表达,并用Band Leade软件分析。
1.3 统计学方法 采用 SPSS 11.2统计软件。计量数据以±s表示,行单因子方差分析处理,组间比较采用Dunnett方法。检验水准α=0.05。
2 结果
2.1 SCH作用后胃癌细胞的生长抑制率 见表1。
2.2 SCH作用后胃癌细胞的细胞周期 见表2。
2.3 SCH作用24 h后胃癌细胞的细胞凋亡率 见表3。
2.4 SCH作用后胃癌细胞S235/236、cyclin D1与caspase-3表达 见表4。
3 讨论
表1 不同浓度SCH作用36、72 h后胃癌细胞的生长抑制率(%,±s)
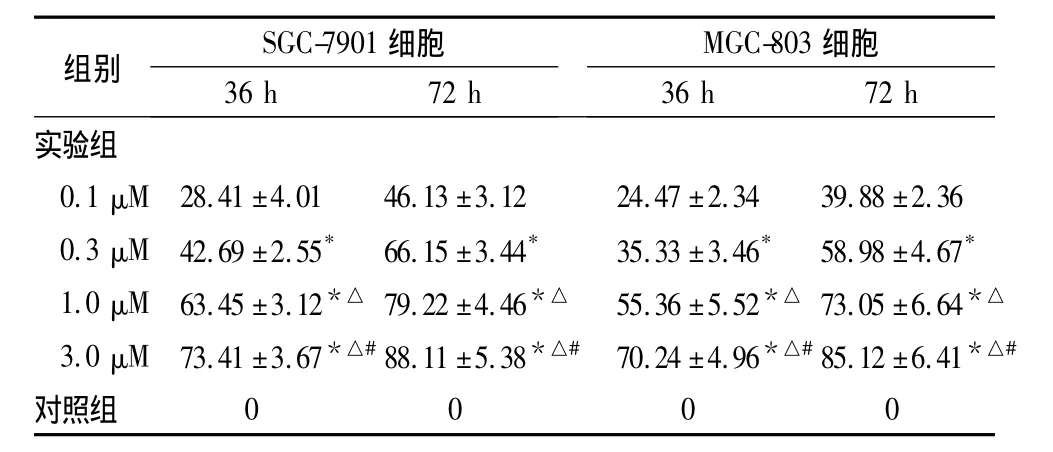
表1 不同浓度SCH作用36、72 h后胃癌细胞的生长抑制率(%,±s)
注:与0.1 μM 比较,*P <0.05;与 0.3 μM 比较,△P <0.05;与 1.0 μM比较,#P<0.05
SGC-7901MGC-803组别 细胞 细胞36 h 72 h 36 h 72 h实验组0.1 μM 28.41±4.01 46.13±3.12 24.47±2.34 39.88±2.36 0.3 μM 42.69±2.55* 66.15±3.44* 35.33±3.46* 58.98±4.67*1.0 μM 63.45±3.12*△ 79.22±4.46*△ 55.36±5.52*△ 73.05±6.64*△3.0 μM 73.41±3.67*△#88.11±5.38*△# 70.24±4.96*△#85.12±6.41*△#对照组0000
研究证实,Ras蛋白与肿瘤的发生发展关系密切,法尼基转移酶(FTase)是Ras蛋白加工过程中最重要的催化酶之一[3]。FTIs能够抑制肿瘤细胞的生长,同时对正常细胞无明显毒性[1],是一类新的信号传导抑制剂,对甲状腺癌、胰腺癌、肺癌、肠癌、肝癌等肿瘤细胞生长均有明显的抑制作用[1]。SCH是一个三环非肽类的FTIs,可与CAAX底物竞争FTase。本研究发现,SCH作用于胃癌细胞系SGC-7901与MGC-803后,呈时间与剂量依赖地抑制细胞的增殖,使这些细胞明显阻滞于G0/G1期。在低血清(0.1%)条件下,可诱导胃癌细胞凋亡;即SCH在体外对胃癌细胞有显著抑制作用。
表2 SCH作用48 h后胃癌细胞的细胞周期改变(%,±s)

表2 SCH作用48 h后胃癌细胞的细胞周期改变(%,±s)
注:与对照组比较,*P <0.05;与0.1 μM 比较,△P <0.05;与0.3 μM 比较,#P <0.05;与1.0 μM比较,▲P <0.05
组别 SGC-7901细胞G0/G1 S G2/M细胞G0/G1 S G2 MGC-803/M实验组0.1 μM 51.63±2.13* 36.71±1.15* 11.66±0.29 57.46±2.36* 28.32±1.27* 14.22±0.63 0.3 μM 57.02±2.74*△ 27.51±1.28*△ 15.47±0.54 58.81±2.78*△ 30.41±1.12*△ 10.78±0.46 1.0 μM 64.23±2.98*△# 22.75±1.08*△# 13.02±0.25 65.61±3.29*△# 25.94±1.26*△# 8.45±0.37 3.0 μM 65.21±3.12*△#▲ 23.37±1.14*△#▲ 11.42 ±0.47 68.33 ±3.21*△#▲ 18.76±0.87*△#▲ 12.91±0.55对照组 40.58±1.99 45.26±2.25 14.16±0.62 48.18±2.31 40.87±1.74 10.95±0.48
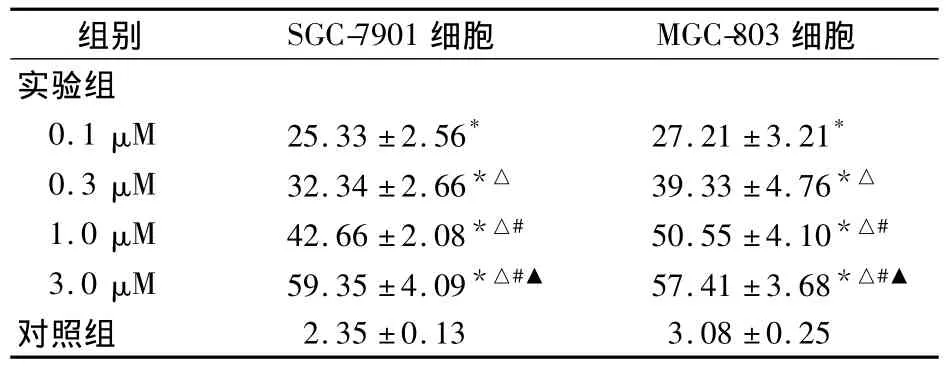
表3 SCH作用24 h后对胃癌细胞凋亡率(%)
表4 SCH作用48 h后胃癌细胞S235/236、cyclin D1与caspase-3表达(±s)
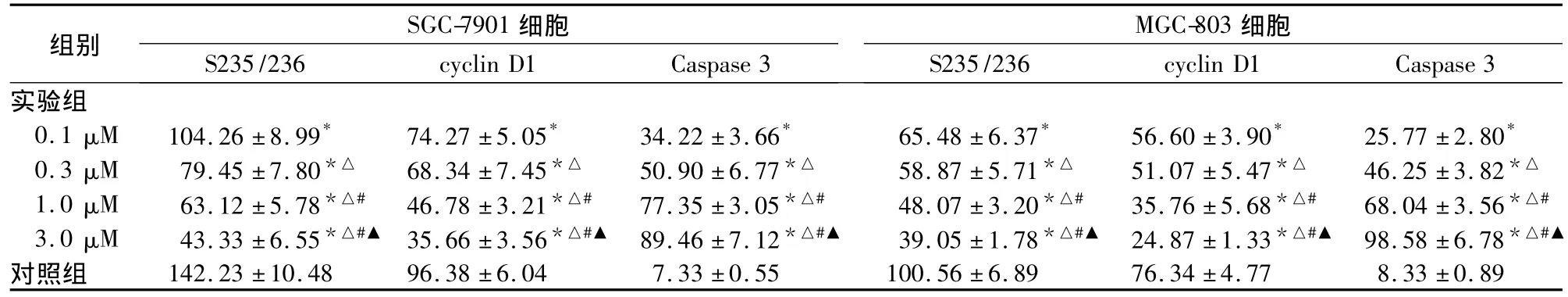
表4 SCH作用48 h后胃癌细胞S235/236、cyclin D1与caspase-3表达(±s)
注:与对照组比较,*P <0.05;与0.1 μM 比较,△P <0.05;与0.3 μM 比较,#P <0.05;与1.0 μM 比较,▲P <0.05
组别 SGC-7901细胞MGC-803细胞S235/236 cyclin D1 Caspase 3S235/236 cyclin D1 Caspase 3实验组0.1 μM 104.26±8.99* 74.27±5.05* 34.22±3.66* 65.48±6.37* 56.60±3.90* 25.77±2.80*0.3 μM 79.45±7.80*△ 68.34±7.45*△ 50.90±6.77*△ 58.87±5.71*△ 51.07±5.47*△ 46.25±3.82*△1.0 μM 63.12±5.78*△# 46.78±3.21*△# 77.35±3.05*△# 48.07±3.20*△# 35.76±5.68*△# 68.04±3.56*△#3.0 μM 43.33±6.55*△#▲ 35.66±3.56*△#▲ 89.46±7.12*△#▲ 39.05 ±1.78*△#▲ 24.87±1.33*△#▲ 98.58±6.78*△#▲对照组 142.23±10.48 96.38±6.04 7.33±0.55 100.56±6.89 76.34±4.77 8.33±0.89
对于FTIs的作用机理,目前认为其作用靶点除Ras外,还具有不依赖Ras的活性。其对缺乏Ras突变的某些肿瘤治疗有效,如对Ras突变率很低(不足2%)的乳腺癌有效[4]。这可能基于FTIs对与细胞信号转导通路有关的其他异戊烯化蛋白有作用。这类FTIs靶点蛋白有些已被证实,如核纤层蛋白 A(laminA)、小分子 GTPase Rho 以及 Rheb[5,6]。其中Rheb是哺乳动物雷帕霉素靶蛋白(mTOR)的上游活化分子,是细胞生长增殖的中心调控分子,可接受细胞内外的各种刺激如激素、生长因子、营养等调节蛋白质翻译、细胞生长增殖、存活等生理过程;而很多肿瘤的发生涉及mTOR信号的过度激活[7]。mTOR被Rheb激活后磷酸化S6激酶1(S6K1),后者磷酸化S6(S235/236)促进核糖体的发生及cyclin D1等蛋白质的翻译,以及细胞的生长增殖[8]。本研究发现,SCH能下调胃癌细胞S235/236及cyclin D1表达,这与其引起胃癌细胞G0/G1期阻滞及抑制增殖的作用是一致的。此外,SCH还具有诱导活化的Caspase-3表达及胃癌细胞凋亡的作用。
综上所述,SCH对胃癌细胞有明显抑制增殖与诱导凋亡的作用。机制可能为抑制Rheb/mTOR/S6信号,降低cyclin D1表达及诱导Caspase-3活化。
[1]Adjei AA.An overview of farnesyltransferase inhibitors and their role in lung cancer therapy [J].Lung Cancer,2003,41(Suppl 1):55-62.
[2]Bai X,Ma D,Liu A,et al.Rheb activates mTOR by antagonizing its endogenous inhibitor,FKBP38 [J].Science,2007,318(5852):977-980.
[3]Bos JL.Ras oncogenes in human cancer:a review [J].Cancer Res,1989,49(17):4682-4689.
[4]O'Regan RM,Khuri FR.Farnesyl transferase inhibitors:the next targeted therapies for breast cancer [J].Endocr Relat Cancer,2004,11(2):191-205.
[5]Oh SH,Jin Q,Kim ES,et al.Insulin-like growth factor-I receptor signaling pathway induces resistance to the apoptotic activities of SCH66336(lonafarnib)through Akt/mammalian target of rapamycin-mediated increases in survivin expression [J].Clin Cancer Res,2008,14(5):1581-1589.
[6]Mavrakis KJ,Zhu H,Silva RL,et al.Tumorigenic activity and therapeutic inhibition of Rheb GTPase[J].Genes Dev,2008,22(16):2178-2188.
[7]Laplante M,Sabatini DM.mTOR signaling at a glance[J].J Cell Sci,2009,122(Pt 20):3589-3594.
[8]Basso AD,Mirza A,Liu G,et al.The farnesyl transferase inhibitor(FTI)SCH66336(lonafarnib)inhibits Rheb farnesylation and mTOR signaling.Role in FTI enhancement of taxane and tamoxifen anti-tumor activity[J].J Biol Chem,2005,280(35):31101-31108.
